
探讨果糖二磷酸醛缩酶A(ALDOA)在急性髓系白血病(AML)患者骨髓中的表达及其与患者临床特征和预后之间的关系。
收集2013年1月至2015年12月郑州大学第一附属医院及郑州大学附属儿童医院90例AML(非急性早幼粒细胞白血病)患者(AML组)及18例异基因造血干细胞移植供者(正常对照组)骨髓标本,应用实时荧光定量聚合酶链反应(qRT-PCR)检测ALDOA mRNA相对表达量。对患者临床资料进行回顾性分析,根据疗效与随访结果将患者分为持续完全缓解组和难治复发组。分析AML组与正常对照组及持续完全缓解组与难治复发组之间ALDOA mRNA相对表达量的差异。应用单因素及多因素Cox比例风险模型分析AML患者预后的影响因素。
AML组ALDOA mRNA相对表达量高于正常对照组(5.71±0.44比1.10±0.08),差异有统计学意义(t=4.74,P<0.001);难治复发组ALDOA mRNA相对表达量高于持续完全缓解组(6.69±0.67比4.30±0.36),差异有统计学意义(t=2.79,P<0.001)。不同白细胞计数、骨髓原始细胞比例及1个疗程诱导治疗是否完全缓解的ALDOA mRNA高表达和低表达患者比例比较,差异均有统计学意义(均P<0.05)。ALDOA高表达患者总生存差于低表达患者(χ2=5.59,P=0.018)。多因素分析显示,白细胞计数、预后分层、1个疗程诱导治疗是否达完全缓解、ALDOA表达均是AML患者死亡的独立影响因素(均P<0.05)。
ALDOA在AML发生、发展中可能起重要作用,骨髓中ALDOA表达水平可作为AML患者预后评估的指标,并可能为AML治疗的潜在靶点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)是一种具有高度异质性的血液系统恶性肿瘤[1]。随着治疗技术的进步,AML预后得到很大改善,但是除急性早幼粒细胞白血病(APL)外,AML的治愈率仍低于50%[2]。肿瘤细胞的主要代谢特征是高水平的糖酵解,即瓦尔堡效应[3]。糖酵解不仅为肿瘤的快速生长提供了充足的能量与合成原料,还为肿瘤转移与浸润提供了适宜的微环境[4]。果糖二磷酸醛缩酶A(ALDOA)是糖酵解过程中的关键酶,可以催化1'6二磷酸果糖转化为3-磷酸甘油醛和α-二羟丙酮磷酸[5]。近年来,研究发现ALDOA在多种恶性肿瘤中过表达,且ALDOA过表达与这些肿瘤细胞的恶性生物学行为密切相关[6,7,8,9,10]。目前尚鲜见关于ALDOA与AML关系的相关报道。本研究检测AML患者骨髓中ALDOA mRNA的表达,并分析其与患者临床特征间的关系,探讨ALDOA在AML发生、发展中的作用。
收集郑州大学第一附属医院及郑州大学附属儿童医院2013年1月至2015年12月收治的90例初治AML(非APL)患者治疗前骨髓标本,其中男性52例,女性38例,中位年龄43.5岁(14~81岁);所有患者均进行细胞形态学、免疫学、分子生物学、遗传学检查,按照法、美、英协作组(FAB)分型。收集18例异基因造血干细胞移植供者骨髓标本作为正常对照组,其中男性14例,女性4例,中位年龄31岁(21~43岁)。所有AML患者诊断、治疗及疗效评价按照血液病诊断与疗效标准和复发难治急性髓系白血病中国诊疗指南(2017版)。随访截至2020年12月。按照疗效将初治AML患者分为持续完全缓解组和难治复发组,其中持续完全缓解组37例,包括男性19例,女性18例,年龄16~81岁;难治复发组53例,包括男性33例,女性20例,年龄14~74岁。本研究已通过郑州大学第一附属医院伦理委员会审核批准(批准文号:2019-KY-227),并获得患者及家属的知情同意。
在PrimerBank网站(https://pga.mgh.harvard.edu/primerbank/)搜索基因的引物序列。ALDOA基因:正向引物5'-ATGCCCTACCAATATCCAGCA-3',反向引物5'-GCTCCCAGTGGACTCATCTG-3';内参GAPDH:正向引物5'-AAGACCTTGGGCTGGGACTG-3',反向引物5'-ACCAAATCCGTTGACTCCGA-3'。送上海生工生物工程有限公司进行设计并合成。
应用人淋巴细胞分离液(天津灏洋生物制品科技有限责任公司)提取AML患者及正常对照者骨髓中单个核细胞。RNA提取:(1)每管加入1 ml TRIzol(美国Invitrogen公司),室温放置5 min,使其充分裂解。(2)加入200 μl氯仿,充分震荡30 s,混匀后静置5 min,4 ℃ 13 800×g离心10 min。(3)将上层液移至一新的1.5 ml无酶EP管中,加入等体积预冷的异丙醇,充分混匀后-20 ℃静置30 min,4 ℃ 13 800×g离心10 min。(4)弃上清,加入1 ml 75%乙醇,上下颠倒混匀,4 ℃ 13 800×g离心10 min。(5)重复(4)的操作。(6)弃上清,待其自然晾干后,加入30 μl焦碳酸二乙酯(DEPC)水,使RNA完全溶解。(7)用Nano Drop 2000(美国Thermo Fisher Scientific公司)测定RNA浓度及纯度,-80 ℃保存备用。
使用Vazyme HiScriptⅢ RT SuperMix for qPCR (+gDNA wiper)试剂盒(南京诺唯赞医疗科技有限公司)进行反转录反应,总反应体系共20 μl。依次加入4×gDNA wiper Mix 4 μl、RNA 1 μg和ddH2O共16 μl,轻轻混匀放入聚合酶链反应(PCR)仪中,设定42 ℃反应2 min;反应完成后加入5×HiScriptⅢ RT SuperMix 4 μl,混匀后重新放入PCR仪(新加坡Life Tehnologirs公司)中,设定反应条件37 ℃ 15 min、85 ℃ 5 s,得到反转录产物cDNA。
参照Vazyme ChamQ Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞医疗科技有限公司)说明书配制qRT-PCR反应体系,反应体系共20 μl,依次加入2×ChamQ Universal SYBR qRT-PCR Master 10 μl,上、下游引物各0.4 μl,cDNA 2 μl,ddH2O 7.2 μl,设定反应条件预变性95 ℃ 30 s;循环反应95 ℃ 10 s,60 ℃ 30 s,共40个循环;溶解曲线95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。采用2-△△Ct法计算目的基因相对表达量。所有操作均在冰上进行,实验重复3次。
采用GraphPad Prism 7统计学软件进行数据分析。计数资料以频数(%)表示,组间比较采用χ2检验或Fisher确切概率法;采用Kaplan-Meier法进行生存分析,并行log-rank检验;单因素及多因素分析采用Cox比例风险模型。以P<0.05为差异有统计学意义。
AML组ALDOA mRNA相对表达量高于正常对照组(5.71±0.44比1.10±0.08),差异有统计学意义(t=4.74,P<0.001);难治复发组ALDOA mRNA相对表达量高于持续完全缓解组(6.69±0.67比4.30±0.36),差异有统计学意义(t=2.79,P<0.001)。
以AML患者中位ALDOA mRNA相对表达量4.21为参考值,ALDOA mRNA相对表达量高于中位数的为高表达(45例),低于中位数的为低表达(45例)。不同年龄、性别、FAB分型及预后分层的ALDOA mRNA高表达和低表达的患者比例比较,差异均无统计学意义(均P>0.05),而不同白细胞计数、骨髓原始细胞比例及1个疗程诱导治疗是否完全缓解的ALDOA mRNA高表达和低表达患者的比例比较,差异均有统计学意义(均P<0.05)(表1)。
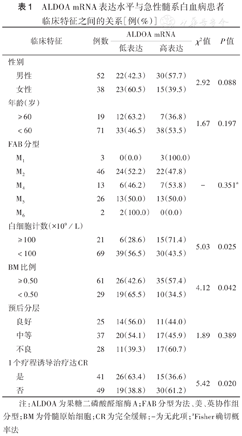
ALDOA mRNA表达水平与急性髓系白血病患者临床特征之间的关系[例(%)]
ALDOA mRNA表达水平与急性髓系白血病患者临床特征之间的关系[例(%)]
| 临床特征 | 例数 | ALDOA mRNA | χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| 低表达 | 高表达 | |||||
| 性别 | ||||||
| 男性 | 52 | 22(42.3) | 30(57.7) | 2.92 | 0.088 | |
| 女性 | 38 | 23(60.5) | 15(39.5) | |||
| 年龄(岁) | ||||||
| ≥60 | 19 | 12(63.2) | 7(36.8) | 1.67 | 0.197 | |
| <60 | 71 | 33(46.5) | 38(53.5) | |||
| FAB分型 | ||||||
| M1 | 3 | 0(0.0) | 3(100.0) | - | 0.351a | |
| M2 | 46 | 24(52.2) | 22(47.8) | |||
| M4 | 13 | 6(46.2) | 7(53.8) | |||
| M5 | 26 | 13(50.0) | 13(50.0) | |||
| M6 | 2 | 2(100.0) | 0(0.0) | |||
| 白细胞计数(×109/L) | ||||||
| ≥100 | 21 | 6(28.6) | 15(71.4) | 5.03 | 0.025 | |
| <100 | 69 | 39(56.5) | 30(43.5) | |||
| BM比例 | ||||||
| ≥0.50 | 61 | 26(42.6) | 35(57.4) | 4.12 | 0.042 | |
| <0.50 | 29 | 19(65.5) | 10(34.5) | |||
| 预后分层 | ||||||
| 良好 | 25 | 14(56.0) | 11(44.0) | 1.89 | 0.389 | |
| 中等 | 37 | 20(54.1) | 17(45.9) | |||
| 不良 | 28 | 11(39.3) | 17(60.7) | |||
| 1个疗程诱导治疗达CR | ||||||
| 是 | 41 | 26(63.4) | 15(36.6) | 5.42 | 0.020 | |
| 否 | 49 | 19(38.8) | 30(61.2) | |||
注:ALDOA为果糖二磷酸醛缩酶A;FAB分型为法、美、英协作组分型;BM为骨髓原始细胞;CR为完全缓解;-为无此项;aFisher确切概率法
截至随访结束,90例AML患者中54例(60.0%)死亡;ALODA低表达患者中21例(38.9%)死亡,中位总生存时间为24个月(95% CI 8.819~39.181个月);ALDOA高表达患者中33例(61.1%)死亡,中位总生存时间为14个月(95% CI 6.624~21.376个月)。ALDOA高表达组OS差于ALDOA低表达组,差异有统计学意义(χ2=5.59,P=0.018)(图1)。
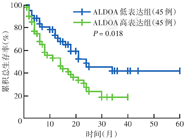

注:ALDOA为果糖二磷酸醛缩酶A;以患者中位ALDOA mRNA相对表达量4.21为参考值,ALDOA mRNA相对表达量高于中位数为高表达,低于中位数为低表达
单因素分析结果显示,WBC、预后分层、1个疗程诱导治疗是否完全缓解及ALDOA表达水平均为AML患者死亡影响因素(均P<0.05);多因素分析结果显示,WBC、预后分层、1个疗程诱导治疗是否完全缓解及ALDOA表达水平均为AML患者死亡的独立影响因素(均P<0.05)(表2)。
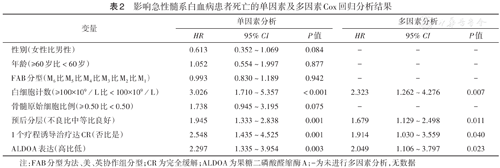
影响急性髓系白血病患者死亡的单因素及多因素Cox回归分析结果
影响急性髓系白血病患者死亡的单因素及多因素Cox回归分析结果
| 变量 | 单因素分析 | 多因素分析 | ||||
|---|---|---|---|---|---|---|
| HR | 95% CI | P值 | HR | 95% CI | P值 | |
| 性别(女性比男性) | 0.613 | 0.352~1.069 | 0.084 | - | - | - |
| 年龄(≥60岁比<60岁) | 1.052 | 0.554~1.997 | 0.877 | - | - | - |
| FAB分型(M6比M5比M4比M3比M2比M1) | 0.993 | 0.830~1.189 | 0.942 | - | - | - |
| 白细胞计数(≥100×109/L比<100×109/L) | 3.026 | 1.710~5.357 | <0.001 | 2.323 | 1.262~4.276 | 0.007 |
| 骨髓原始细胞比例(≥0.50比<0.50) | 1.738 | 0.945~3.195 | 0.075 | - | - | - |
| 预后分层(不良比中等比良好) | 1.945 | 1.333~2.838 | 0.001 | 1.679 | 1.129~2.498 | 0.011 |
| 1个疗程诱导治疗达CR(否比是) | 2.548 | 1.435~4.525 | 0.001 | 1.914 | 1.030~3.559 | 0.040 |
| ALDOA表达(高比低) | 2.297 | 1.335~3.954 | 0.003 | 2.049 | 1.106~3.797 | 0.023 |
注:FAB分型为法、美、英协作组分型;CR为完全缓解;ALDOA为果糖二磷酸醛缩酶A;-为未进行多因素分析,无数据
AML发病中位年龄为68岁,一旦确诊就需要及时进行预后分层并给予相应治疗,以达到获得完全缓解并长期生存的目的[11]。目前AML的长期预后仍不乐观,尤其是老年患者[12]。因此寻找新的有效低毒治疗方法对于AML患者尤为重要。
葡萄糖是细胞能量代谢的主要底物,葡萄糖代谢在正常细胞与肿瘤细胞中的调控方式不同。在正常细胞中葡萄糖经过三羧酸循环氧化磷酸化生产三磷酸腺苷(ATP),但在大多数肿瘤细胞中即使在氧气充足的情况下,肿瘤细胞依然通过糖酵解的方式将葡萄糖转化为丙酮酸进而分解为乳酸生产ATP[13],虽然糖酵解过程生产ATP效率较低,但肿瘤细胞糖酵解速率较高,基本上是正常细胞的10倍,且糖酵解过程可产生大量细胞合成的中间产物,有利于肿瘤细胞的快速增殖[3],另外肿瘤细胞在糖酵解过程中产生大量的氢离子和乳酸,可以导致肿瘤微环境pH值降低,利于肿瘤细胞的转移与侵袭[14]。
ALDOA位于染色体16q22 q24上,在胚胎组织及成年人肌肉组织中广泛存在[15,16]。酶促动力学分析显示,与ALDOB及ALDOC相比,ALDOA对1,6二磷酸果糖的催化效率最高,这表明ALDOA在糖酵解过程中发挥着重要作用[17]。ALDOA是红细胞和骨骼肌中唯一的醛缩酶同工酶,是红细胞和肌肉纤维中产生ATP所必需的[16]。近年来,越来越多的研究证明ALDOA参与了肿瘤的发生、发展。Rho等[18]研究发现,与正常肺组织相比,人肺腺癌组织中ALDOA表达上调。与黑色素细胞相比,在黑色素瘤细胞G361中ALDOA的表达上调。Du等[19]研究发现在肺鳞状细胞癌中,ALDOA可诱导上皮-间质转化,促进肿瘤细胞的浸润、转移。Chang等[6]研究发现高表达ALDOA的肺癌患者预后较差,抑制ALDOA的表达可以抑制肺癌细胞的迁移和侵袭。Huang等[20]研究发现,相较于正常肾组织,肾细胞癌组织中ALDOA蛋白高表达,且ALDOA高表达患者总生存时间明显短于ALDOA蛋白低表达患者,抑制ALDOA的表达可以阻滞肾细胞癌细胞于G0期,抑制其增殖。
本研究结果发现,与正常对照组相比,ALDOA在初治AML中的表达水平增高;与完全缓解组相比,难治复发组ALDOA表达水平增高;Cox回归多因素分析结果提示WBC、预后分层、1个疗程诱导治疗是否完全缓解及ALDOA表达水平均是AML患者死亡的独立影响因素。据此我们推测,ALDOA在AML发生、发展过程中起着类似癌基因的作用。
综上所述,本研究结果提示ALDOA在初治AML患者骨髓单个核细胞中的表达水平升高,难治复发患者较持续完全缓解患者增高,并且ALDOA表达水平与患者生存时间呈负相关,是AML患者的独立预后因素,但是ALDOA对AML生物学特征的影响及对糖酵解影响的具体机制尚不清楚,需要进一步深入研究。
所有作者均声明不存在利益冲突



























