
对比重症新型冠状病毒肺炎(corona virus disease 2019,COVID-19)与甲型H1N1流感肺炎的胸部CT影像特征及临床症状、实验室检查结果,以提高对重症COVID-19的影像诊断水平。
回顾性分析2020年1月至2020年2月我院收治确诊的29例重症COVID-19患者(简称"研究组")的CT表现及临床特点、实验室检查结果,并与2019年1月至2020年2月确诊的58例重症甲型H1N1流感肺炎患者(简称"对照组")进行比较,对比分析两组患者的临床特点、实验室检查结果及CT表现特征。
研究组发病早期咳嗽及咽痛的阳性率低于对照组,发展到重症的时间长于对照组,差异有统计学意义(P<0.05);研究组的乳酸升高高于对照组,降钙素原、肌红蛋白升高水平低于对照组,差异有统计学意义(P<0.05)。CT影像病灶分布上研究组右肺上叶、中叶的发生率及累及总肺叶数均高于对照组,差异有统计学意义(P<0.05);影像征象上研究组小叶中心结节或树芽征、支气管管壁增厚、纵隔淋巴结肿大及胸腔积液的发生率低于对照组,网格影、小叶内间隔增厚发生率高于对照组,差异有统计学意义(P<0.05)。
重症COVID-19以双肺弥漫分布的磨玻璃密度影、网格影为主,伴局部实变,小叶内间隔增厚常见,树芽征及小叶中心结节极少见,可合并心包积液及胸腔积液,临床上乳酸水平升高、肌红蛋白正常或轻度升高,与重症甲型H1N1流感肺炎相比,降钙素原正常或轻度升高。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2019年年底以来,新型冠状病毒肺炎(corona virus disease 2019,COVID-19)在全球各地蔓延,引起全球大流行。COVID-19的发病季节与甲型H1Nl流感时间重叠,二者的临床诊断除了流行病学、病原学及临床症状,胸部CT也是一个主要的辅助诊断,本研究回顾性分析重症COVID-19的临床资料及胸部CT影像特征,与甲型H1N1流感肺炎对比分析,为临床救治重症及危重症患者提供更多有价值的信息。
重症COVID-19及甲型H1N1流感患者以临床诊断为重症时间为准,收集此时临床特点、实验室数据及CT表现。所有重症COVID-19病例均需符合《新型冠状病毒肺炎诊疗方案试行第七版》诊断标准[1]。符合下列任何一条为重症病例:(1)出现气促,RR≥30次/分;(2)静息态下,指氧饱和度≤93%;(3)动脉血氧分压/吸氧浓度≤300 mmHg。
通过数字表法随机选择2019年1月至2020年2月我院确诊的58例重症甲型H1N1流感肺炎病例,作为对照组。所有甲型H1N1流感肺炎病例均符合卫生部办公厅关于印发《甲型H1N1流感诊疗方案(2010年版)》的通知诊断标准[2]。出现以下情况之一者为重症病例:(1)持续高热>3 d,伴有剧烈咳嗽,咳脓痰、血痰,或胸痛;(2)呼吸频率快,呼吸困难,口唇紫绀;(3)神志改变:反应迟钝、嗜睡、躁动、惊厥等;(4)严重呕吐、腹泻,出现脱水表现;(5)合并肺炎;(6)原有基础疾病明显加重。
采用德国Siemens Emotion 16 CT扫描仪,患者仰卧位,头先进,吸气后屏气进行扫描。扫描参数:管电压120 kV,管电流为自动毫安,层厚5 mm,层间距5 mm,视野500 mm×500 mm,矩阵512×512,1.5 mm高分辨算法重建肺窗,扫描范围从胸廓入口至肺底。
由2名胸部CT诊断专业且工作10年以上的副主任医师回顾性分析所有患者的临床资料及CT图像,主要在薄层轴位图像上观察CT影像征象及病灶分布情况,CT征象包括磨玻璃密度影、实变、实变+磨玻璃密度影、小叶中心结节或树芽征、网格影、支气管壁增厚、纵隔淋巴结肿大及胸腔积液、心包积液等,意见不统一时由2名医师讨论决定。
通过SPSS 19.0软件比较分析研究组与对照组的CT表现特征及临床特点有无差异。符合正态分布的计量资料以(Mean±SD)表示,组间比较采用t检验;偏态分布的计量资料以M(P25~P75)表示,组间比较采用秩和检验;计数资料采用"频数"或"率"表示,组间比较采用x2检验。以P<0.05为差异有统计学意义。
纳入2020年1月1日至2020年2月28日北京地坛医院收治并确诊的重症COVID-19患者29例(简称"研究组"),其中男16例,女13例;年龄29~88岁,平均年龄(58.86±17.69)岁;发热患者28例(96.55%)、咳嗽17例(58.62%)、乏力14例(48.28%)、咽痛3例(10.34%),伴高血压、糖尿病、冠心病等慢性疾病史13例(44.82%),死亡1例(3.45%)。通过数字表法随机选择2019年1月至2020-2月北京地坛医院确诊的重症甲型H1N1流感肺炎病例58例(简称"对照组"),其中男36例,女22例;年龄16~56岁,平均(60.26±18.23)岁;发热患者57例(98.28%)、咳嗽53例(91.38%)、乏力28例(48.28%)、咽痛17例(29.31%),伴高血压、糖尿病、冠心病等慢性疾病史38例(65.52%),死亡2例(3.45%)。
两组患者性别、年龄、发热、乏力及是否合并慢性基础病无统计学意义;咳嗽、咽痛构成比差异有统计学意义;两组间CT检查与发病时间间隔差异有统计学意义。见表1。
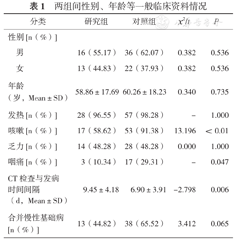
两组间性别、年龄等一般临床资料情况
两组间性别、年龄等一般临床资料情况
| 分类 | 研究组 | 对照组 | x2/t | P | |
|---|---|---|---|---|---|
| 性别[n(%)] | |||||
| 男 | 16(55.17) | 36(62.07) | 0.382 | 0.536 | |
| 女 | 13(44.83) | 22(37.93) | 0.382 | 0.536 | |
| 年龄(岁,Mean±SD) | 58.86±17.69 | 60.26±18.23 | 0.340 | 0.735 | |
| 发热[n(%)] | 28(96.55) | 57(98.28) | - | 1.000 | |
| 咳嗽[n(%)] | 17(58.62) | 53(91.38) | 13.196 | <0.01 | |
| 乏力[n(%)] | 14(48.28) | 28(48.28) | 0.000 | 1.000 | |
| 咽痛[n(%)] | 3(10.34) | 17(29.31) | - | 0.047 | |
| CT检查与发病时间间隔(d,Mean±SD) | 9.45±4.18 | 6.90±3.91 | -2.798 | 0.006 | |
| 合并慢性基础病[n(%)] | 13(44.82) | 38(65.52) | 3.412 | 0.065 | |
研究组中降钙素原及肌红蛋白的升高程度低于对照组(t=-4.592,P<0.01;t=-3.683,P<0.01);研究组中乳酸的升高程度高于对照组(t=-2.216,P=0.032);研究组白细胞计数小于4.0×109/L患者占10例(34.48%)高于对照组的13例(22.41%),白细胞计数大于10.0×109/L患者占3例(10.34%)低于对照组的11例(18.97%),但两组间差异无统计学意义(检验值为-1.598,P值为0.110);研究组中淋巴细胞计数减低为14例(48.28%),略高于对照组中的27例(46.56%),但两组间差异无统计学意义(t=-0.886,P=0.375);研究组乳酸脱氢酶、血沉及C-反应蛋白升高幅度高于对照组,但差异无统计学意义(t=-0.886,P=0.375;t=-1.999,P=-1.999;t=-1.225,P=0.221)。
研究组肺内病灶在右肺上叶、中叶及胸膜下分布的构成比高于对照组,差异有统计学意义;研究组支气管血管束周围分布构成比低于对照组,差异无统计学意义;研究组在总肺叶数上多于对照组,差异有统计学意义。见表2。
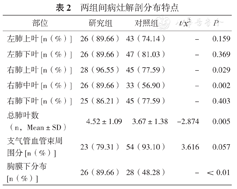
两组间病灶解剖分布特点
两组间病灶解剖分布特点
| 部位 | 研究组 | 对照组 | t/x2 | P |
|---|---|---|---|---|
| 左肺上叶[n(%)] | 26(89.66) | 43(74.14) | - | 0.159 |
| 左肺下叶[n(%)] | 26(89.66) | 47(81.03) | - | 0.369 |
| 右肺上叶[n(%)] | 28(96.55) | 45(77.59) | - | 0.029 |
| 右肺中叶[n(%)] | 26(89.66) | 33(56.90) | - | 0.002 |
| 右肺下叶[n(%)] | 25(86.21) | 45(77.59) | - | 0.403 |
| 总肺叶数(n,Mean±SD) | 4.52±1.09 | 3.67±1.38 | -2.874 | 0.005 |
| 支气管血管束周围分[n(%)] | 23(79.31) | 54(93.10) | 3.616 | 0.057 |
| 胸膜下分布[n(%)] | 26(89.66) | 28(48.28) | - | <0.01 |
研究组中小叶中心结节或树芽征、支气管管壁增厚、纵隔淋巴结肿大及胸腔积液的构成比低于对照组,差异有统计学意义;研究组中网格影及小叶内间隔增厚的构成比高于对照组,差异有统计学意义(表3)。典型图像见图1。
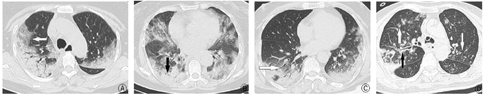

注:图A、B,重症COVID-19患者,双肺多叶、弥漫分布的磨玻璃密度影,以胸膜下分布为主,小叶内间隔增厚(见白箭头),局部实变(黑箭头);图C,甲型H1N1流感患者,双肺胸膜下分布为主的实变影,局部呈磨玻璃渗出影(见白箭头);图D,重症H1N1流感肺炎患者,双肺上叶见多发小叶中心结节及树芽征(见白箭头),右肺上叶后段支气管管壁增厚(见黑箭头)
A:重症COVID-19患者图像1;B:重症COVID-19患者图像2;C:甲型H1N1流感患者图像;D:重症H1N1流感肺炎患者图像
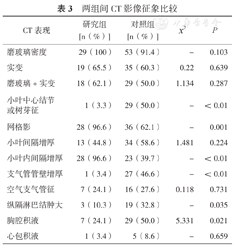
两组间CT影像征象比较
两组间CT影像征象比较
| CT表现 | 研究组[n(%)] | 对照组[n(%)] | x2 | P |
|---|---|---|---|---|
| 磨玻璃密度 | 29(100) | 53(91.4) | - | 0.103 |
| 实变 | 19(65.5) | 35(60.3) | 0.22 | 0.639 |
| 磨玻璃+实变 | 18(62.1) | 29(50.0) | 1.134 | 0.287 |
| 小叶中心结节或树芽征 | 1(3.3) | 29(50.0) | - | <0.01 |
| 网格影 | 28(96.6) | 36(62.1) | - | 0.001 |
| 小叶间隔增厚 | 13(44.8) | 34(58.6) | 1.481 | 0.224 |
| 小叶内间隔增厚 | 28(96.6) | 23(39.7) | - | <0.01 |
| 支气管管壁增厚 | 1(3.4) | 27(46.6) | - | <0.01 |
| 空气支气管征 | 7(24.1) | 16(27.6) | 0.118 | 0.731 |
| 纵隔淋巴结肿大 | 3(10.3) | 19(32.8) | - | 0.035 |
| 胸腔积液 | 7(24.1) | 29(50.0) | 5.331 | 0.021 |
| 心包积液 | 1(3.4) | 5(8.6) | - | 0.659 |
2019年年底以来,COVID-19在全球各地蔓延。新型冠状病毒感染后主要累及肺部,重症、危重症患者比较多,约20%左右,研究发现25.2%的患者至少有一种慢性基础疾病(如高血压、慢性阻塞性肺病)[3,4],致死率约2%[5,6]。甲型H1N1流感病毒传染性强,轻者表现为伴有发热的急性自限性上呼吸道感染,重者则表现为重症肺炎和呼吸功衰竭[7]。
研究组和对照组病例的主要传染源均为发病病人,无症状感染者也具有一定的传染性,传播途径相似,人群普遍易感,且重症患者以60岁及以上老年人伴或不伴慢性基础疾病多见,因此两组间年龄、性别、发热等差异无统计学意义。研究组咳嗽及咽痛的发生率分别为58.6%、10.3%,低于对照组的91.4%、29.3%。这可能和两种病毒与人体病变靶细胞及可能致病机制不同有关,流感病毒首先必须通过血凝素(H)与宿主细胞膜上的唾液酸受体结合进入宿主细胞才能进行病毒复制及传播,人体气管和支气管的唾液酸受体多为α-2,6-SA,细支气管和肺泡的唾液酸受体则为α-2,3-SA[8],所以人流感病毒与宿主细胞的结合力在气管-支气管树的上游即气管部位最强,H1N1病毒对上呼吸道纤毛上皮细胞具有偏好性[9],这些可以解释季节性流感多导致上呼吸道感染,主要表现为咳嗽及咽痛。而相关基因序列分析表明,2019-nCoV属于β冠状病毒属,与SARS-CoV的核苷酸同源性为79.0%,研究人员推测2019-nCoV与SARS-CoV一样,通过病毒外表面的Spike蛋白与人细胞表面血管紧张素酶2(ACE2)受体的介导作用感染人体呼吸道的上皮细胞,后续研究进一步证实了ACE2受体的表达主要集中在肺内Ⅱ型肺泡上皮细胞上,所以上呼吸道感染症状不如H1N1流感明显。同时2019-nCoV病毒与ACE2受体的结合较慢且潜伏期较长(多为1~14 d,平均8 d)[10],而甲型H1N1流感潜伏期较短(多为1~3 d),这可以解释COVID-19发展到重症的平均时间长于甲型H1N1流感肺炎。对照组中PCT升高明显,作者认为是合并细菌性炎症的可能性最大,Gill等[11]在超过一半的甲型H1N1病例中(19/34)看到局灶到广泛的肺泡腔内大量中性粒细胞浸润,从而导致了实验室PCT升高;Xu等[12]报道的1例50岁男性,确诊为COVID-19,心脏骤停死亡,肺活检显示肺组织有透明膜形成、肺泡上皮脱落、肺泡腔见渗出及散在单核细胞,小血管扩张,符合弥漫性肺泡损伤渗出期,渗出细胞主要为单核和巨噬细胞,未见明显的中性粒细胞浸润。对照组死亡2例,死亡原因均为感染性休克,亦提示重症H1N1流感肺炎合并细菌性肺炎的可能性最大。研究组乳酸升高水平高于对照组,乳酸的增加表明身体中的缺氧和酸中毒的存在,表明重症COVID-19患者更容易有心肌受损的表现,有文献表明乳酸大于3 mmol/L是COVID-19患者心肌损害的高危因素[13],与文献报道一致。
重症COVID-19以双肺广泛分布为主,与文献报道相似[14],本研究中研究组病例受累肺叶中位数为4.5个,与吕志彬等[15]报道的重症型COVID-19受累肺叶中位数相似,研究组更容易累及右肺上叶、右肺中叶,胸膜下分布的比例明显高于对照组,与Pan等[16]报道的COVID-19肺部病变解剖变分布大致相同。相关文献表明重症H1N1及COVID-19病毒感染尸检肺组织病理均表现为弥漫性肺泡损伤(diffuse alveolar damage,DAD)[10,11,17]。DAD是指肺内、外严重疾病(包括病毒感染)导致的以毛细血管内皮及肺泡上皮弥漫性损伤,血管通透性增强为基础,以肺水肿、透明膜形成为主要形态表现的一种病理变化。两组间病程时间大部分重叠,处于渗出期及增生期,伴机化或纤维化,影像表现上表现为磨玻璃密度影、实变及网格影。因此两组间实变、磨玻璃密度影发生率差异无统计学意义;部分文献报道重症COVID-19以实变为主要特征,与本研究相似[18]。由于重症H1N1累及上、下呼吸道,引起局灶或广泛的气管炎和支气管炎,CT上表现为支气管管壁增厚、树芽征及小叶中心结节,与本研究结果相似。重症COVID-19患者的胸部CT表现为原有病灶的进展及新发的磨玻璃密度影并存,由于SARS-CoV-2主要侵犯II型肺泡上皮细胞,从而引起上皮细胞显著增生,肺泡隔血管充血、水肿,可见单核和淋巴细胞浸润及血管内透明血栓形成,CT上表现为间质性炎症改变,以网格影及小叶内间隔增厚为主。临床上两组的CD4+ T淋巴细胞计数均有减低,提示有不同程度的免疫抑制,影像上表现为脾脏及淋巴结淋巴细胞显著减少,但本组研究显示对照组淋巴细胞肿大较研究组发生率高,作者推测可能是COVID-19引起的免疫抑制较甲型H1N1流感病毒明显有关[19],临床上在治疗重症COVID-19使用糖皮质激素时,也会对免疫进一步抑制,从而很少出现淋巴结肿大。由于重症H1N1流感肺炎常合并细菌性炎症,引起脏层胸膜黏膜充血及明显纤维素反应、胸腔积液形成;重症COVID-19也可见少量胸腔积液,可能与患者合并慢性基础病、冠心病等相关可能性大,有待于进一步研究。
综上所述,重症COVID-19以双肺弥漫分布的磨玻璃密度影、网格影为主,伴局部实变,小叶内间隔增厚常见,可见纵隔淋巴结肿大,树芽征及小叶中心结节极少见,可合并心包积液及胸腔积液,乳酸水平升高、肌红蛋白及PCT正常或轻度升高,而重症H1N1流感肺炎常伴有上呼吸道、气管、支气管和细支气管炎,较易合并细菌感染,工作中多注意这些征象及临床特点,提示临床,有助于重症COVID-19病人的临床诊治。
所有作者均声明不存在利益冲突



























