
分析对比神经导航辅助内镜与传统开颅手术治疗高血压脑出血疗效,探讨其临床应用及价值。
收集自2012年1月-2015年11月应用神经导航辅助内镜手术治疗的患者,随机抽取30例为试验组;收集开颅手术治疗高血压脑出血的患者,随机抽取30例为对照组。记录两组患者术后GCS评分,皮肤切口长度、手术时间、手术出血量、住院时间、术后并发症及术后随访第6个月KPS评分进行比较分析。
试验组与对照组相比,术后GCS昏迷评分两组差异无统计学意义(P>0.05);在皮肤切口上,试验组平均切口长度为(4.25±0.44) cm,对照组平均切口长度为(13.27±1.01) cm,两组差异有统计学意义(P<0.05);在手术时间上,试验组平均手术时间为(93.93±21.04) min,对照组的平均手术时间为(176.50±35.65) min,两组差异有统计学意义(P<0.05);在手术出血量上,试验组平均出血量为(69.83±23.83) ml,对照组平均出血量为(196.17±33.83) ml,两组对比差异有统计学意义(P<0.05);在住院天数上,试验组平均住院天数为(13.33±1.79) d,对照组的平均住院天数为(16.20±4.31) d,两组对比差异有统计学意义(P<0.05);在并发症上,试验组发病率明显低于对照组,两组对比差异有统计学意义(P<0.05);术后随访6个月KPS评分试验组预后优于对照组,两组对比差异有统计学意义(P<0.05)。
神经导航辅助内镜治疗高血压脑出血定位准确、微创、直视、省时、止血充分,出血量少,可缩短住院天数、降低并发症发病率,术后恢复好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
高血压脑出血(Hypertensive intracerebral hemorrhage, HICH)是高血压病引起的常见的并发症之一[1],常好发于中老年人,部位多位于基底节区,其发病率和病死率均高[2]。近几年来我国心脑血管疾病逐渐年轻化[3],其并发症对患者本人身体、精神方面造成的损害及对家庭和社会所造成的影响甚至更为严重。因此,治疗中年人HICH有着十分重要的意义。
病例纳入标准:(1)年龄介于30~60岁,患有高血压病史,不伴有严重的其他器官疾病;(2)血量(根据多田公式a×b×c×1/2,a代表最大血肿面积层面血肿的最长径;b代表最大血肿面积层面上与最长径垂直的最长径,c代表CT片中出现出血的层面数)计算,血量为30~60 ml。(3)出血部位位于基底节区,血肿未侵及幕下及脑干,且未发生脑疝的患者;(4)术前未口服影响手术的药物,如"利血平""阿司匹林"等抗凝药物;(5)CT证实出血位于基底节区,排除非高血压性脑出血;(6)术前GCS评分大于6分;(7)术前排除患者误吸及肺部感染。依据纳入标准,收集山西医科大学附属人民医院神经外科自2012年1月-2015年11月应用神经导航辅助内镜手术治疗高血压脑出血患者,随机抽取30例为试验组;收集开颅手术治疗高血压脑出血的患者,随机30例为对照组。两组患者基本情况如下表1。
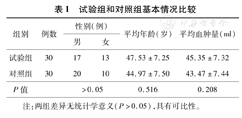
试验组和对照组基本情况比较
试验组和对照组基本情况比较
| 组别 | 例数 | 性别(例) | 平均年龄(岁) | 平均血肿量(ml) | |
|---|---|---|---|---|---|
| 男 | 女 | ||||
| 试验组 | 30 | 17 | 13 | 47.53±7.25 | 45.35±7.32 |
| 对照组 | 30 | 20 | 10 | 44.97±7.50 | 43.47±7.44 |
| P值 | >0.05 | 0.516 | 0.208 | ||
注:两组差异无统计学意义(P>0.05),具有可比性。
神经导航系统(Medtronic公司,美国),神经内窥镜(Storz公司,德国),头架(Doro公司,德国)。
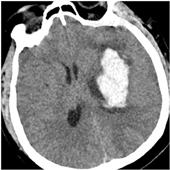
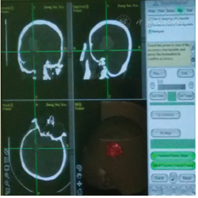
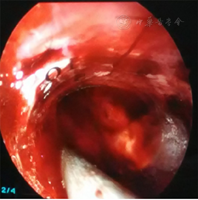
所有患者均在入院后24 h内[4]全麻下行手术治疗。试验组患者术前行头颅CT 1 mm薄扫(图1)、刻盘,并将数据录入神经导航系统;患者全麻取仰卧位,头偏健侧,头架固定并取颅骨标记点进行导航注册,定位手术最佳点,铺单消毒。在患侧颞部切开3~4 cm皮肤切口,充分止血钻孔,切开硬脑膜,通过导航引导组织导管扩张器穿刺至血肿腔内(见封四,图2、图3),取出管芯,将内镜沿组织导管扩张器通道进入血肿腔,由内镜将组织扩张器引导至血肿腔底面,使用吸引器抽吸底面血肿(见封四,图4),直至显露脑组织,向外渐退出组织扩张器,此时见周围血肿回缩至中央,继续抽吸并逐渐退出,依此方式逐渐抽吸血肿至清除完毕,并完全退出扩张器。遇到活动性出血时给予电凝止血,并给予少量明胶海绵覆盖;在创面渗血的地方给予速即沙及少量明胶海绵覆盖。血肿清除完毕后,通过内镜观察残腔无出血及渗血,留置引流管,缝合头皮术毕。



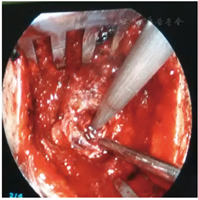

开颅手术组:患者全麻下在颞部行弧形切口,避开大血管及神经,遇到出血时及时仔细止血。根据患者血肿量及脑组织水肿程度判断骨瓣的大小,星形切开硬脑膜,并沿脑回方向切开脑皮质直至血肿区。在显微镜下清除血肿,遇到粘连较紧的血块时无须清除,观察有无残腔渗血,放置引流管,并根据脑组织肿胀程度考虑是否行回复骨瓣,严密缝合肌肉皮下及皮肤。两组术后24 h内复查头颅CT(图5),并给予相同治疗方案。

对比两组术后GCS昏迷评分,术中记录手术时间、术中出血量、术后住院天数、并发症的发病率以及随访6个月后KPS评分。
GCS昏迷评分:两组均在术前及术后1周根据睁眼反应、运动反应和语言反应3个方面进行评分,分值大小与意识障碍严重程度呈负相关[5],总分值3~15分。清醒15分,轻度昏迷13~14分,中度昏迷9~12分,重度昏迷3~8分。
KPS功能状态评分:随访患者出院后第6个月并进行评分,良好90~100分,轻度残疾70~90分,中度残疾50~70分,重度残疾30~50分,植物状态10~30分,死亡0~10分。
采用SPSS 22.0处理本研究数据。计量资料采用均数±标准差( ±s)表示,组间比较采用两个独立样本t检验。等级资料采用频数和百分数表示,组间比较采用秩和检验。计数资料采用频数和百分数表示,组间比较采用χ2检验。P<0.05为差异具有统计学意义。
±s)表示,组间比较采用两个独立样本t检验。等级资料采用频数和百分数表示,组间比较采用秩和检验。计数资料采用频数和百分数表示,组间比较采用χ2检验。P<0.05为差异具有统计学意义。
两组患者术后意识状态恢复进行对比,差异无统计学意义(P>0.05)。详见表2。
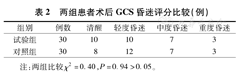
两组患者术后GCS昏迷评分比较(例)
两组患者术后GCS昏迷评分比较(例)
| 组别 | 例数 | 清醒 | 轻度昏迷 | 中度昏迷 | 重度昏迷 |
|---|---|---|---|---|---|
| 试验组 | 30 | 10 | 10 | 7 | 3 |
| 对照组 | 30 | 8 | 12 | 7 | 3 |
注:两组比较χ2=0.40,P=0.94>0.05。
两组患者比较,试验组在住院天数、术中出血量、手术时间及皮肤切口长度优于对照组,详见表3。
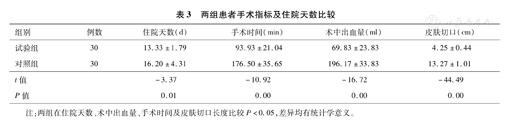
两组患者手术指标及住院天数比较
两组患者手术指标及住院天数比较
| 组别 | 例数 | 住院天数(d) | 手术时间(min) | 术中出血量(ml) | 皮肤切口(cm) |
|---|---|---|---|---|---|
| 试验组 | 30 | 13.33±1.79 | 93.93±21.04 | 69.83±23.83 | 4.25±0.44 |
| 对照组 | 30 | 16.20±4.31 | 176.50±35.65 | 196.17±33.83 | 13.27±1.01 |
| t值 | -3.37 | -10.92 | -16.72 | -44.49 | |
| P值 | 0.01 | 0.00 | 0.00 | 0.00 |
注:两组在住院天数、术中出血量、手术时间及皮肤切口长度比较P<0.05,差异均有统计学意义。
两组患者术后并发症以率(%)表示,试验组术后并发症发病率为5%,对照组发病率为13%,试验组术后并发症发病率低于对照组,两组比较差异有统计学意义(P<0.05)。详见表4。
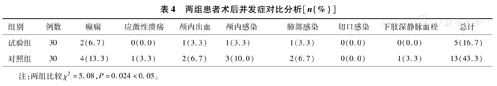
两组患者术后并发症对比分析[n(%)]
两组患者术后并发症对比分析[n(%)]
| 组别 | 例数 | 癫痫 | 应激性溃疡 | 颅内出血 | 颅内感染 | 肺部感染 | 切口感染 | 下肢深静脉血栓 | 总计 |
|---|---|---|---|---|---|---|---|---|---|
| 试验组 | 30 | 2(6.7) | 0(0.0) | 1(3.3) | 1(3.3) | 1(3.3) | 0(0.0) | 0(0.0) | 5(16.7) |
| 对照组 | 30 | 4(13.3) | 1(3.3) | 2(6.7) | 3(10.0) | 2(6.7) | 0(0.0) | 1(3.3) | 13(43.3) |
注:两组比较χ2=5.08,P=0.024<0.05。
两组患者随访术后第6个月并进行KPS评分,试验组1例出院后失访,1例放弃治疗死亡;对照组1例出院后因家庭经济因素放弃治疗,详见表5。
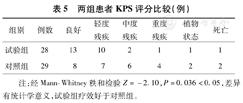
两组患者KPS评分比较(例)
两组患者KPS评分比较(例)
| 组别 | 例数 | 良好 | 轻度残疾 | 中度残疾 | 重度残疾 | 植物状态 | 死亡 |
|---|---|---|---|---|---|---|---|
| 试验组 | 28 | 13 | 10 | 2 | 1 | 1 | 1 |
| 对照组 | 29 | 8 | 7 | 6 | 4 | 2 | 2 |
注:经Mann-Whitney秩和检验Z=-2.10,P=0.036<0.05,差异有统计学意义,试验组疗效好于对照组。
既往传统治疗高血压脑出血的方法是内科保守治疗,治疗效果未达到满意程度。早期传统开颅手术创伤大且并发症较多;随着医学影像和微创技术的创新发展,神经外科手术更倾向于创伤小、损伤低、术后并发症少的方向发展。外科治疗高血压脑出血的方法除了传统大骨瓣开颅手术外,还包括小骨窗开颅手术、B超引导下血肿清除术、借助CT、MRI立体定向抽吸技术、脑室穿刺脑脊液外引流术、神经内镜辅助清除血肿术以及神经导航辅助微创手术技术。精准微创手术治疗高血压脑出血已成为手术方式的主流。
本研究通过利用神经导航术前定位,并通过内镜微创清除颅内血肿与传统大骨瓣开颅手术进行比较分析,试验组在手术时间、术中出血量及住院天数方面均少于对照组,尽可能减少了因麻醉、术中的输血给患者带来2次损伤,而在短时间内尽快的清除血肿,减少了血肿液化分解过程中释放的各种毒性物质[6],从而促进患者术后的恢复。
在术后并发症方面,试验组并发症的发病率明显低于对照组。神经内镜术后再出血率低于开颅手术组,与神经内镜沿组织导管扩张器有充分的操作空间及清晰可视度发现出血点,通过双极电凝止血。其他并发症方面,术后恢复情况来看,试验组生活质量明显优于对照组。早期传统开颅手术可以立即清除颅内血肿,降低颅内压,改善对周围脑组织压迫及局部血液循环,降低患者病死率[7]。但手术时间长、创伤大,切口暴露时间长,增加了颅内感染的风险;术中深部血肿通过牵拉脑组织而进一步清除,加重了脑实质水肿等继发性损害;术后发生癫痫概率明显增加,且意识障碍恢复较慢,发生双下肢深静脉及肺部感染的概率也明显增加。2014年,Zhang等[7]发表的一篇文章中提到神经内镜利用金属针可调节套管对颅内血肿进行清除,与本研究神经内镜利用组织扩张器原理基本一致。但本课题特点在于通过利用神经导航对血肿腔进行定位,引导组织扩张器进入血肿腔底面最佳位置,清除血肿;避免了因切口位置不佳,导致血肿清除困难、手术时间延长等问题。而术后长期神经功能改善方面与该文章中存在出入,可能因本文中手术组及对照组样本例数均较少,导致最终结果存在差异。
神经内镜治疗颅内血肿手术由Auer等[8]在1989年最早报道,并得出内镜在治疗颅内血肿方面是一种快速、安全的手术方法。之后国内外相关文献[9,10]报道,肯定了神经内镜在治疗高血压脑出血方面微创、省时、可视性强、术中止血可靠、清除血肿彻底及对脑组织牵拉小等优点。但神经内镜也存在自身缺点:(1)对于高血压脑出血而言,无论血量的多少,手术入路的选择尽可能接近血肿腔且避开重要功能区和血管;(2)神经内镜所呈现的图像为平面图像,缺乏立体感,且三维空间不足,导致术者易产生错觉[11];(3)神经内镜仅能呈现镜头的视野,对于穿刺通道周围的颅脑结构不能呈现,术中易产生对周围脑组织的损伤。而神经导航系统根据CT、MRI等影像资料实时引导神经外科手术,有以下优点:(1)能在术前定位小骨窗的最佳位置,并清晰显示功能区和血管的位置,为手术提供指导;(2)术中可利用穿刺管进行实时定位,确定穿刺通道进入血肿腔的最佳位置和层面,为神经内镜提供最佳窦道;(3)在神经导航系统实时定位过程中,可展现穿刺通道周围脑组织的情况,减少损伤。而神经导航充分弥补了神经内镜在治疗高血压脑出血手术中的不足,使得手术更加的简单、安全,尽可能减少对患者的二次损伤,缩短患者住院时间、减少术后并发症,促进患者预后的恢复。
神经导航联合神经内镜已经用于神经外科各种手术,包括肿瘤、脑出血、小脑扁桃体下疝等手术中,其疗效已被肯定[12,13,14]。对于操作熟悉的神经导航医师而言,关节臂的安装、坐标注册、表面注册仅需5~10 min便可完成。对于经验不足的医师而言,神经导航的定位可以选择最佳手术切口及位置,并引导至血肿腔最佳位置,快速清除血肿。经验丰富的医师在没有神经导航的定位下也不能百分之百进入血肿腔最佳位置,从而影响手术时间及进度。神经导航系统对应于"精准",而神经内镜迎合于"微创",二者结合印证了现阶段"精准微创医疗"的理念,更突显了神经外科手术今后的发展道路。



























