
建立肝硬化组织来源纤维母细胞的分离、培养方法,探讨体外培养纤维母细胞的生物学特性。
采用组织块贴壁法等细胞培养技术分离培养肝硬化组织来源纤维母细胞,通过显微摄像、细胞计数研究其形态学变化及生长特性,用细胞免疫荧光及Western blotting等方法检测细胞成纤维细胞特异性蛋白1(FSP1)、波形蛋白的表达情况,对所得细胞进行分析鉴定。
2 h内组织块贴壁良好,1周左右可见组织块周边有单个的胞体较大的肝细胞样细胞游出,2周左右可见梭形或三角形纤维母细胞游出。传代后细胞呈均一的成纤维细胞样,生长潜伏期短,纤维母细胞生长性状稳定,3、4、5代细胞生长曲线基本一致。细胞免疫荧光结果表明,细胞表达FSP1、波形蛋白呈阳性,阳性率分别为(90.6±1.0)%和(91.2±4.1)%。
采用组织块贴壁培养法能获得纯度较高的纤维母细胞,此方法简便、高效、稳定,培养的细胞具有良好的细胞生物学特性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
纤维母细胞在机体生长因子的分泌,细胞外基质的沉积等方面发挥着重要的作用,进而参与机体的多种病理过程,包括肝脏纤维化[1]。分离纯化较多数量的纤维母细胞是研究这些机制的首要条件,本研究通过应用胶原蛋白构建培养体系及组织块贴壁培养法成功分离得到纯度较高的纤维母细胞。
收集2015年4月-8月郑州大学第一附属医院肝胆胰外科收治的符合以下入选标准的肝硬化患者5例。患者纳入标准:(1)患者存在肝硬化的证据,包括临床表现、实验室检查、影像学及组织病理学等;(2)合并巴塞罗那分期为A期或B期(单发肿瘤,直径为5~7 cm;多发肿瘤,数目≤3个,单个直径≤3 cm)的肝癌或肝脏良性占位性病变需行肝脏部分切除术;(3)术前肝功能Child-Pugh分级为A级或B级。排除标准:(1)患者合并其他重要脏器或系统疾病;(2)患者全身状况差,不可以耐受手术。5例肝硬化组织样本均在患者的手术过程中取得。5例肝脏组织样本肉眼观无肿瘤结节,组织细胞学观察排除了肿瘤性增生。本实验研究获得了当地伦理学委员会的批准,所有参与研究的患者都给予了知情同意。患者的术前临床资料汇总在表1。
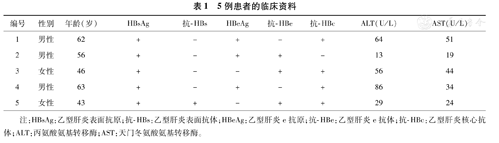
5例患者的临床资料
5例患者的临床资料
| 编号 | 性别 | 年龄(岁) | HBsAg | 抗-HBs | HBeAg | 抗-HBe | 抗-HBc | ALT(U/L) | AST(U/L) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 男性 | 62 | + | - | + | - | + | 64 | 51 |
| 2 | 男性 | 56 | + | - | + | + | - | 13 | 19 |
| 3 | 女性 | 46 | + | - | - | + | + | 56 | 44 |
| 4 | 男性 | 63 | + | - | + | - | + | 86 | 34 |
| 5 | 女性 | 43 | + | + | - | + | + | 29 | 24 |
注:HBsAg:乙型肝炎表面抗原;抗-HBs:乙型肝炎表面抗体;HBeAg:乙型肝炎e抗原;抗-HBe:乙型肝炎e抗体;抗-HBc:乙型肝炎核心抗体;ALT:丙氨酸氨基转移酶;AST:天门冬氨酸氨基转移酶。
DMEM培养液(Hyclone公司,美国),胎牛血清(Gibco公司,美国),青-链霉素(市售),0.25% Trypsin胰蛋白酶(Gibco公司,美国),Ⅰ型鼠尾胶原(BD公司,美国)。
抗体:兔抗人成纤维细胞特异性蛋白1(Fibroblast-specific protein 1, FSP1)单克隆抗体、小鼠抗人波形蛋白单克隆抗体(Abcam公司,英国);二抗:异硫氰酸荧光素(Fluorescein isothiocyanate, FITC)山羊抗鼠IgG及CY3小鼠抗兔IgG(Santa Cruz公司,美国)。
Ⅰ型鼠尾胶原蛋白可模拟体内细胞生长所需的细胞外基质,是最常用的细胞培养体系。原代培养前12 h,取Ⅰ型鼠尾胶原蛋白于超净工作台内包被6孔板,200 μl/孔,紫外灯照射过夜。
取术中患者肝硬化组织,立即置于放有DMEM培养基的无菌瓶中,带回超净台中处理。把组织摊开,反复用磷酸缓冲盐溶液(Phosphate buffer saline, PBS)冲洗,去除组织块上的血污及其他杂质,用镊子去除表面肝被膜、肝脏组织块内血管及胆管等附属物,冲洗至溶液清亮,移至培养皿中。将组织块剪碎至大小为0.5~1.0 mm3,用镊子将剪碎的组织块接种在提前包被有Ⅰ型鼠尾胶原的培养板中,置入37 ℃、含5%CO2的细胞培养箱中培养。2 h后观察,有活性的组织块贴壁良好,加入含10%胎牛血清及1%青-链霉素的DMEM培养基,静置培养。以后每3~4 d换液,保持培养瓶静止。待有纤维母细胞游出且能传代者为培养成功,待细胞铺满培养皿时进一步传代培养(见封三,图1)。
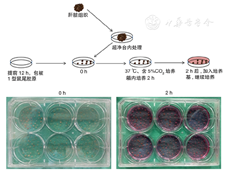

注:肝硬化组织来源纤维母细胞分离培养过程,将组织块剪碎至大小0.5~1.0 mm3,接种至提前包被有鼠尾胶原的培养板中,置于37 ℃、含5%CO2的培养箱内培养,2 h后组织块贴壁良好,加入培养基,静置培养。
分别将培养第3、4、5代的纤维母细胞消化,调节细胞浓度为2×104/ml,接种于24孔培养板,每孔约1 ml,置于37 ℃、含5%CO2培养箱内培养,每隔24 h收集3孔细胞并计数,取平均值,连续计数7 d后绘制生长曲线。
取第3代的纤维母细胞,细胞爬片,待细胞融合度达60%~80%时多聚甲醛固定,染色时用FSP1、波形蛋白的特异性抗体1∶50稀释后孵育过夜,PBS冲洗3次,再将CY3或FITC标记的IgG二抗按1∶200比例稀释后置于37 ℃恒温箱孵育2 h,PBS冲洗3次,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)染核,PBS冲洗3次,80%甘油封片。倒置相差显微镜和荧光显微镜下观察。将未孵育一抗、只孵育二抗的细胞作为阴性对照。
收集分离纯化后的细胞,用蛋白裂解液在冰上裂解细胞30 min,收集细胞裂解液离心去沉淀,取上清4 ℃保存备用,BCA法测定蛋白含量,上样量30~60 μg,SDS聚丙烯酰胺凝胶电泳、转膜,0.5%脱脂牛奶封闭,一抗4 ℃孵育过夜,室温孵育二抗1 h,电化学发光法(Electro-chemi-luminescence, ECL)发光后曝光洗片。
组织块贴壁2 h后,有活性的组织块贴壁良好,倒置显微镜下观察组织块透光性差,组织块接种至包被有鼠尾胶原的培养皿或6孔板后,1周左右可见单个细胞游出,胞体较大,圆形或方形,细胞界限清楚,折光率好,此细胞多为肝细胞,随着培养时间延长逐渐胞体变大直至细胞死亡,2周左右可见组织块周边有梭形或不规则三角形细胞游出,随后组织块周边细胞逐渐变密,并彼此连接成网,待细胞融合达90%时传代。传代后细胞增殖迅速,接种后24 h可完全贴壁,逐渐伸展呈梭形、多角形,第5天即达融合可再次传代,第3代细胞典型漩涡状生长,呈均一的成纤维细胞样(见封三,图2)。
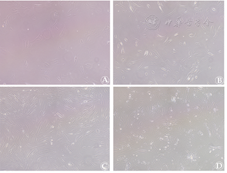

注:Ⓐ~Ⓒ:分别为第2、3、4代纤维母细胞,细胞呈梭形,典型纤维母细胞形态,双极或多极;Ⓓ:第5代纤维母细胞,可见细胞集落形成。
传代后细胞生长变快,一般第5天即可达融合。第3、4、5代细胞生长曲线相似,均于第2天左右进入快速生长期,约在第6天进入平台期。整个生长曲线近似"S"形(见封四,图3)。
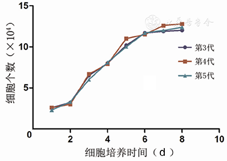

注:第3~5代纤维母细胞生长曲线类似,近似"S"形生长。纤维母细胞于第二天进入快速生长期,约于培养第6天进入细胞生长平台期。
经细胞免疫荧光染色示纤维母细胞FSP1、波形蛋白染色强阳性,细胞核DAPI染色阳性(见封四,图4)。细胞FSP1及波形蛋白染色阳性率超过90%,其阳性率分别为(90.6±1.0)%和(91.2±4.1)%,培养出的细胞为纤维母细胞。


注:成纤维细胞特异性蛋白1细胞免疫荧光染色阳性(Ⓐ低倍镜×200;Ⓑ:高倍镜×400);波形蛋白细胞免疫荧光染色阳性(Ⓒ:低倍镜×200;Ⓓ:高倍镜×400)。
采用Western blotting法检测不同组织样本提取的纤维母细胞FSP1和波形蛋白的表达,在相对分子质量为12×103及54×103处分别出现阳性条带,表明从肝脏组织样本中成功培养出的纤维母细胞均有FSP1及波形蛋白的表达。
纤维母细胞通过分泌生长因子及调节细胞外基质的沉积等参与机体的多种病理过程,众所周知,肝纤维化是由慢性肝病在疾病进展中胶原蛋白等细胞外基质蛋白的过度沉积引起,进一步发展为肝硬化、肝功能衰竭、门静脉高压症等,肝星状细胞、纤维母细胞和肌成纤维细胞在此过程中发挥了极其重要的作用[2,3,4]。近年来,有关纤维母细胞干细胞特性的研究日趋火热。研究证实,纤维母细胞可诱导分化为骨细胞、软骨细胞、脂肪细胞等[5]。我们的前期研究也证实肝硬化组织来源纤维母细胞具有间充质干细胞的特性,且可分化为肝细胞[6]。而纤维母细胞分离培养是研究众多病理过程的基础,根据组织来源不同,其分离培养方法也各异;包括酶消化法和组织块贴壁法等。在该研究中,我们利用Ⅰ型胶原构建培养体系结合组织块贴壁法进行肝硬化组织来源纤维母细胞的培养,获得了成功,分离得到的细胞具有典型的纤维母细胞特性,成分单纯,且容易成功。本方法避免了酶消化等化学手段对细胞的相对损伤,纯净的纤维母细胞靠细胞本身在体外培养中的增殖来获得。此外,在本实验中,我们利用FSP1和波形蛋白来进行纤维母细胞的鉴定。肝癌相关纤维母细胞作为微环境中最为丰富的细胞成分,在肿瘤的发生、发展过程中有重要作用;如分泌血管内皮生长因子促进血管内皮细胞在肿瘤内形成血管,从而促进肿瘤的生长及转移[7]。细胞外基质是组织和器官中的非细胞成分,主要由水、蛋白质及蛋白多糖组成[8]。其中胶原蛋白约占细胞外基质蛋白成分的30%,为细胞提供支架及抗弹性牵拉作用[9]。Suzuki等[10]发现细胞外基质成分对于干细胞及祖细胞的培养是必须的。在我们的实验中也证实,未使用Ⅰ型胶原包被的2例样本未能成功培养出纤维母细胞,可见Ⅰ型胶原包被是必要的。在本实验中影响纤维母细胞原代培养成功与否的因素有:(1)样本离体时间及组织块的活性,离体后1 h内处理的样本,组织块活性较高,接种至培养皿后贴壁良好,2周后可见纤维母细胞游出;(2)组织块的大小,将样本剪碎为大小0.5~1.0 mm3组织块时,利于组织块内各种促进细胞生长的生长因子释放至培养基中,此时组织块边缘毛糙,利于细胞的游出;(3)无菌操作,严格遵循无菌原则进行细胞培养过程中的各项操作。
本研究采用组织块法成功分离了肝硬化组织来源的纤维母细胞,细胞呈梭形或多角形,细胞界限明显,符合纤维母细胞的形态学表现。此方法简便、高效,且获得的细胞纯度较高,具有良好的生物学特性。



























