
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
原发性下腔静脉平滑肌肉瘤(Primary leiomyosarcoma of the inferior vena cava, PIVCLMS)是一种临床罕见且预后不佳的恶性肿瘤,临床表现的非特异性导致对该病的诊断较晚而错失手术及治疗机会,虽然本病目前的治疗方法包括手术治疗、化疗及放疗在内的综合治疗方法,但只有切缘阴性的肿瘤根治性切除是唯一已被证实对预后有效的治疗手段。因此,本文通过分析福建医科大学附属龙岩第一医院2015年3月-2016年4月收治的2例行手术治疗的PIVCLMS患者,并通过文献复习来介绍本病的发病特点、诊断方法及治疗进展。
病例一:患者,女性,53岁,因双下肢反复浮肿2月余,腹痛1月余入院,既往体健,月经正常,已绝经,入院行CT静脉造影(CT venography, CTV)检查显示:肾静脉与肝静脉之间下腔静脉肿瘤,左肾静脉累及,考虑平滑肌肉瘤可能,并远端下腔静脉及右髂静脉血栓形成(见封四,图1Ⓐ,图1Ⓑ,图1Ⓒ,图1Ⓓ)。联合肝胆胰外科医师协助游离肝脏并暴露第一肝门肝动脉、门静脉及第二肝门处门静脉,阻断带预阻断,防止无法控制的出血。阻断第一、二肝门血流,于肝后段下腔静脉切开,见肿瘤与下腔静脉前管壁及左肾静脉粘连紧密,将肿瘤及粘连紧密的下腔静脉管壁及左肾静脉切除合,下腔静脉及右髂静脉陈旧性血栓机化严重,尽量取出。将管壁切除较少的远端下腔静脉用4-0 Proline线直接缝合,另外用聚四氟乙烯(Polytetrafluoroethylen, PTFE)人工血管补片重建切除较多的近端下腔静脉壁,并同时重建左肾静脉(见封四,图1Ⓔ)。术后病理结果显示:下腔静脉平滑肌肉瘤(见封四,图1Ⓕ)。术后给予肝素抗凝治疗,出院后长期口服华法林,维持国际标准化比值在2.5~3.0。术后3、6个月复查未见肿瘤复发,仅见髂静脉陈旧性血栓,并形成大量侧支血管。
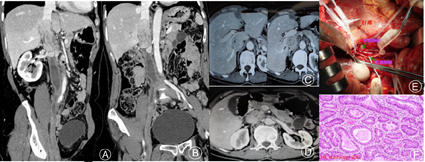

注:Ⓐ:二维重建显示肾静脉与肝静脉之间下腔静脉内肿瘤,远端下腔静脉及右侧髂静脉血栓形成;Ⓑ:二维重建显示肾静脉与肝静脉之间下腔静脉内肿瘤,远端下腔静脉及右侧髂静脉血栓形成;Ⓒ:肝后段下腔静脉肿瘤影,副肝静脉血栓形成;Ⓓ:肿瘤达肾静脉水平,并左肾静脉管壁累及;Ⓔ:因肿瘤与下腔静脉前管壁及左肾静脉粘连紧密,肿瘤近远端腔静脉阻断后,将肿瘤及粘连紧密的下腔静脉管壁及左肾静脉管壁切除,远端下腔静脉直接缝合,用聚四氟乙烯人工血管补片重建切除较多的近端下腔静脉壁,并同时重建左肾静脉;Ⓕ:平滑肌肉瘤术后病理图(苏木精-伊红染色,×200)。
病例二:患者,男性,46岁,因活动后气喘伴双下肢麻木1月余入院,平素无高血压、冠心病,行CTV检查示:下腔静脉肝静脉至右心房入口处肿瘤(见封四,图2Ⓐ,图2Ⓑ,图2Ⓒ),行经食管超声见右心房下腔静脉汇入处见高回声肿块影(见封四,图2Ⓓ)、胸部及全腹部MRI平扫+增强等检查,联合心脏外科、肝胆胰外科医师手术,进腹后见肝脏淤血严重,探查见下腔静脉肿瘤来源于肝静脉汇入部,侵及肝右静脉,向上生长侵及右心房,肿块质硬,行右股静脉、下腔静脉、升主动脉插管体外循环。于肝右静脉内侧肿瘤表面切开肝脏,逐渐分离出肿瘤前壁、远端和肝右静脉,纵行切开心包、下腔静脉至肝右静脉,完整切除肿瘤(见封四,图2Ⓔ)。因为肿瘤侵及肝右静脉、下腔静脉前壁及右心房后壁,所以切除了1/3肝右静脉前壁及下腔静脉前壁,间断性阻断第一肝门。术后病理结果显示:平滑肌肉瘤(见封四,图2Ⓕ)。术后行CTV检查,发现下腔静脉肝上段狭窄(考虑重建下腔静脉时翻转肝脏后复位引起下腔静脉扭转)。
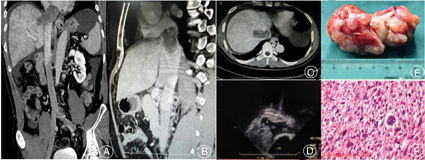

注:Ⓐ:肝静脉汇入部至右心房入口处下腔静脉肿瘤;Ⓑ:肝静脉汇入部至右心房入口处下腔静脉肿瘤;Ⓒ:肝静脉汇入部下腔静脉肿瘤,并侵及右肝静脉;Ⓓ:经食管超声见右心房下腔静脉汇入处见高回声肿块影;Ⓔ:完整切除肿瘤,质地较坚硬,呈灰红色;Ⓕ:平滑肌肉瘤术后病理图(苏木精-伊红染色,×200)。
PIVCLMS属于腹膜后软组织平滑肌肉瘤范畴。腹膜后软组织平滑肌肉瘤是一种少见且预后较差的恶性肿瘤,只占成人恶性肿瘤的0.5%[1,2,3]。起源于静脉壁的平滑肌肉瘤占所有平滑肌肉瘤的2%,其中约一半来自于下腔静脉[1,4,5],最常见于50~60岁女性[1]。Xu等[6]通过回顾性分析得到PIVCLMS患者平均年龄(53.9±14.7)岁,中位生存期48个月,术后1、3、5、10年生存率分别为66.6%、51.2%、43.9%、29.3%。由于本病症状隐匿或伴发腹部包块、腹痛、下肢水肿、下肢静脉曲张,血栓形成、静脉阻塞等非特异性症状,早期容易误诊为下肢浅静脉曲张、下肢深静脉血栓形成、布加综合征等,并且目前并未发现与PIVCLMS有关联的肿瘤标志物,致诊断较晚而错失手术及治疗机会[1,7]。因此本病的早期诊断至关重要,协助本病诊断的检查方法包括下腔静脉彩超、胸腹部CTV、MRI等,还有针对性经食管彩超、下腔静脉造影等。Gui等[8]通过分析51例静脉内平滑肌肉瘤(其中31例PIVCLMS),得出对于静脉内平滑肌肉瘤包括PIVCLMS而言,CTV能够全面地显示肿瘤部位、大小、静脉病变受累情况,并对手术方案的制订及提高手术成功率有极大的帮助,因此推荐CTV是其首选的检查方法。Ganeshalingam等[9]认为,平滑肌肉瘤在磁共振T1呈低信号,而在T2呈高信号,MRI也常用于评估肿瘤的侵犯范围并能够评估肿瘤的可切除性。并且CT和MRI均能精确地发现同时合并的血栓[10]。经食管超声扫查比经胸超声扫查能获得更多的诊断信息,尤其对下腔静脉口病变的显示更有优势(如病例二)。传统的PIVCLMS分区有以下几种:I区(上段)(38%),右心房至肝静脉开口处(如病例二);Ⅱ区(中段)(46%),肝静脉以下至肾静脉开口处(如病例一);Ⅲ区(下段)(16%),肾静脉以下。I区的病变主要表现为布加综合征,Ⅱ区的病变常表现为腹痛和腹部肿块,肾静脉受累时,常伴有血尿、蛋白尿。Ⅲ区的病变表现为腹部肿块和下肢肿胀,如无继发下肢静脉血栓形成,可不表现为下肢肿胀[11,12]。De Luca等[13]报道1例PIVCLMS患者表现为晕厥。Cinà等[14]认为,即使下腔静脉受累梗阻严重,但因为广泛的侧支静脉形成使梗阻下端有足够的血液回流,因此不常出现严重的静脉梗阻症状。
关于本病的大多数治疗信息都是来自于个案报道或者少数病例研究,目前针对PIVCLMS病例数最多的研究是1996年发表的共有218例患者入组的一项国际研究,其根治切除后的5、10年生存率分别为49.4%、29.5%,而非手术患者平均生存期仅(4.7±1.1)个月,姑息手术患者平均生存期为(31.5±12.5)个月,手术组生存期明显优于姑息切除组和非手术组[15]。Xu等[6]回顾性分析显示,年龄>55岁、远处转移、邻近器官或血管受累和非根治性切除是预后不良的潜在危险因素,并且非根治性切除是预后不良的独立危险因素,风险比为5.128。手术方式选择主要根据肿瘤分区及静脉壁受累情况,I区:张小明等[16]认为,需采用布加综合征根治术的方法切除肿瘤,下腔静脉壁缺损用人工血管进行修补。Spinelli等[11]采用下腔静脉人工血管置换,同时自体部分肝移植的方法处理这一部位的病变。Ⅱ区、Ⅲ区:手术入路采用经腹腔或腹膜后途经切除肿瘤和周围受累组织,下腔静脉重建多采用PTFE人工血管。或采用自体腹膜和直肠后筋膜进行重建[17],还有学者利用同种异体下腔静脉作为移植物,并在腹股沟处做临时性动静脉瘘,增加下腔静脉血流量以避免血栓形成[18]。双肾静脉尽可能重建,特别是右肾静脉,右肾静脉受累严重时右侧肾脏可一并切除。Ippolito等[19]报道1例Ⅱ区PIVCLMS行肿瘤切除并右肾切除用PTFE行血管重建术后17年出现了十二指肠下腔静脉瘘。下腔静脉处理需根据血管壁切除情况决定:(1)血管壁切除范围≤75%血管壁周径,可行人工血管补片或者自主心包修补;(2)血管壁切除范围>75%血管壁周径(包括完整切除),需用人工血管重建。并发现26%的患者因术中发现已形成丰富的侧支静脉而直接结扎下腔静脉[20]。Biswas等[21]认为,I区肿瘤或者肿瘤累及至I区行单纯的下腔静脉结扎并不可行,但可用于肿瘤仅位于Ⅱ和(或)Ⅲ区者。较多学者认为切缘阴性的肿瘤根治性切除是唯一已经证实对预后有效的治疗手段[3,20,21,22]。多位学者指出,对PIVCLMS的根治性外科切除加上术后化疗、放疗是最好的选择[23,24,25]。虽然国内外有不少学者尝试对PIVCLMS使用放疗、化疗等新辅助治疗,但目前还没有试验和研究能够真正证实化疗、放疗对PIVCLMS的治疗效果[26]。因此,美国国立综合癌症网络2016年发布有关腹膜后或腹腔肉瘤临床实践指南中指出:对于可切除的平滑肌肉瘤推荐手术治疗,而化疗、放疗均被视为分类2B推荐。同时指出:(1)如果化疗后肿瘤突然进展,推荐手术;(2)对于R0切除的患者,如肿瘤恶性程度高、肿瘤极大、肿瘤边缘不清时术后需行放疗。而R1切除的患者,如术前未给予新辅助疗法,术后需行放疗;如术前行放疗,术后给予高于术前10~16 Gy剂量的放疗。
虽然目前有不少对于本病包括手术治疗、化疗及放疗的综合治疗报道,但切缘阴性的肿瘤根治性切除是唯一已经证实对预后有效的治疗手段,化疗及放疗需要临床医师在以后长期的临床工作及试验中研究以证实其疗效。


























