
探索乳腺癌中肿瘤相关成纤维细胞(CAF)稳定可行的原代分离、培养方法,探讨CAF的生物学特性。
取10例未进行任何放疗、化疗及内分泌治疗的手术切除乳腺癌组织及其癌灶外缘2 cm处的配对癌旁组织,采用组织块酶消化法分离培养CAF。流式细胞术检测细胞周期,细胞免疫化学法检测CAF生物学标志波形蛋白(Vimentin)、α平滑肌肌动蛋白(α-SMA)以及细胞增殖指标Ki-67表达情况,Transwell小室侵袭、迁移实验检测CAF侵袭、迁移能力。
通过条件优化,成功分离培养CAF。细胞免疫化学结果提示,CAF高表达Vimentin、α-SMA以及Ki-67。流式细胞术结果显示,CAF较乳腺癌旁成纤维细胞S期细胞比例增加,提示CAF增殖能力强,分裂增殖活跃。CAF具有很强的侵袭、迁移能力[CAF组和乳腺癌旁成纤维细胞组侵袭细胞数分别为(79.7±3.5)、(66.3±1.5)个,迁移细胞数分别为(242.3±3.1)、(218.3±2.1)个,均P<0.05]。
优化组织块酶消化法并成功分离、培养CAF。CAF具有较强的分裂增殖能力和侵袭迁移能力。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来,越来越多的研究发现,恶性肿瘤的发生发展不仅依赖肿瘤细胞本身,肿瘤微环境同样具有极其重要的作用[1]。肿瘤微环境由肿瘤细胞、基质细胞(如脂肪细胞、成纤维细胞、内皮细胞等)以及细胞外基质共同组成[2,3,4]。肿瘤相关成纤维细胞(cancer-associated fibroblast,CAF)是活化的成纤维细胞,是肿瘤微环境中最主要的细胞,几乎存在于所有实体肿瘤组织中,CAF分泌的生长因子、细胞因子以及趋化因子等通过细胞-细胞间作用或与肿瘤细胞交互对话在肿瘤发生发展中扮演了重要的角色[5,6,7]。本研究通过优化方法对乳腺癌CAF进行原代分离培养,并对CAF生物学特性进行分析,为后续CAF在乳腺癌发生发展中作用的研究提供实验依据。
实验样本均取自2016年重庆市肿瘤医院乳腺外科已明确诊断为乳腺癌,且尚未进行任何放疗、化疗及内分泌治疗的手术切除乳腺癌组织以及癌灶外缘2 cm处的配对癌旁组织。共取10例配对标本。患者平均年龄43岁,所有标本经患者知情同意后取材。
Ⅰ型胶原酶(美国Sigma公司)干粉100 mg用0.1 mol/L的无菌磷酸盐缓冲液(PBS)1 ml进行复溶,充分溶解后使用0.22 μm孔径的一次性滤过膜过滤,制成1.0%(W/V,g/L)的胶原酶原液,再用无菌PBS分别进行5、6、7、8倍稀释,制成0.20%、0.17%、0.14%、0.12%(W/V,g/L)的胶原酶溶液。
术前0.5 h准备2个装有达氏修正伊氏(DMEM)培养液(美国Gibco公司)的一次性培养瓶,封口胶密封,做好标记,送到手术室。由乳腺外科手术医生将术中切除的乳腺癌组织及配对癌旁组织在无菌条件下装进相应的培养瓶中,封口胶密封,冰浴条件下尽快(30 min至1 h)运送到实验室。
(1)组织标本用含有青霉素(100 U/ml)、链霉素(100 μg/ml)的无菌PBS漂洗3次;(2)用高压灭菌的眼科镊固定组织块,眼科剪尽量剔除组织块中的脂肪组织;PBS漂洗1次;(3)用无菌眼科剪将处理好的组织块剪成约1 mm×1 mm×1 mm大小的肉糜状,加入配制好的Ⅰ型胶原酶溶液,轻轻混匀后置37 ℃、5% CO2培养箱中培养,每0.5 h取出轻轻混匀1次,至组织块完全消化分散,离心半径8 cm,1 000 r/min,离心5 min,终止消化,PBS重悬后离心,重复2次;(4)用含有20%胎牛血清(FBS,美国Gibco公司)的DMEM完全培养液重悬步骤(3)所得的沉渣,转移到高压灭菌玻璃培养瓶中,置37 ℃、5% CO2培养箱中培养;(5)培养72 h后弃去陈旧培养液,加入新的完全培养液继续培养至细胞达到80%~90%融合,用0.25%胰蛋白酶(美国Gibco公司)消化细胞成单个细胞,用含有10% FBS的DMEM完全培养液重悬后分到2个新的无菌玻璃瓶中培养。
1 cm×1 cm细胞爬片,用4%多聚甲醛溶液固定15 min,PBS漂洗3次,5 min/次,3% H2O2反应10 min,0.1% Triton-100反应10 min,山羊封闭血清封闭30 min,加入波型蛋白(Vimentin)、α平滑肌肌动蛋白(α-SMA)、Ki-67相关单克隆抗体(北京中杉金桥生物技术有限公司),4 ℃反应4 h,滴加生物素标记二抗,室温反应1 h,PBS冲洗3次,5 min/次;DAB染液染色,自来水充分冲洗,苏木精对比染色3 min,乙醇梯度脱色,干燥,封固,显微镜下观察。
将培养至第三代的CAF加0.25%胰蛋白酶消化成单个细胞,调整细胞密度为1×106/ml,用1 ml 75%乙醇重悬固定细胞,制成单细胞悬液,流式细胞术检测细胞周期。
用50 mg/L Matrigel(美国BD公司)1∶8稀释液包被孔径为8.0 μm的Transwell小室(美国Corning公司)底部膜的上室面,置37 ℃ 30 min,使Matrigel聚合成凝胶,下室加入600 μl含10% FBS的DMEM完全培养液。将培养至第三代的CAF消化成单个细胞,调整细胞密度,用无血清DMEM培养液重悬,吸取200 μl细胞悬液,加入Transwell小室底部膜的上室面凝胶上层,细胞8 000个/孔,置37 ℃、5% CO2培养箱中培养24~48 h,固定,结晶紫染色,显微镜下计数。
Transwell小室加入600 μl含10% FBS的DMEM完全培养液。将培养至第三代的CAF消化成单个细胞,调整细胞密度,用无血清DMEM培养液重悬,吸取200 μl细胞悬液加入Transwell小室底部膜的上室面凝胶上层,细胞8 000个/孔,置37 ℃、5% CO2培养箱中培养24~48 h,固定,结晶紫染色,显微镜下计数。
采用SPSS 19.0软件进行统计学分析,首先进行正态性检验和方差齐性检验,计量资料符合正态分布,采用均数±标准差( ±s)表示,两组间比较采用配对t检验,检验水准α=0.05。
±s)表示,两组间比较采用配对t检验,检验水准α=0.05。
在37 ℃无菌培养箱中胶原酶消化乳腺癌组织块2 h后大量细胞游出,细胞呈圆形,散在或成团分布(图1)。原代分离的乳腺癌旁成纤维细胞和乳腺癌CAF在37 ℃培养箱中培养48 h后开始贴壁生长并分裂增殖,96 h达到80%~90%融合,用0.25%胰蛋白酶消化成单个细胞,按照1∶1传代,12 h后换液,可以将贴壁较晚的肿瘤细胞以及其他非成纤维细胞(如上皮细胞等)除去;传代培养至第三代时细胞形态趋于一致,乳腺癌旁成纤维细胞及乳腺癌CAF均呈细长梭型纤维状,漩涡状生长,细胞核圆形或椭圆形,核仁清晰(图2)。
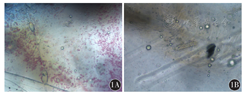

1A、1B中大小不等、折光性强的圆形颗粒均为脂肪滴
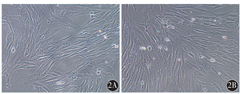

2A:乳腺癌旁成纤维细胞;2B:乳腺癌CAF
细胞免疫化学结果显示,Vimentin蛋白主要表达在细胞质,为棕褐色,原代分离培养的乳腺癌旁成纤维细胞及乳腺癌CAF均有表达(图3);α-SMA主要表达在细胞质中,细胞核有少量表达,为棕褐色,在乳腺癌CAF和乳腺癌旁成纤维细胞中均有表达(图4);Ki-67蛋白在细胞核中表达,为棕褐色,乳腺癌CAF较乳腺癌旁成纤维细胞表达明显增加(图5)。
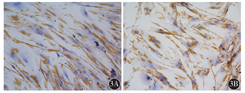

3A:乳腺癌旁成纤维细胞;3B:乳腺癌CAF
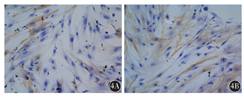

4A:乳腺癌旁成纤维细胞;4B:乳腺癌CAF
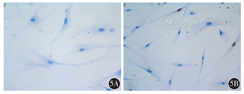

5A:乳腺癌旁成纤维细胞;5B:乳腺癌CAF
流式细胞术检测细胞周期结果显示,乳腺癌CAF G1期细胞占82.20%,G2期细胞占3.13%,S期细胞占14.67%,而癌旁成纤维细胞各期细胞比例依次为50.45%、10.10%、39.44%,乳腺癌CAF较乳腺癌旁成纤维细胞S期细胞比例增加,处于DNA复制、组蛋白合成及组装期的细胞增加,提示乳腺癌CAF增殖能力强,分裂增殖活跃(图6)。
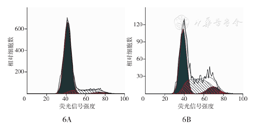

6A:乳腺癌旁成纤维细胞;6B:乳腺癌CAF
Transwell小室侵袭、迁移实验结果发现,乳腺癌旁成纤维细胞和乳腺癌CAF都具有较强的迁移、侵袭能力(图7)。乳腺癌CAF较乳腺癌旁成纤维细胞具有更强的迁移能力和侵袭能力,差异有统计学意义(均P<0.05)(表1)。
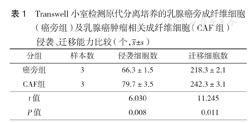
Transwell小室检测原代分离培养的乳腺癌旁成纤维细胞(癌旁组)及乳腺癌肿瘤相关成纤维细胞(CAF组)侵袭、迁移能力比较(个, ±s)
±s)
Transwell小室检测原代分离培养的乳腺癌旁成纤维细胞(癌旁组)及乳腺癌肿瘤相关成纤维细胞(CAF组)侵袭、迁移能力比较(个, ±s)
±s)
| 分组 | 样本数 | 侵袭细胞数 | 迁移细胞数 |
|---|---|---|---|
| 癌旁组 | 3 | 66.3±1.5 | 218.3±2.1 |
| CAF组 | 3 | 79.7±3.5 | 242.3±3.1 |
| t值 | 6.030 | 11.245 | |
| P值 | 0.008 | 0.011 |
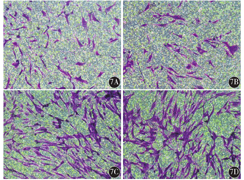

7A:乳腺癌旁成纤维细胞侵袭细胞;7B:乳腺癌CAF侵袭细胞;7C:乳腺癌旁成纤维细胞迁移细胞;7D:乳腺癌CAF迁移细胞
自20世纪90年代以来,我国的乳腺癌发病率增长速度是全球的两倍多,城市地区尤为显著。目前,乳腺癌是我国女性发病率最高的癌症,位居癌症死亡原因的第6位[8]。随着研究的进展,肿瘤微环境在肿瘤发生发展过程中的作用越来越受到关注[9,10]。
本研究在借鉴Peng等[11]成纤维细胞原代分离培养方法的基础上,经过多次条件优化,成功分离培养了乳腺癌旁成纤维细胞及乳腺癌CAF。成纤维细胞原代分离培养方法主要有以下两种,(1)组织块法:将组织块切的足够小(约1 mm×1 mm×1 mm),贴在培养瓶或培养皿中,加少量培养液培养,让成纤维细胞从组织周边游离出来并贴壁生长增殖从而达到分离的目的;(2)组织块酶消化法:采用胶原酶消化水解组织块中的胶原蛋白成分,从而使细胞成分游离出来,再经过差速贴壁等方法筛选出成纤维细胞。目前多用组织块酶消化法来分离培养成纤维细胞。胶原酶是从溶组织梭状细胞芽孢杆菌中提取制备的,主要用于水解组织中的胶原蛋白成分。胶原酶仅对细胞间质有消化作用,而对于上皮细胞影响甚微,因此适用于消化分离纤维性组织、上皮及癌组织。胶原酶分为Ⅰ型、Ⅱ型、Ⅲ型、Ⅳ型、Ⅴ型以及肝细胞专用胶原酶。其中Ⅰ型胶原酶适用于消化上皮组织、肾上腺、肺及脂肪组织。乳腺癌是上皮来源的肿瘤组织,因此本研究中使用Ⅰ型胶原酶,配制质量浓度分别为0.20%、0.17%、0.14%、0.12%(W/V,g/L)的Ⅰ型胶原酶消化液,消化时间分别为1.5、2、3 h,结果发现胶原酶浓度在0.14%(W/V,g/L),消化时间为3 h条件下分离的成纤维细胞数量多,细胞成活率高,细胞状态良好。
在本研究开展初期,经历了很多次失败,经过反复的方法改进以及条件优化最终成功分离培养了CAF,主要有以下几个方面需要特别注意,(1)组织块处理:①组织离体后要冰浴保存,尽量在30 min至1 h内运送到实验室,并在2 h内完成胶原酶消化组织的所有操作步骤;组织运送过程中要保存在含有10% FBS的DMEM完全培养液中,保持组织块的营养供给以及微环境的稳定;②本研究中发现同时保留血管和结缔组织可提高CAF的存活率,但同时也可增加污染的风险,脂肪组织要尽量去除干净;③在组织剪碎过程中可用适量无血清DMEM培养液来保持组织块湿润,从而避免细胞失水死亡,组织剪碎过程要把握好时间,在最短时间内(一块组织10~15 min)完成;④胶原酶消化组织块后不用细胞筛直接终止消化后培养。由于细胞筛操作费时,可能会导致细胞死亡,若操作不当,还有可能增加污染的风险;消化终止时可用镊子轻轻挤压残存的组织消化物,帮助细胞团从组织中游离出来。(2)胶原酶的浓度和作用时间:有研究使用浓度为0.1%的Ⅰ型胶原酶(美国Sigma公司)37 ℃消化8~12 h即可终止消化[11,12],本研究初期借鉴该研究方法消化8 h时因消化过度而失败,随后分别设置不同的胶原酶浓度和消化时间,最终发现本研究中最适胶原酶浓度为0.14%(W/V,g/L),最适消化时间为3 h为最佳实验条件。在整个消化过程中,每0.5 h观察一次,并轻轻振荡,以便使胶原酶与组织块充分接触反应并适时终止消化。此外,组织块剪碎的程度与消化时间密切相关,应当根据具体的情况进行调整。(3)细胞贴壁后首次换液及传代培养:①在分离培养后3 d内不要移动培养瓶(皿),以免影响细胞贴壁;首次更换培养液时动作要轻柔,直接弃掉陈旧培养液后换新的完全培养液,不要用PBS漂洗,以免细胞被冲洗脱落;②细胞传代时要严格把握胰蛋白酶消化时间(1~1.5 min),传代后培养12 h更换培养液可以去掉其他贴壁较晚的非成纤维细胞;(4)整个操作过程必须严格无菌操作,以免细胞被污染。
CAF具有肌成纤维细胞(MF)的特性,其特征性表面标志物有α-SMA、成纤维细胞活化蛋白(FAP)、Vimentin[13,14]。Peng等[11]从乳腺癌组织中分离出CAF,通过细胞免疫化学法检测CAF表面标志发现95%以上的CAF表达α-SMA和FAP,此外CAF还具有很强的增殖能力和侵袭、迁移能力。Kuzet和Gaggioli[15]研究发现成纤维细胞发生表型转化活化成为CAF,CAF表达α-SMA、Vimentin、FAP等标志蛋白。本研究在成功分离培养CAF后,通过细胞免疫化学法检测CAF细胞表面标志α-SMA、Vimentin,结果显示95%以上CAF高表达α-SMA、Vimentin,与文献报道一致。本研究采用流式细胞术检测细胞周期发现CAF较乳腺癌旁成纤维细胞G2期细胞比例明显增加;此外,细胞免疫化学法检测细胞增殖指标Ki-67蛋白结果显示,CAF较乳腺癌旁成纤维细胞表达Ki-67水平显著增加,提示CAF具有很强的增殖分裂能力。本研究中Transwell小室侵袭迁移实验结果显示,CAF和乳腺癌旁成纤维细胞都具有很强的侵袭、迁移能力,CAF较乳腺癌旁成纤维细胞侵袭迁移能力显著增强(P<0.05)。提示CAF可能在乳腺癌浸润转移过程中具有重要协同促进作用,其具体机制尚需进一步研究。
无



























