已证实前哨淋巴结活组织检查(SLNB)可显示乳腺癌或黑色素瘤患者是否有局部淋巴结转移。由此,对此类患者的处理有了彻底的改变。作为分期方法,SLNB在早期乳腺癌患者中可替代腋窝淋巴结清扫(ALND),在前哨淋巴结(SLN)未见转移的黑色素瘤患者中,SLNB可替代区域淋巴结清扫。最近,1项乳腺癌多中心随机试验显示,SLNB组和ALND组的5年和10年无病生存率和总体生存率无显著差异,但与ALND相比,SLNB可明显减少并发症。在术前使用淋巴显像和术中使用双重定位的研究中其假阴性率最低(5.5%~6.7%)。为评估SLNB对黑色素瘤患者生存情况的影响,进行了多中心选择性淋巴结清扫Ⅰ期试验。受试者随机分配至SLNB组(活组织检查显示有淋巴结转移者行淋巴结清扫)和观察组(淋巴结复发后行淋巴结清扫),2组黑色素瘤生存率没有不同。但是,SLNB组10年无病生存率高于观察组,在中厚型黑色素瘤或厚型黑色素瘤患者中这点尤为明显。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
淋巴显像是指使用放射性核素(通常是99Tcm)进行淋巴平面或断层显像,前哨淋巴显像的目的是识别和定位拟手术活组织检查的所有前哨淋巴结(sentinel lymph nodes, SLNs)。以下探讨涉及皮肤、乳腺和头颈部恶性肿瘤的SLN淋巴显像方法。
在其出现至今的20多年里,淋巴显像识别和定位SLNs已成为一种临床淋巴结阴性乳腺癌和黑色素瘤的分期方法[1,2,3]。SLNs是原发肿瘤淋巴引流区域的淋巴结,是淋巴结转移所必经的第一批淋巴结。如果肿瘤的首个引流淋巴结未见恶性肿瘤细胞,那么与原发灶和瘤床相关的其他淋巴结也多为阴性[4]。切除多个SLNs可消除对淋巴结清扫的需要,减少相关不良反应,提升生活质量。因原发灶可有多个引流方向,每位患者可有数个SLNs,显著摄取放射性示踪剂的那几个淋巴结有可能全部或单独发生癌细胞转移。因此,对上述淋巴结均要手术切除并进行病理分析。
1977年泌尿科医师Cabanas[5]首先报道在处理阴茎癌时采用了SLN活组织检查(SLN biopsy, SLNB)。20世纪90年代,Morton等[3]将SLNB用于黑色素瘤和乳腺癌患者,利用染料将淋巴管和SLNs染成蓝色以便肉眼可见。20世纪90年代,Alex和Krag[2]建立了基于放射性示踪剂技术的SLNB,该方法依赖于使用γ计数探头或γ相机探测放射性示踪剂的γ射线。淋巴显像是放射性示踪剂从肿瘤部位迁徙到SLNs的动态或静态的显像,该显像能使SLNs易于辨认并利于后续活组织检查的实施。
在SLNB问世的那些年,许多研究支持将其作为早期(Ⅰ期和Ⅱ期)乳腺癌腋窝和腋窝外淋巴结筛查的可靠方法。在早期乳腺癌的治疗中,SLNB取代了清扫范围更大的腋窝淋巴结清扫(axillary lymph node dissection, ALND)。在黑色素瘤上,淋巴显像提供了一种特定区域引流SLN或多个区域引流SLN的定位方法。SLNB方法自首次报道以来已有细化和改进,现已被广泛用于乳腺癌和黑色素瘤的检查[6],其在其他恶性肿瘤中的潜在价值也正在评估当中。以下将主要讨论SLNB在乳腺癌和黑色素瘤中的应用,也对其在头颈部恶性肿瘤的应用作一介绍。
打开谷歌搜索,输入"sentinel+node" ,搜索结果超过500 000条,在Pubmed上搜索"sentinel AND node" ,同行评审期刊上以SLN为主题的研究和教育出版物信息超过10 000条。人们对该项内容的关注和热情是显而易见的,SLNB在多种肿瘤的处置方面取得了成功。
1.SLN淋巴显像方法。SLNB过程患者无需前期准备。一些医院通过局部使用复方利多卡因乳膏(恩纳;阿斯利康)来减少穿刺疼痛。使用乳膏时要指导患者避免涂抹到破损皮肤上,至少在注射前30 min使用[7]。患者要除去有可能影响淋巴显像的所有首饰及衣裤,身着宽松衣物。
淋巴显像后,负责注射和显像的医师应直接与手术医师沟通,并作好相应记录。手术时外科医师应该能够浏览到图像。
2.放射性药物和注射方法。用于淋巴显像的放射性药物包括99Tcm标记的胶体(粒径3~5 000 nm,常被过滤至一狭窄范围)和99Tcm-tilmanocept{Lymphoseek; Navidea[二乙三胺五乙酸(diethylene-triaminepentaacetic acid, DTPA)-甘露糖-葡聚糖]}。99Tcm-tilmanocept在2013年被美国食品和药物监督管理局批准用于乳腺癌和黑色素瘤SLN研究,2014年被批准用于头颈部鳞状细胞癌SLN研究。胶体随淋巴液引流而移动,其迁移依赖于微球大小。到目前为止,大多数SLN研究都使用放射性胶体。
99Tcm-tilmanocept是一种基于受体的放射性示踪剂,靶向CD206受体蛋白,可在巨噬细胞和树突细胞的表面高度浓聚[8]。从生化性质看,99Tcm-tilmanocept是一种含多个DTPA和甘露糖单元的高分子化合物,每个单元共价相连于一个右旋糖酐骨架。甘露糖作为受体的配体,DTPA为99Tcm标记的螯合剂。99Tcm-tilmanocept在注射部位的清除比99Tcm-硫胶体更快,而主要SLN摄取两者则类似[9]。在SLN显像方法、示踪剂放射性活度或体积方面尚无共识,操作人员可因地制宜,探索合适方案。
注射剂量从黑色素瘤的每次皮内注射3.7 MBq到乳腺癌的每次皮内注射总量185~370 MBq不等。对于黑色素瘤多为皮内注射,推荐在肿瘤周围(或在切除部位周围)注射2~4个点,每点0.1 ml[10]。对于四肢来说,由于淋巴流速较快,推荐在手术瘢痕附近或原发灶附近注射2点(内、外侧各一)。
在乳腺癌的SLN显像中,注射方法更加复杂多样。可为浅表注射(皮下、乳晕周边或乳晕下)或深层注射(肿瘤病灶周围)[11,12,13]。浅表注射较深层注射更易实施,但可能无法提供引流的全部信息。特别情况下,为定位腋窝外尤其是内乳的SLNs,方案应包括瘤周注射[14]。比起浅表注射,瘤周注射需要了解肿瘤确切部位等信息(以免误注入肿瘤致局部扩散)。如已切除并行活组织检查,或有假体存在,切忌注入血肿死腔和假体中[10,15]。
3.显像。在黑色素瘤中,根据原发肿瘤的位置,显像必须包括所有可能引流的部位。如果原发肿瘤位于患者的躯干部位,不仅要做左右侧腋窝和颈区显像,也要做左右侧骨盆和腹股沟区显像(图1)。对于肢体肿瘤,上肢部位应做肘前区和腋窝显像,下肢部位应做腹股沟和腘窝区显像。对于头颈部鳞状细胞癌,显像范围应包括整个头颈部,尤其是肿瘤近端的所有部位,因该区域淋巴引流通常流向下方。同样,对于头颈部SLN,操作者应时刻铭记头颈部有很多微小而致命的结构(如颈动脉窦等,切忌随意按摩)。躯干和头颈部注射后越过身体中线的对侧引流很常见(图2)[16]。此外,对于某些适应证(如观察膈面引流),SPECT或SPECT/CT或许是首选。
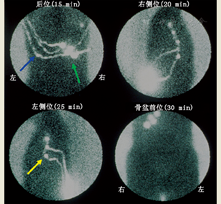

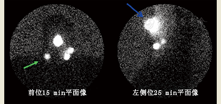

显像过程的所有方面,包括皮肤标记,患者的摆放体位应与术中相同。
(1)动态显像。在黑色素瘤患者中,注射完成时立即开始动态显像。特别是对于头颈部黑色素瘤,由于皮内注射后淋巴结迭加摄取,淋巴引流快,即刻显像减少了遗漏淋巴结的概率。可以1帧/s的速率(首选用于头颈部)或1帧/2~5 s的速率显像。如此显像可看到放射性药物引流旁路和淋巴管。
动态显像并不常规应用于乳腺癌,因为在上述采集条件下,淋巴链很难显影。同时,探测淋巴链可能需要较长显影时间,存在操作不便的问题。即便如此,如图3所示,动态显像还是有价值的,可以纳入乳腺癌方案。
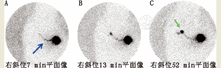

(2)平面显像。平面显像在动态显像之后或穿插进行。平面显像通常每隔5 min进行1次,直至SLNs显影良好。应多体位采集(在乳腺癌中,可根据需要,行前位,侧斜位和侧位显像;在黑色素瘤中,可根据需要,行前(或后)位和侧斜位或侧位显像)。乳腺癌、黑色素瘤或头颈部肿瘤患者的SLNs常在10~60 min内显示良好;但该过程也可能要花费数小时。
在识别SLNs方面,断层显像优于平面显像,因此在SLN方案中使用SPECT或SPECT/CT有重要价值[17]。对于头颈部黑色素瘤,SLNs可能会距原发肿瘤较近,SPECT或SPECT/CT或许有助于定位在平面显像时因邻近注射点而被掩盖的SLNs[18]。对于乳腺癌,SPECT/CT适用于以下情形,如未找到SLN、腋窝外淋巴结或内乳淋巴结显影、怀疑污染、患者体质量指数高、既往行乳腺手术或对侧摄取(图4)[19,20]。
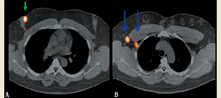

(3)透射成像。可使用泛源(99Tcm 或57Co)获得患者的平面像。此时获得的图像既包括发射数据(来自患者体内的放射性药物),也包括透射数据(来自泛源)。此类图像有身体轮廓(图2),为所示SLN提供了解剖参考。
(4)皮肤标记。一旦SLNs可见,使用术中γ计数探测仪确定每个淋巴结的位置,用笔在皮肤上作标记,这样每个淋巴结都可以在术中对比定位。皮肤标记的位置也可通过放置点源、观察SLN放射性与点源放射性是否叠加来确定。标记至少在2个投影方向进行,以利外科医师手术时预测淋巴结深度,并对其进行三角定位。
当一个区域内见多个淋巴结,或术中探测到不止一个淋巴结,理论上应切除所有放射性淋巴结,以减少假阴性。黑色素瘤研究中常见多条淋巴引流通道,有时难于判断哪条真正指向SLN,建议外科医师尽可能切除所有放射性淋巴结。
1.乳腺癌。比起ALND,SLNB可进一步降低乳腺癌的并发症和死亡率,而其阳性淋巴结检出率则与ALND类似。乳腺癌SLN处理并不存在单一的方案,若能联合使用放射性示踪剂和染料,则效果更好。
(1)假阴性率及其意义。通常SLNB的假阴性率应控制在5%以下。假阴性率是指活组织检查未见而实际上存在淋巴结转移的患者在所有受检患者中所占的百分比。该指标非常重要,因为假阴性可能会导致患者分期下降甚至可能未被治疗。作为美国肿瘤学会指南制定的一部分,2004年1篇纳入69项研究的系统评价显示,SLNB的假阴性率范围为0%~15%[21]。鉴于SLNB结果阴性者的腋窝复发率低[22],操作者必须实施一种SLNB方案,这种方案可在超过95%的患者中识别出至少1个SLN[21]。
美国乳腺外科医师协会发表了资格审查标准,推荐外科医师在独立进行SLNB之前至少在监督下完成20次SLNB或活组织检查后的腋窝淋巴结清扫[23]。
(2)乳腺癌淋巴显像的适应证。乳腺癌行SLNB的一般适应证是活组织检查证实为乳腺癌、临床上无明显腋窝淋巴结转移的早期患者,局部早期意味着肿瘤尚未扩散至乳腺外。
临床上已确立SLNB可以用于下列情况:原发肿瘤为T1、T2期,或原位导管癌(ductal carcinoma in situ, DCIS);拟行乳房切除术;男性患者;或计划行术前系统性治疗[10]。
(3)DCIS。DCIS被认为是最早期的乳腺癌,最初使用空芯针穿刺确诊。根据定义,DCIS并无淋巴结转移。然而,如果病理样本中存在一些高危特征,就显示其具一定的侵袭性,预示有转移的可能。DCIS转移的风险较低,只有0.1%~3%的DCIS患者具有高危病理特征,但是这些高危患者病理特征被遗漏的可能性高达40%[24]。在手术切除(肿块切除术或乳房切除术)和病理分析后,之前空芯针活组织检查诊断为DCIS的肿瘤有时会被重新更正为浸润性癌[25,26,27]。如此再分类是对患者分期诊断的升级。如果发现其较具侵袭性,临床上腋窝淋巴结无转移,就需要行SLNB。在拟行肿块切除术或乳房切除术的DCIS患者中,应行SLNB。如果发现有浸润,就可以避免第2次手术或难以做SLNB的窘境[28]。
(4)多中心乳腺癌。在多中心乳腺癌中使用SLNB仍然是有争议的。尽管越来越多的证据表明对多中心乳腺癌患者行SLNB可能会成为常规[28],但是在示踪剂如何到达SLN,以及如何注射才能最佳反映SLN等方面仍有一些问题。
根据美国临床肿瘤学会指南,若多中心乳腺癌原发肿瘤小于5 cm可行SLN方案,且应表浅注射不要瘤周注射,因为在这种情况下,多中心病灶的SLNB操作类似于单病灶操作[28]。
(5)新辅助化疗。在局部晚期乳腺癌(有1个大的病灶),术前使用新辅助化疗可达到缩小肿瘤和降低分期的目的。这种治疗有时甚至用于已证实有腋窝转移的患者。高达40%的患者成功地降低了分期[29]。在早期乳腺癌中,SLNB可用于某些临床上淋巴结阴性者的新辅助化疗前的分期。这时,患者需接受2次外科干预,即化疗前SLNB和化疗后肿块或乳房切除术[15,29]。新辅助化疗后乳腺癌的分期也是一个重要的预后因子,故SLNB也可用于新辅助化疗后。在这种情况下,应认识到其结果代表的是一个新的基线,与新辅助化疗前的基线不同(即使未曾获得治疗前基线)。多个荟萃分析[15,30,31,32]表明,在新辅助化疗后行SLNBs,SLN识别率可超过90%,假阴性率不到12%。每个新辅助化疗的患者必须被单独评估是否适合执行SLN活组织检查,以及如果适合应何时进行。
由于化疗药物会导致乳腺组织和淋巴引流改变,新辅助化疗后SLNB的成功率可能会降低,假阴性率可能会增高。美国外科学院肿瘤组进行了Z0011(ACOSOG Z0011)试验来澄清这个有争议的问题,主要观察点是女性化疗后SLNB的假阴性率(即是否存在N1期淋巴结转移),结果显示进一步的ALND提示化疗后SLNB假阴性率是12.6%,这一数值被认为是偏高的[33]。
(6)乳腺癌的SLN临床试验。在过去15年,为研究SLNB在乳腺癌中的作用,实施了一些随机临床试验来比较SLNB和ALND。这些试验的结果包括研究并发症发生率、死亡率、假阴性率、SLN识别率和生活质量。有4项多中心随机临床试验发表了5~10年的数据。这些研究均表明SLNB和ALND组在无病生存率[28,34,35,36,37,38]和总生存率[28,35,36,37,39]方面差异无统计学意义。所有试验均显示,SLNB组患者比ALND组患者的手臂和乳腺并发症更少、生活质量更佳。SLNB组与并发症有关的就诊次数、医保支出均减少,而与SLNB相关的满意度增加。评估手臂和乳腺并发症发病率的指标包括淋巴水肿、疼痛、神经损伤和患侧手臂活动范围减少等。术后6~12个月,SLNB组上述所有并发症的发生率均比ALND组低[34,40,41,42,43,44,45]。
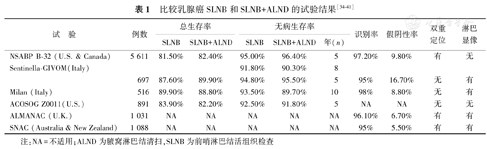
表1总结比较了SLNB组和SLNB+ALND组的重要随机对照试验的概貌和结果,包括总生存率、无病生存率、SLN识别率和假阴性率。表格也标注出每个试验是否都包括双重定位或淋巴显像[34,35,36,37,38,39,40,41]。
| 试 验 | 例数 | 总生存率 | 无病生存率 | 识别率 | 假阴性率 | 双重定位 | 淋巴显像 | |||
|---|---|---|---|---|---|---|---|---|---|---|
| SLNB | SLNB+ALND | SLNB | SLNB+ALND | 年(n) | ||||||
| NSABP B-32 (U.S. & Canada) | 5 611 | 81.50% | 82.40% | 95.00% | 96.40% | 5 | 97.20% | 9.80% | 有 | 无 |
| Sentinella-GIVOM(Italy) | 91.80% | 90.30% | 8 | |||||||
| 697 | 87.60% | 89.90% | 94.80% | 95.50% | 5 | 95% | 16.70% | 无 | 有 | |
| Milan (Italy) | 516 | 89.90% | 88.80% | 93.50% | 89.70% | 10 | 98% | 8.80% | 无 | 有 |
| ACOSOG Z0011(U.S.) | 891 | 83.90% | 82.20% | 92.50% | 91.80% | 5 | NA | NA | 无 | 无 |
| ALMANAC (U.K.) | 1 031 | NA | NA | NA | NA | NA | 96.10% | 6.70% | 有 | 有 |
| SNAC (Australia & New Zealand) | 1 088 | NA | NA | NA | NA | NA | 95% | 5.50% | 有 | 有 |
注:NA=不适用;ALND为腋窝淋巴结清扫,SLNB为前哨淋巴结活组织检查
在ACOSOG Z0011试验中,有1或2个阳性SLNs的患者于手术时随机行ALND或非ALND,有3个或更多阳性淋巴结的患者被排除研究。研究的主要结果为总生存率。仅使用了染料法(生物蓝),未使用放射性示踪剂。
如表1所示,假阴性率最低的为SLNB对腋窝清扫试验(sentinel node biopsy versus axillary clearance, SNAC)和腋窝淋巴定位对腋窝淋巴结清扫试验(axillary lymphatic mapping against axillary clearance, ALMANAC)。这些试验联合应用了术前淋巴结显像和术中双重定位手段。Sentinella-GIVOM试验假阴性率最高。该试验在一个小群体中进行,外科医师在研究开始前对此过程可能没有足够经验。在ALMANAC试验中,所有参与的外科医师都接受了正规培训,以求手术过程规范。试验数据显示,SLNs肿瘤高负荷可能是导致SLN活组织检查假阴性的原因之一。
2.黑色素瘤。皮肤浸润性黑色素瘤的淋巴结转移风险较大,该风险的增加与Breslow厚度的增加一致(表2)[46]。如果所有的SLNs病理均为阴性,很可能没有转移;如果1个或多个SLNs病理为阳性,可能还有其他转移灶。

特定厚度黑色素瘤的淋巴结转移风险[46]
特定厚度黑色素瘤的淋巴结转移风险[46]
| 黑色素瘤厚度 | 风险 | |
|---|---|---|
| 厚(>4 mm) | 40% | |
| 中等(1~4 mm) | 8%~30% | |
| 薄(<1 mm) | ||
| 0.76~1.00 mm | 5% | |
| <0.75 mm | 1% | |
(1)分期。浸润性黑色素瘤是根据病变的特征如厚度(Breslow测算法)和皮肤侵犯程度(Clark分级法)进行分期的;两者均由病理学家根据活组织检查样本确定。美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)[47]和美国癌症联合委员会(American Joint Committee on Cancer, AJCC)最近更新的指南去掉了Clark分级法。因为,纳入核分裂分析后发现该分级法不是一个独立预后因子[48],和Breslow深度相比其对结果的预测较差,重现性和客观性欠佳[49]。但该分级法仍可被用于预测薄型(<1.0 mm)黑色素瘤患者的预后。
SLNB被推荐应用于临床上无局部或远处转移证据、临床分期为T1b~T4b的黑色素瘤,可用于不能确定是否转移的病灶。根据最近的美国临床肿瘤学会指南,将SLNB用于薄型黑色素瘤的证据还不够。然而,如果存在高风险特征(如纵深边缘阳性、溃疡、淋巴血管侵犯、年龄小于40岁、明显的垂直生长表现,或者核分裂细胞增加),则可接受SLNB处理。如果存在阳性SLN,推荐进行淋巴结清扫[50,51,52,53]。
(2)黑色素瘤临床试验。常规的选择性淋巴结清扫显示20%的患者有转移。因此,大约80%的患者因受外科并发症困扰而没有临床获益。单纯临床随访并不是令人满意的处理方法,因为会导致患者对不确定的预后产生焦虑。"多中心选择性淋巴结切除试验Ⅰ"被用于评估SLNB结合术中淋巴结定位是否能探测到上述20%的隐匿性淋巴结转移[54]。
"多中心选择性淋巴清扫切除试验Ⅰ"是1个3期试验,纳入了2 001例皮肤黑色素瘤的患者(主要是薄型或中厚型)。试验的主要目的是评估SLNB对生存的影响。患者接受随机分配,行SLNB并对有转移者行淋巴结清扫,或者观察到淋巴结复发时再行淋巴结清扫术。该研究表明,两组间黑色素瘤患者的特异生存率没有差异。然而,在中厚型和厚型黑色素瘤患者中10年无病生存率SLNB组优于观察组 [55]。虽然许多研究者并不认为该研究结果论证了SLNB的有效性,但至少表明SLNB可以成为一个黑素瘤的标准处理方法。2010年1篇对包括非随机研究在内、共涉及2 633例患者的荟萃分析显示,接受SLNB者的生存更佳,SLNB及对阳性者淋巴结清扫可能会使五分之一的患者生存时间超过5年[56]。
2005年开始了多中心选择性淋巴结切除试验Ⅱ。研究者计划纳入1 925例SLNs转移的患者。如果患者有阳性SLN且满足了研究要求,则将其随机分配接受全淋巴结清扫或淋巴结超声观察,并对其进行10年的随访[57]。该试验的目的是回答SLNs阳性患者是否需要进行全淋巴结清扫的问题。因为,有研究[58]发现约80% SLNs阳性的患者在其单纯SLN切除后并没出现淋巴结的复发,无需进一步的全淋巴结清扫。
3.头颈部恶性肿瘤。SLNB在头颈部鳞状细胞癌中的应用前景广阔。约15%~60%的口腔、口咽和声门上鳞状细胞癌可有隐匿性转移[59]。多项研究[59,60]验证了此方法,总体结果良好。
口腔鳞状细胞癌患者如处于T1或T2期,且颈部扪诊、CT、MR或PET/CT检查等均阴性时应接受SLNB[61],使用术前淋巴显像和术中γ计数探测仪进行定位[62]。显像方案类似于乳腺癌和黑色素瘤,包括动态、平面显像和皮肤标记。
可选择性使用SPECT/CT。单独使用平面显像已足够识别淋巴结[62,63]。然而,头颈部解剖结构复杂,一些原发灶靠近SLNs和其他重要结构,建议在某些情况下应用SPECT/CT[64,65]。
放射性示踪剂注射体积宜小,上限是0.2 ml,病灶周围正常黏膜下注射,每次20 MBq。使用漱口水或冲洗口腔后吐出可能的放射性液体,可避免放射性吞入造成咽喉、食管等处的放射性污染[61,62]。
99Tcm-tilmanocept已被获准用于口腔鳞状细胞癌SLNB。用胶体类示踪剂的结果也令人满意,有的已被常规应用[61]。
其他SLN定位技术,如使用近红外荧光示踪剂(吲哚菁绿),也一直在进行可行性研究[66,67]。最常报道的缺陷是示踪剂迅速转移到二级淋巴结。
这里讨论的所有SLN操作,对患者的辐射剂量都很小,远低于国际放射防护委员会的限定标准。对常规参与SLN操作的医护人员(核医学科技师和医师、放射科医师、外科医师及手术辅助人员、病理科人员等)的年辐射剂量也在可接受范围,也就是说,低于国际放射防护委员会限定的职业人员年度限值[10]。
孕妇在行SLNB之前需确认该操作的必要性。如必要则可行,对患者和胎儿的辐射剂量都很小,也在指南限定范围内[10]。
SLNB目前是乳腺癌和黑色素瘤淋巴结分期的"金标准" ,与更具创伤性的淋巴结清扫相比减少了并发症,死亡率也未增高。在乳腺癌中坚持使用一种选定的技术(包括99Tcm标记示踪剂、生物蓝染料)、至少2个注射部位(一深一浅)以及术前显像有可能产生高识别率和低假阴性率。在多中心随机临床试验中,使用术前淋巴显像和术中双重定位的研究假阴性率最低(5.5%~6.7%)。
黑色素瘤的多中心随机试验显示,随机进行SLNB并对有转移者进行淋巴结清扫,或者观察到淋巴结复发时再行淋巴结清扫术,这2组患者中特定生存率没有差异。然而,对于中厚型或厚型黑色素瘤的患者来说,试验显示10年无病生存率SLNB组比观察组更佳。
SLNB手术在某些中心也常规用于其他肿瘤,但所采取的方案尚未被广泛采纳和常规应用。