分析鞭毛多发形态异常(MMAF)患者精子的形态学特点,对其共同特征和表型进行分析。
对28例表现为鞭毛多发形态异常的患者进行精液分析,光镜下初步形态分析,并通过扫描电镜和透射电镜进一步明确其超微结构特点,对其中一例睾丸组织进行组织病理分析。
28例患者中仅13例(46.4%)患者检测到活动精子,其中12例精子活动率<10%,精子存活率9.0%~80.0%。光镜和扫描电镜下可见MMAF精子鞭毛缺失、短、卷曲、弯折和不规则宽度等多种畸形及其组合,透射电镜表现为精子鞭毛纤维鞘、线粒体鞘等多种结构组装异常,中心微管缺失率41.4%~84.6%。动力蛋白臂缺失或存在,内、外侧动力蛋白臂均缺失的2例患者精液中无活动精子。射精中无活动精子和存在活动精子的两组患者间,各种鞭毛畸形构成比例的差异无统计学意义。
MMAF就是精子鞭毛特异性异常的一种,光镜观察可以初步诊断,利用透射电镜观察可见以中心微管缺失为主要特征的整个鞭毛组装异常,进行明确分析。通过形态学的分析和研究,可以进行具体分型,为明确诊断提供有力依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
全世界超过2 000万男性受到不育症的影响,有10%~15%的夫妇不育,而其中男性因素约占到一半[1]。影响男性不育的因素很多,按照精子特征,不育男性可以诊断为少精子症、弱精子症和无精子症等。其中部分的严重弱精子症,表现为大多数精子存活但不活动,提示着精子鞭毛超微结构存在缺陷。严重的不动精子症经常在原发性纤毛运动障碍(PCD)患者中出现,这是一类以纤毛动力蛋白臂缺失为主的超微结构异常疾病,患者伴随有反复的呼吸道感染症状。还有一部分不动精子症患者表型与PCD类似,其精子在光学显微镜下观察,出现尾部短而粗,僵直等特征,早年间学者将其称为"短尾"、"残段尾"或纤维鞘发育不良[2],目前在中国人群中仅见个别确诊或可疑病例报道,发病率不详。由于越来越多的研究发现这一类精子并非一味的拘泥于一种表型,如今有专家建议称这一类综合征为"鞭毛多发形态异常"(MMAF),通过这一名称来提供了一个更准确表型描述[3,4]。
对精子染色后行光学显微镜形态学分析是对MMAF初步诊断的有效方法,但是,MMAF存在很多不同表型,如果要其进行区分,则需要通过电子显微镜对MMAF精子的具体超微结构异常进行分析。不同的表型存在着不同的遗传学病因,了解各种表型的超微结构形态学特征是临床治疗和遗传学病因分析的首要因素[5]。本研究对28例MMAF病例精子鞭毛缺陷进行光镜下形态学细分,并且对部分病例采取了扫描电镜(SEM)和透射电镜(TEM)进行超微结构观察,希望为MMAF进一步研究奠定基础。
28例患者为2012年3月至2016年8月于南京医科大学附属苏州市立医院和南京医科大学附属第一医院因不育就诊男性,本课题组曾报道了病例1~6部分前期结果[6]。所有患者均为汉族,年龄(31.5±5.3)岁。详细询问家族史,尤其是呼吸道疾病史。患者签署知情同意书参与本项研究,该研究获得南京医科大学附属苏州市立医院伦理委员会通过。
患者控制禁欲天数2~7 d来苏州市立医院手淫取精,精液在37 ℃恒温培养箱放置30~60 min,待液化后检测。常规参数评判标准严格按照世界卫生组织《人类精液检查与处理实验室手册》第5版,采用计算机辅助分析系统(CASA)进行。
按照《WHO人类精液检查与处理实验室手册》第5版标准对精子进行精子形态分析,所有精子涂片均由两名固定的经规范化培训合格的技术人员人工操作完成,并两两比对,进行严格质控。针对短尾精子,按照MMAF诊断标准进行分类,鞭毛分为缺失(无尾)、短、卷曲、弯折和不规则形,1个精子归于1种鞭毛畸形。所有样本中有病例13、14、16、18、19因精子数少、精液量低以及失访等原因未参与光学显微镜检测,参与病例总数为23例。
(1)扫描电子显微镜观察:对患者1~6进行了扫描电镜观察,将精液样本涂片,室温下经2.5%戊二醛(2 h)及1%饿酸(1 h)双固定,梯度乙醇脱水,丙酮、醋酸异戊酣置换,临界点干燥器干燥(HCP-2,HITACHI),离子溅射喷镀仪(E-1020,HITACHI)镀金膜,扫描电镜观察(Stereosean260,Cambridge UK),加速电压20 kV。(2)透射电子显微镜观察:精液样本离心,精子细胞室温下经2.5%戊二醛(2 h)及1%饿酸(1 h)双固定,2%醋酸铀染色,梯度乙醇脱水,丙酮与Epon812包埋剂(Serva Feinbiochenica,NewYork)渗透,包埋剂包埋,半薄切片,光镜定位,超薄切片,醋酸铀和枸橼酸铅染液双重染色,透射电镜观察(TECNAI 10, PHILIPS,Amsterdam,Netherlands),加速电压60 kV。患者病例7、病例10、病例14、病例17和病例20精液标本由于电镜标本制样过程中的未知因素,观察图像不清晰,未列入结果。
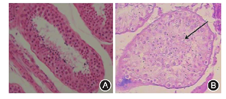
在胞质内单精子注射技术(ICSI)治疗取卵日,对病例8射采取睾丸穿刺获取精子用于临床治疗,剩余睾丸组织标本用Bouin′s液固定,石蜡包埋,切片厚度4~5 μm,进行HE染色,光镜下观察,分析睾丸生精功能。
患者1、14和19的父母为表亲近亲结婚,其余患者来自于非近亲婚配家庭。患者1在1岁时有急性肺炎病史,具体病情未诊断;病例7曾患有充血性鼻炎。其余患者均无反复呼吸道感染、鼻窦炎等病史,本组患者均未发现内脏反位。患者8因阑尾炎于12岁时行阑尾切除术。病例11伴有左侧精索静脉曲张,分别于2013和2015年在外院行精索静脉高位结扎术,手术后患者精液质量无明显改善。
患者精液量0.1~6.2 ml,除病例24为0.1 ml,其他患者精液量均>1.5 ml标准。精液pH值7.2~7.7,精子浓度正常或偏低,其中10例患者在多次精液检查中精子浓度均不能达到15×106/ml。所有患者精液检测精子活动率均低于正常参考值,其中15例患者精液中无活动精子,占53.6%;13例(46.4%)患者至少1次可在精液中找到活动精子,12例精子活动率<10%,见表1。
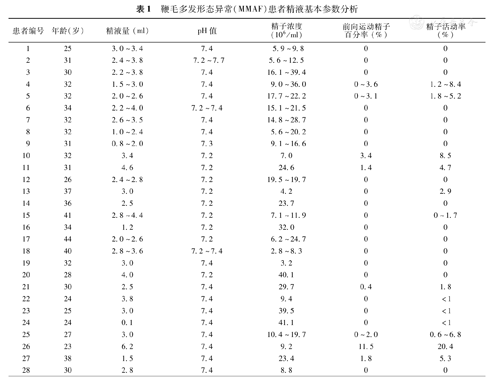
鞭毛多发形态异常(MMAF)患者精液基本参数分析
鞭毛多发形态异常(MMAF)患者精液基本参数分析
| 患者编号 | 年龄(岁) | 精液量(ml) | pH值 | 精子浓度(106/ml) | 前向运动精子百分率(%) | 精子活动率(%) |
|---|---|---|---|---|---|---|
| 1 | 25 | 3.0~3.4 | 7.4 | 5.9~9.8 | 0 | 0 |
| 2 | 31 | 2.4~3.8 | 7.2~7.7 | 5.6~12.5 | 0 | 0 |
| 3 | 30 | 2.2~3.8 | 7.4 | 16.1~39.4 | 0 | 0 |
| 4 | 32 | 1.5~3.0 | 7.4 | 9.0~36.0 | 0~3.6 | 1.2~8.4 |
| 5 | 32 | 2.0~2.6 | 7.4 | 17.7~22.2 | 0~3.1 | 1.8~5.2 |
| 6 | 34 | 2.2~4.0 | 7.2~7.4 | 15.1~21.5 | 0 | 0 |
| 7 | 32 | 2.6~3.5 | 7.4 | 14.8~28.7 | 0 | 0 |
| 8 | 32 | 1.0~2.4 | 7.4 | 5.6~20.2 | 0 | 0 |
| 9 | 31 | 0.8~2.0 | 7.3 | 9.1~16.6 | 0 | 0 |
| 10 | 32 | 3.4 | 7.2 | 7.0 | 3.4 | 8.5 |
| 11 | 31 | 4.6 | 7.2 | 24.6 | 1.4 | 4.7 |
| 12 | 26 | 2.4~2.8 | 7.2 | 19.5~19.7 | 0 | 0 |
| 13 | 37 | 3.0 | 7.2 | 4.2 | 0 | 2.9 |
| 14 | 36 | 2.5 | 7.2 | 23.7 | 0 | 0 |
| 15 | 41 | 2.8~4.4 | 7.2 | 7.1~11.9 | 0 | 0~1.7 |
| 16 | 34 | 1.2 | 7.2 | 32.0 | 0 | 0 |
| 17 | 44 | 2.0~2.6 | 7.2 | 6.2~24.7 | 0 | 0 |
| 18 | 40 | 2.8~3.6 | 7.2~7.4 | 2.8~8.3 | 0 | 0 |
| 19 | 32 | 3.0 | 7.4 | 3.2 | 0 | 0 |
| 20 | 28 | 4.0 | 7.2 | 40.1 | 0 | 0 |
| 21 | 30 | 2.5 | 7.4 | 29.7 | 0.4 | 1.8 |
| 22 | 24 | 3.8 | 7.4 | 9.4 | 0 | <1 |
| 23 | 25 | 3.0 | 7.4 | 39.5 | 0 | <1 |
| 24 | 24 | 0.1 | 7.4 | 41.1 | 0 | <1 |
| 25 | 27 | 3.0 | 7.4 | 10.4~19.7 | 0~2.0 | 0.6~6.8 |
| 26 | 23 | 6.2 | 7.4 | 9.2 | 11.5 | 20.4 |
| 27 | 38 | 1.5 | 7.4 | 23.4 | 1.8 | 5.3 |
| 28 | 30 | 2.8 | 7.4 | 8.8 | 0 | 0 |
光镜下形态分析,正常头部形态占4.7%±4.3%,但精子头部无特异性严重畸形。MMAF精子鞭毛表现为缺失、短、卷曲、弯折和不规则宽度5种类型,鞭毛粗短为典型表现(图1),病变精子占94.0%±5.9%,各种形态所占比例详见表2。
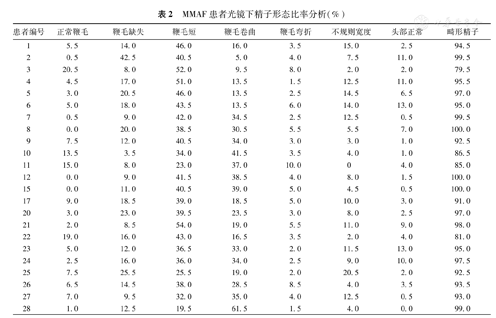
MMAF患者光镜下精子形态比率分析(%)
MMAF患者光镜下精子形态比率分析(%)
| 患者编号 | 正常鞭毛 | 鞭毛缺失 | 鞭毛短 | 鞭毛卷曲 | 鞭毛弯折 | 不规则宽度 | 头部正常 | 畸形精子 |
|---|---|---|---|---|---|---|---|---|
| 1 | 5.5 | 14.0 | 46.0 | 16.0 | 3.5 | 15.0 | 2.5 | 94.5 |
| 2 | 0.5 | 42.5 | 40.5 | 5.0 | 4.0 | 7.5 | 11.0 | 99.5 |
| 3 | 20.5 | 8.0 | 52.0 | 9.5 | 8.0 | 2.0 | 2.0 | 79.5 |
| 4 | 4.5 | 17.0 | 51.0 | 13.5 | 1.5 | 12.5 | 11.0 | 95.5 |
| 5 | 3.0 | 20.5 | 46.0 | 13.5 | 2.5 | 14.5 | 6.5 | 97.0 |
| 6 | 5.0 | 18.0 | 43.5 | 13.5 | 6.0 | 14.0 | 13.0 | 95.0 |
| 7 | 0.5 | 9.0 | 42.0 | 34.5 | 2.5 | 12.5 | 0.5 | 99.5 |
| 8 | 0.0 | 20.0 | 38.5 | 30.5 | 5.5 | 5.5 | 7.0 | 100.0 |
| 9 | 7.5 | 12.0 | 40.5 | 34.0 | 3.0 | 3.0 | 1.0 | 92.5 |
| 10 | 13.5 | 3.5 | 34.0 | 41.5 | 3.5 | 4.0 | 1.0 | 86.5 |
| 11 | 15.0 | 8.0 | 23.0 | 37.0 | 10.0 | 0 | 4.0 | 85.0 |
| 12 | 0.0 | 9.0 | 41.5 | 38.5 | 4.0 | 8.0 | 1.5 | 100.0 |
| 15 | 0.0 | 11.0 | 40.5 | 39.0 | 5.0 | 4.5 | 0.5 | 100.0 |
| 17 | 9.0 | 18.5 | 39.0 | 18.5 | 5.0 | 10.0 | 3.0 | 91.0 |
| 20 | 3.0 | 23.0 | 39.5 | 23.5 | 3.0 | 8.0 | 2.5 | 97.0 |
| 21 | 2.0 | 8.5 | 54.0 | 19.0 | 5.5 | 11.0 | 9.0 | 98.0 |
| 22 | 19.0 | 16.0 | 43.0 | 16.5 | 3.5 | 2.0 | 4.0 | 81.0 |
| 23 | 5.0 | 12.0 | 36.5 | 33.0 | 2.0 | 11.5 | 13.0 | 95.0 |
| 24 | 2.5 | 16.0 | 36.0 | 34.0 | 2.5 | 9.0 | 10.0 | 97.5 |
| 25 | 7.5 | 25.5 | 25.5 | 19.0 | 2.0 | 20.5 | 2.0 | 92.5 |
| 26 | 6.5 | 14.5 | 38.0 | 28.5 | 8.5 | 4.0 | 3.5 | 93.5 |
| 27 | 7.0 | 9.5 | 32.0 | 35.0 | 4.0 | 12.5 | 0.5 | 93.0 |
| 28 | 1.0 | 12.5 | 19.5 | 61.5 | 1.5 | 4.0 | 0.0 | 99.0 |
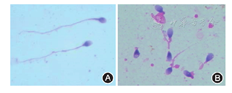

注:A:正常精子,B:MMAF精子
与光镜观察相比,扫描电镜更加清晰地观察到精子鞭毛畸形。相较正常精子(图2A),MMAF部分精子鞭毛仅存末段样的突出,光镜下则不能观察到,或出现尾部卷曲和异常粗短的现象(图2B)。虽然扫描电子显微镜可以更好的突出MMAF患者的精子的畸形,但是由于光镜下形态分析已经可以对MMAF做出初步诊断,所以并未对所有患者采取扫描电镜观察。
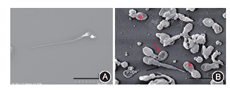

注:(A:正常精子;B:MMAF精子,*鞭毛缺失,#不规则宽度鞭毛,黑色箭头:鞭毛粗短;红色箭头:鞭毛卷曲)
在透射电镜下,正常精子可见鞭毛组装正常,线粒体鞘和纤维鞘结构和位置正常,轴丝为典型的9+2微管结构,9+2结构外存在完整的外周致密纤维,而在9根外周微管上,内外动力蛋白臂完整可见,中央微管与外周微管间,放射辐正常组装(图3A,图3B,图3C)。MMAF精子纵切面可见纤维鞘以及线粒体鞘等整个鞭毛未完成组装,而是紊乱的堆积在精子尾部,但颈部可见正常中心粒结构(图3D,图3E,图3F)。横切面可见包裹在鞭毛轴丝外的纤维鞘明显增厚或出现结构紊乱,线粒体数目减少、缺失或位置异常,以及轴丝微管结构缺陷(图3G,图3H,图3I)。MMAF精子最常见的异常是轴丝的异常,而其中最明显的特征性异常是中心微管缺失,病例1~6和病例8精子中心微管缺失率分别为59.1%、78.1%、81.0%、41.4%、62.1%、73.4%和84.6%。MMAF精子的另一大异常是动力蛋白臂缺失,但是值得注意的是并非所有患者精子都存在动力蛋白臂的异常,而在同一患者样本中也可同时见到动力蛋白臂缺失或正常精子。病例1和病例5精子内、外侧动力臂均缺失,病例1仅在1个切面见到完整的动力臂;病例3、病例4和病例8动力臂存在;病例6未找到适合观察动力臂的切面。除此之外,少数患者,如病例2,可在多个横切面中可见外周致密纤维数目异常,表现为数目加倍(图3J)。少数精子可见鞭毛结构完全破坏,微管散乱分布(图3K,图3L);病例1~6和病例8微管结构完全紊乱的比例分别为12.9%、14.1%、3.2%、20.0%、27.6%、3.8%和7.7%。值得一提的是,在同一患者的多个精子中,这些异常或单独或伴随着出现。
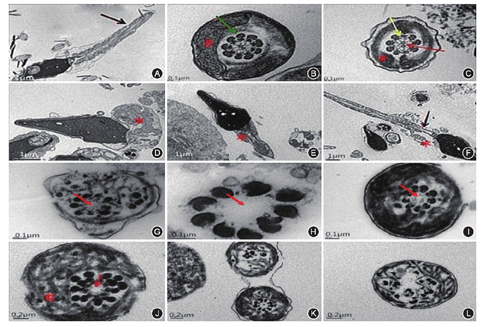

注:A~C:正常精子;D~F: MMAF精子纵切面;G~L:MMAF精子横切面。*:线粒体鞘;#:纤维鞘;黑色箭头:Jensen环;绿色箭头;外周致密纤维;红色箭头:中心微管;黄色箭头:动力蛋白臂
弱精子症在临床十分常见,导致严重弱精子症的原因很多,其中比较常见的是精子鞭毛的异常,根据产生原因,精子鞭毛的异常分为非特异性鞭毛异常(NSFA),如:精索静脉曲张、生殖道感染、不良生活方式等引起的鞭毛异常,还有一种为特异性异常,MMAF就是精子鞭毛特异性异常的一种。相较于前者通过祛除病因或者经验性治疗后可能得到改善,特异性异常往往经验性治疗无效。本研究纳入的28例病例也存在长年的不育治疗无效病史,如患者4在外院尝试治疗2年,期间经过10余次精液检测,虽精子活力有波动,均无实质性改善。
MMAF患者精子最明显的常规参数异常是活动力的极度低下,这是由于鞭毛结构存在异常导致的运动障碍,此次研究的患者均表现为弱精子症,精子活动率低于正常值,精子浓度正常或低于参考值。患者中有10例表现为少精子症,具体原因不详。文献报道的MMAF病例中也存在少精子症,作者未对原因进行分析[3]。本研究中精子存活率为9.0%~80.0%,但即使精子存活率为0%,MMAF也并非继发于死精子症[7]。患者8睾丸病理切片观察。光镜下的睾丸病理学与文献报道相符[7]。
光镜下的精子形态学分析可以做出MMAF的初步诊断,我们认为精子鞭毛粗短是MMAF精子光镜下的典型表现,根据MMAF缺陷精子所占比例,病例可分为完全型和不完全型[8],但分类标准尚未达到共识。本研究中对MMAF精子透射电镜观察到的超微结构,表现为精子鞭毛轴丝和轴丝外附属结构的组装异常。我们观察到MMAF精子中心微管的缺失率在41.4%~84.6%,是MMAF超微结构的共性之一。Coutton等[9]也认为中心微管的缺失是MMAF的主要表现。MMAF精子不仅是纤维鞘的增厚和发育不良,而是包括线粒体鞘在内的整个精子鞭毛组装异常[10]。动力蛋白臂缺失往往表现为完全性MMAF[8],如病例1和病例5精子内外侧动力蛋白臂缺失。但病例8虽然存在内、外侧动力蛋白臂,精子仍100%不活动,可能由于未观察到动力臂的细微缺陷。
MMAF在中国人群中鲜有报道,作为严重弱精子症和完全性不活动精子的一种病因,值得临床关注。我们建议对发现的可疑病例通过光镜下精子形态观察做出初步诊断,并建议根据超微结构分型,而对于MMAF的详细分型需要借助未来遗传学病因的研究,目前针对MMAF的遗传学研究并不是很多,AKAP(A-kinase anchoring protein)蛋白家族是迄今为止被认定对DFS/MMAF影响较大的蛋白之一。研究者目前发现至少有两种运输蛋白方式参与了精子形态的发生,即IMT和鞭毛内运输(IFT);而且敲除IFT和IMT相关基因后,精子鞭毛形成严重受损[11]。我们猜测,MMAF的发生与IFT和IMT受损相关。最近本课题组通过全基因组测序和杂交芯片发现了CFAP43与CFAP44的双等位基因突变会导致MMAF,而通过CRISPR/Cas9技术获得这两个基因的敲除模型小鼠,发现这两个基因缺失的雄性小鼠均呈现出MMAF表型[12]。MMAF可能与PCD具有相同的致病基因,但是由于基因缺陷类型不同而造成了不同的精子表型,比如DNAH1可以造成MMAF,也是PCD的致病基因之一[13],所以对MMAF进行更深入的遗传学研究是十分有必要的。
ICSI对于MMAF患者是可靠的辅助生殖手段,在过程中,如何在完全不动的精子中挑选存活着且质量好的精子是个关键问题,采用睾丸内的精子代替射出的精子行ICSI是一种可行的选择[14]。