
探讨CD4+ T细胞表面CD1d分子对实验性自身免疫性脑脊髓炎(EAE)小鼠模型疾病进展的影响。
建立C57BL/6小鼠的EAE模型,在疾病进展的不同时期分离小鼠脾细胞,用流式细胞术检测活化与非活化CD4+ T细胞表面的CD1d+细胞比例。
对照组(正常组和CFA组)、EAE组发病高峰期以及疾病恢复期相比较,对照组表达CD1d分子的CD4+ T细胞数量百分率为(8.98±0.36)%,EAE组高峰期及恢复期表达CD1d分子的CD4+ T细胞数量百分率分别为(2.14±0.15)%、(13.80±0.84)%,差异有统计学意义(P<0.05)。
验证了EAE发病过程中表达CD1d分子的CD4+ T细胞数量的变化趋势,为进一步研究EAE模型病程进展中CD4+ T细胞和NKT细胞之间的相互作用奠定基础。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性硬化(MS)是最常见的一种累及中枢神经系统(包括脑和脊髓)的自身免疫性脱髓鞘性疾病,实验性自身免疫性脑脊髓炎(EAE)是研究人类多发性硬化的理想动物模型。大量免疫病理研究证实,在多发性硬化患者体内,CD4+T细胞识别自身髓鞘碱性蛋白抗原,触发免疫应答,导致免疫细胞异常活化[1,2]。有报道指出获得性免疫缺陷综合征(AIDS)患者体内CD1d明显比正常人低,可能与患者免疫系统受损有关[3],这说明CD1d在维持自身免疫稳定方面起到重要作用,但具体机制尚不十分清楚。本研究应用C57BL/6小鼠制备EAE模型[4],通过观察不同发病时期小鼠外周免疫器官(脾脏)中CD4+T细胞表面CD1d表达水平的变化,探讨多发性硬化病情进展过程中,CD1d分子的影响机制。
(1)实验动物:C57BL/6雌性小鼠32只,6~8周龄,体质量15~18 g,由中科院上海实验动物中心提供。(2)仪器与试剂:鼠源MOG35-55多肽(MEVGWYRSPFSRVVHLYMGK)由北京赛百盛基因技术公司合成,纯度≥95%;弗氏完全佐剂(CFA)购自美国Sigma公司;百日咳毒素(1 μg/ml)无菌水溶液购自美国Sigma公司;小鼠PE-抗CD4抗体;小鼠FITC-抗CD1d抗体;BD公司流式细胞仪。
将C57BL/6小鼠随机分为3组,EAE组24只,CFA组及正常组各8只。(1)EAE组:将3 mg MOG35-55多肽[5]溶于1 ml PBS(0.01 mol/ml),与CFA等体积混合,使用注射器反复推拉约500下,使之成为滴于水中晃之不散的乳化产物。选取小鼠背部脊柱两侧四点进行皮下注射,每只老鼠注射0.2 ml乳剂,其中MOG35-55多肽计量为300 μg/只。然后立即腹腔注射百日咳菌稀释液0.1 ml,48 h后再次腹腔注射百日咳菌稀释液0.1 ml。(2)CFA组:将1 ml PBS(0.01 mol/ml)与CFA等体积混合均匀后,按照EAE组相同的方法进行注射。(3)正常组:未做任何处理。
免疫后每天观察小鼠并记录体质量,以Kerlero de Rosbo等[6]提出的标准对其进行神经功能评分。1分:尾巴无力;2分:尾巴瘫痪;2.5分:单侧后肢轻度无力;3分:单侧后肢显著无力;4分:单侧后肢瘫痪;4.5分:单侧后肢瘫痪伴对侧后肢无力或者同侧前肢轻度无力;5分:双侧后肢瘫痪;6分:双侧后肢瘫痪伴单侧前肢瘫痪。
(1)取CFA组、正常组、症状高峰期EAE组的小鼠各1只,称重,给予腹腔注射0.03 ml/kg体质量的10%水合氯醛将小鼠麻醉;生理盐水心脏灌流、4%多聚甲醛灌流固定后,取出脑组织,OCT包埋后,冰冻切片,HE染色。(2)分别于发病前期(免疫后10 d)、发病高峰期(发病后3 d)以及疾病恢复期(发病后7 d)处死小鼠,分离脾脏,获取脾细胞,用流式细胞术检测CD4、CD69、CD1d。
所有数据均用 ±s表示,组间比较行方差分析,应用SPSS 13.0软件对数据进行分析,P<0.05为差异有统计学意义。
±s表示,组间比较行方差分析,应用SPSS 13.0软件对数据进行分析,P<0.05为差异有统计学意义。
EAE组小鼠发病前毛色发暗,活动减少,反应迟钝,食欲较差。首发症状为尾巴无力下垂,体质量明显减轻(图1),临床评分随时间延长加重,继而出现后肢无力、后肢瘫痪等症状。发病小鼠临床症状无缓解,部分稍有减轻,活动量稍有增加,但反应仍较迟钝,体质量没有进一步下降。其余两组均无明显变化,食欲好、活动多、反应敏捷、尾部张力正常。
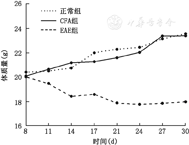

实验结束时,EAE组24只小鼠有21只发病,发病率为87.5%,发病时间为(12.7±1.64) d,高峰期症状评分为(3.35±0.58)分,CFA组和正常组小鼠均没有发病。
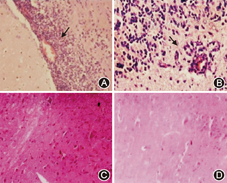
HE染色显示,EAE组小鼠发病高峰期,小血管周围出现大量炎性细胞,成袖套样改变,浸润细胞以淋巴细胞为主,神经细胞肿胀、变性。灰白质均受累,脑白质神经纤维束间、脑膜和脊膜也发现炎性细胞浸润。对照组(CFA及正常组)小鼠神经组织病理检查未见明显的病理改变(图2)。

流式细胞术检测结果显示,对照组(正常组和CFA组)、EAE组发病高峰期以及疾病恢复期相比较,对照组表达CD1d分子的CD4+ T细胞数量百分率为(8.98±0.36)%,EAE组高峰期及恢复期表达CD1d分子的CD4+ T细胞数量百分率分别为(2.14±0.15)%、(13.80±0.84)%,差异有统计学意义(P<0.05)。
多发性硬化(MS)是一种发病机制复杂的慢性炎性脱髓鞘疾病,主要累及中枢神经系统,病因至今尚未完全明了。但已有研究表明,免疫因素在MS的发病中起着关键作用。MOG35-55诱导建立的小鼠EAE模型与人类中枢脱髓鞘疾病多发性硬化极为相似,因而成为研究多发性硬化发病机制、病理改变的最佳选择。诸多免疫因素中,CD4+ T细胞是介导该疾病发生发展的关键因素,不同发病阶段表达的细胞因子能够介导髓鞘破坏、调节异常免疫反应,对疾病发展起重要作用。
CD4+T辅助细胞(Th)是重要的免疫调节细胞,有四种细胞亚型,Th1、Th2、Th17以及Treg。Th1细胞具有促炎症反应作用,Th2细胞具有抗炎作用[7];Th17细胞可诱导严重的自身免疫反应[8],Treg细胞具有很强的免疫抑制能力[9]。自然杀伤性T细胞(NKT)具有双向免疫调节功能,能促进或者抑制CD4+T的发育,与自身免疫性疾病(如系统性红斑狼疮、多发性硬化症等)有着密切关系。NKT细胞在EAE模型中的免疫调节作用一直存在争议,有实验用α-GalCer刺激野生型与IL-4和IL-10基因敲除的EAE小鼠[10],说明NKT细胞通过活化CD4+ Th2免疫反应抑制EAE病情的进展。但α-GalCer作用于CD1d基因敲出的CD1d-/- EAE小鼠时,病情仍可缓解[11],说明NKT细胞的激活不是唯一缓解EAE病情的途径。
本实验中,我们检测了EAE模型疾病进展不同时期小鼠脾脏中CD4+T细胞表面的CD1d+表达情况,与对照组(正常组和CFA组)相比,EAE模型组在发病高峰期表达CD1d分子的CD4+ T细胞数量百分率明显下降,疾病恢复期表达CD1d分子的CD4+ T细胞数量百分率明显升高。在MS患者中,复发期外周血中NKT细胞的数量减少,缓解期CD4+NKT细胞的数量增加,与本实验结果类似。可能的机制为抗原除了主要刺激CD4+Th1细胞介导炎症反应外,还可通过CD1d APC细胞提呈给NKT细胞,而NKT细胞可通过某种信号途径上调CD1d分子的表达,表现为疾病恢复期表达CD1d分子的CD4+ T细胞数量百分率明显升高,提示疾病恢复期CD1d限制性T细胞的保护作用。而发病高峰期表达CD1d分子的CD4+ T细胞数量百分率明显下降则可能是其他验证细胞数量增多导致的相对减少。关于EAE模型病程进展中CD4+ T细胞和NKT细胞之间的相互作用,还有待进一步研究。



























