
分析恶性血液病合并毛霉菌感染患者的临床特征、诊断、治疗及预后。
分析郑州大学附属洛阳中心医院2016年6月至2017年9月诊治的3例恶性血液病合并毛霉菌感染患者的临床资料,并复习相关文献。
3例均为恶性血液病患者,其中1例为复发难治急性髓系白血病(AML)。3例患者肺部影像学检查结果均提示毛霉菌病,经活组织检查获得病原菌后明确诊断。两性霉素B/两性霉素B脂质体单药或联合泊沙康唑在2例患者中取得良好疗效,另1例患者因原发病不缓解,且发生毛霉菌血行播散,治疗失败。
早期精确诊断、治疗原发病或去除危险因素、新药以及联合治疗方案对于改善恶性血液病合并毛霉菌感染患者的预后具有重要意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
毛霉菌病是由毛霉目真菌引起的一类临床少见的严重机会性感染,大多病情凶险,病死率高,其危险因素包括恶性血液病、接受免疫抑制剂治疗等[1]。尤其是恶性血液病合并毛霉菌感染,近十年来相关研究未有重大进展,多数患者在确诊后12周左右死亡[1]。我们从2016年6月至2017年9月诊治了3例恶性血液病合并毛霉菌感染患者,现报道如下并对相关文献进行复习。
例1,男性,76岁,以发现血常规异常6个月余为主诉入院,2015年10月因发现血常规异常在外院确诊为急性髓系白血病(AML)-M5a伴FLT3-ITD阳性[骨髓增生异常综合征(MDS)转化],给予2个疗程地西他滨(25 mg/d×5 d)去甲基化治疗,出院时复查患者骨髓象示原始细胞0.095。出院后患者持续索拉菲尼400 mg口服2次/d治疗。2016年4月2日患者因血小板计数(Plt)4×109/L收入我科,骨髓象示原始细胞0.45,给予地西他滨(10 mg/m2 3次/周),三氧化二砷(10 mg,隔日1次,共6次)的方案化疗,效果欠佳,复查骨髓穿刺结果示原始细胞0.56。2016年5月24日再次入我院,血常规示白细胞计数(WBC)16.44×109/L、血红蛋白(Hb)62 g/L、Plt 14×109/L;外周血原始幼稚细胞0.71;合并肺部感染,予多种抗生素及抗真菌药物,效果欠佳。WBC进行性上升至53.68×109/L,给予地西他滨25 mg第1天至第3天,阿糖胞苷100 mg第1天至第5天,去甲氧柔红霉素5 mg第1天至第2天化疗。2016年6月19日胸部CT示右肺中下叶及右肺门可见球形密度增高影,呈反晕征;1,3-β-D葡聚糖(G试验)(-),半乳甘露聚糖(GM试验)(-),提示患者可能为毛霉菌感染。立即给予两性霉素B脂质体(LAmB)每天3 mg/kg联合泊沙康唑口服液200 mg 4次/d口服治疗。3 d后患者右脚可见多处瘀斑伴疼痛,瘀斑局部发黑,周围皮肤稍发红,行病变处皮肤活组织检查,组织培养提示毛霉菌生长,诊断为毛霉菌感染(图1)。治疗7 d后患者出现右侧肢体无力,双侧瞳孔缩小,脑部CT示左侧基底节区混杂密度影,结合病史考虑中枢神经系统白血病,不排除毛霉菌中枢播散,治疗效果欠佳,5 d后患者因呼吸衰竭死亡。
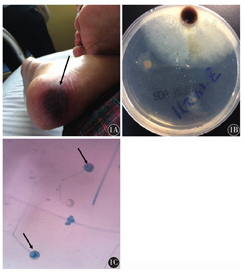

例2,男性,68岁,以确诊原发性血小板增多症2年为主诉于2016年10月14日入我院。患者于2014年4月28日在我院确诊为原发性血小板增多症,给予羟基脲降血小板,患者血小板正常后出院。近1年患者未随访。本次入院血常规示WBC 1.09×109/L、Hb 66 g/L、Plt 5×109/L,骨髓活组织检查示造血组织增生不均匀,大部分区域增生极度减低,局灶见少许纤维组织增生,网银染色2级,考虑继发性骨髓纤维化,停用羟基脲治疗,并予升高WBC及输血支持治疗。入院第3天患者出现发热,最高体温38.5 ℃,伴咳嗽,予头孢唑肟抗感染,效果欠佳,仍持续发热。2016年10月19日胸部CT检查示右肺密度增高影,反晕征,立即行肺穿刺活组织检查。肺组织培养结果提示毛霉菌感染,给予两性霉素B(AmB)静脉滴注,起始剂量为每天0.5 mg/kg,逐渐增大至最大耐受剂量,并密切监测不良反应。2周后患者体温逐渐恢复正常,治疗21 d后患者好转出院,院外继续AmB治疗。
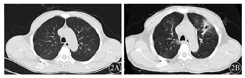
例3,男性,59岁,以发热10 d为主诉于2017年7月22日入我院。患者10 d前无明显诱因出现发热,最高体温38.5 ℃。入院后查胸部CT示双肺多发结节,真菌感染待排除,细菌感染不排除(图2A);查血常规示WBC 0.62×109/L、中性粒细胞计数(NEUT)0.17×109/L、Hb 58 g/L、Plt 48×109/L;凝血示血浆凝血酶原时间(PT)11.4 s,活化部分凝血活酶时间(APTT)27.6 s,纤维蛋白原(FIB)3.98 g/L,血浆凝血酶时间(TT)14.7 s,D-二聚体280 ng/ml;骨髓涂片示:异常早幼粒细胞0.835。结合流式细胞学、染色体、融合基因等检测结果确诊为急性早幼粒细胞白血病(APL)。予全反式维甲酸(ATRA)每天20 mg/m2+去甲氧柔红霉素(IDA)每天8 mg/m2,第2、4、6天+三氧化二砷(ATO)每天0.16 mg/kg,广谱抗生素联合伏立康唑抗感染治疗,患者胸痛、胸闷症状进行性加重,2017年8月5日复查CT示左肺上叶新发高密度影,反晕征,真菌感染(毛霉菌不除外),建议行肺穿刺活组织检查,伴有左侧胸腔积液。遂改用AmB抗真菌治疗,起始剂量为每天0.5 mg/kg,逐渐增大至最大耐受剂量,并密切监测不良反应。2017年8月7日行CT引导下肺穿刺活组织检查。1周后肺活组织培养考虑毛霉菌感染,因患者无法耐受AmB,改为泊沙康唑200 mg/6 h口服。2017年8月15日CT示疾病较前进展,双肺感染并左肺上叶空洞形成,双肺磨玻璃影增多,左侧胸腔积液增多并左下肺膨胀不全,右侧胸腔少量积液,加用利奈唑胺覆盖G+球菌,加用AmB雾化吸入抗真菌治疗。2017年8月24日CT示双肺感染并左肺上叶空洞形成较前好转。2017年9月3日患者骨髓涂片及微小残留病检测均提示完全缓解。2017年9月6日CT示双肺感染并左肺上叶空洞形成,空洞略变小,闭合,肺部病情较前稳定,请胸外科会诊,建议手术治疗,患者家属拒绝。患者于2017年9月14日出院,出院时血常规示WBC 5.78×109/L、Hb 76 g/L、Plt 419×109/L,出院后继续口服泊沙康唑。随访至2017年10月26日,患者CT示病情好转(图2B)。

毛霉菌病是一种临床较少见的机会性感染,具有急性发作、进展迅速、侵袭血管以及死亡率高等特征[1]。血液系统恶性肿瘤、免疫抑制剂治疗、中性粒细胞减少等是毛霉菌病最常见的危险因素,本组报道的3例患者均为恶性血液病合并的毛霉菌感染。
毛霉菌可侵犯机体不同部位,在临床上表现为多种类型,包括鼻脑型、肺型、皮肤型、播散型、胃肠型、单一病灶型等[1]。本组3例患者均出现肺毛霉菌感染,其中例1患者还出现皮肤和中枢毛霉菌感染。肺毛霉菌病一般进展快,亦有亚急性起病,主要症状为咳嗽、发热、胸痛、呼吸困难、咯血,临床表现缺乏特异性,且尚无生物标志物可用于该病的诊断[2]。除此之外,有研究表明,毛霉菌病患者还常合并细菌和病毒感染[3],与本组例3患者一致,抗毛霉菌治疗效果欠佳时加用抗球菌药物利奈唑胺后症状明显改善。混合感染可导致真菌感染诊断的延缓和抗真菌治疗的失败[3]。本组例1患者具有复发难治AML的基础,长期服用伏立康唑片预防真菌感染,临床表现为高热,无咳嗽、咳痰或咯血,正规的抗生素治疗前期有效,在此之前我科尚无确诊的毛霉菌病例,这在一定程度上造成了临床上对毛霉菌感染诊断和治疗的认识不足。因此对于有免疫缺陷基础疾病的患者,临床上经正规抗生素治疗效果欠佳或常规真菌预防的基础上出现突破性感染时,一定要考虑毛霉菌病,尽快行影像学检查及有创检查寻找病原菌,以免延误治疗[4]。
肺部影像学改变在肺毛霉菌病诊断中的价值不可忽视,主要改变为渗出实变、多发结节、厚壁空洞等,特征性不强,但反晕征强烈提示毛霉菌感染[2,5],本组3例患者肺部CT检查均报告出现反晕征。除此之外,对于高度怀疑肺毛霉菌感染的患者,鼻窦部CT检查也是推荐的,因与曲霉菌相比毛霉菌更容易同时侵犯肺和鼻窦[6]。本组3例患者均未出现鼻窦症状,为皮肤/肺穿刺培养确诊,但例1患者最终出现中枢症状,不排除鼻窦感染逆行中枢的可能性,未行鼻窦CT检查与对该病认识不足有关。活组织检查发现特征性菌丝和病理改变或组织、无菌体液培养阳性仍然是诊断毛霉菌病的金标准[4]。虽然血液肿瘤患者常伴有血小板减少和凝血障碍,但是在具有血小板输注和新鲜血浆支持的情况下,怀疑毛霉菌感染的患者仍应考虑进行活组织检查。本组例2、例3患者经正规抗感染治疗效果不佳时,在血小板较低情况下给予血小板输注后进行肺部活组织穿刺检查获得了病原菌,从而明确诊断,使患者及早治疗。
目前对毛霉菌病的早期精确诊断仍然是改善患者预后的重要阻碍。近年来,不依赖于培养或组织病理学的诊断方法如聚合酶链反应(PCR)成为研究热点。2013年Bernal-Martínez等[7]报道对22例培养的毛霉菌菌株和12例确诊的毛霉菌病患者活检标本中毛霉菌核糖体DNS ITS序列进行多重实时定量PCR,检测特异度达到100%。随后Ino等[8]也报道通过PCR检测患者血清中毛霉菌目的循环DNA来实现对毛霉菌病的诊断,诊断特异度达到了100%,此外该方法还可定量毛霉菌DNA的负荷量,从而可作为治疗效果的监测手段。虽然目前PCR因检测方法或结果解读等尚未有统一标准而在临床上未得到广泛应用,但该方法在早期诊断毛霉菌病中具有巨大应用前景。
在治疗方面,早期诊断、治疗原发疾病或去除危险因素、抗真菌药物及手术均是影响毛霉菌病预后的关键。AmB对毛霉菌及曲霉菌均有作用,是治疗毛霉菌病的一线用药,但该药不良反应大,累积较大剂量时可发生不可逆的肾损害,用药过程中需密切监测肝、肾功能,在确诊的情况下如能耐受应尽快应用[4,6]。我们报道的例2患者应用单药AmB治疗,取得良好疗效,而例3患者在单药应用AmB 8 d后出现肝损害,后改用泊沙康唑联合AmB雾化吸入,肝功能逐渐好转,肺部病情得到改善。在经济条件允许的情况下,不良反应较小的LAmB相对来说具有更强的组织渗透性,且肾毒性小,能更好地改善患者预后[4,6]。近些年,泊沙康唑在抗毛霉菌以及预防真菌感染中的作用得到广泛关注,欧洲指南强烈推荐泊沙康唑200 mg 4次/d应用于毛霉菌病的挽救性治疗[9]。一项泊沙康唑挽救性治疗91例对其他抗真菌药物耐药、复发或不耐受的毛霉菌病患者的回顾性研究发现,泊沙康唑800 mg/d持续治疗12周,60%的患者病情好转,21%的患者疾病稳定[10]。此外,毛霉菌病的联合治疗也越来越多被应用于临床[11],如卡泊芬净联合LAmB、泊沙康唑联合LAmB或AmB等,均明显提高了患者生存率。
总之,毛霉菌病在临床上的发病率逐渐增高,目前其预后仍不理想。新的影像学诊断工具、实验室诊断方法的开发、新药的出现以及联合治疗方案的提出将不断提高毛霉菌病的早期诊断、监测和治疗效果。
无



























