
评估利妥昔单抗联合改良NHL-BFM-90方案对儿童和青少年伯基特淋巴瘤(BL)的远期疗效。
回顾性分析病理确诊的67例接受改良NHL-BFM-90方案±利妥昔单抗治疗的初治儿童和青少年BL患者的临床特征与疗效。
64例BL患者(95.52%)获完全缓解(CR),3例(4.48%)获部分缓解(PR),总有效率(CR+PR)为100%。中位随访44(3~89)个月,3年和5年总生存(OS)率分别为92.54%和88.98%,3年和5年无进展生存(PFS)率均为90.34%。低危、中危和高危组患者的5年OS率分别为100%、91.7%和80.0%,差异有统计学意义(P=0.048)。55例(82.09%)联合利妥昔单抗治疗,与单纯化疗组的5年OS和PFS分别为74.3%和78.6%相比,利妥昔单抗联合化疗组BL患者的5年OS和PFS分别为95.2%和95.5%,显示出明显生存优势(P值分别为0.021和0.036)。主要不良反应为骨髓抑制和黏膜炎,无治疗相关死亡。
利妥昔单抗联合改良NHL-BFM-90方案对儿童和青少年BL疗效显著,明显改善患者的长期生存率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
伯基特淋巴瘤(BL)是一种高度侵袭性成熟B细胞非霍奇金淋巴瘤(NHL),好发于儿童及青少年,分为流行性、散发性和免疫缺陷相关3种亚型。除非洲BL具有流行性外,其他地域为散发性。既往BL的治疗一般采用1~2年的化疗联合放疗,长生存率低。自20世纪80年代以来,欧美国家一系列脉冲式短疗程强化疗方案,如Hyper-CVAD/MA(大剂量环磷酰胺、长春新碱、阿霉素和地塞米松/大剂量甲氨蝶呤和阿糖胞苷)方案、CODOX-M/IVAC(环磷酰胺、长春新碱、阿霉素和大剂量甲氨蝶呤/异环磷酰胺、依托泊苷和大剂量阿糖胞苷)方案、德国BFM-90/95方案和法国LMB-89方案等,极大改善了患者的预后,但重度骨髓抑制、肝肾功能损害和黏膜炎等致命性毒性不可忽视[1,2,3]。优化BL的治疗,尤其是对于儿童及青少年患者,需结合国人特点降低治疗相关毒性,按期完成整体治疗规划,对改善长期疗效至关重要。BL细胞强表达CD20分子,利妥昔单抗的靶向联合化疗进一步改善了BL的预后[4,5]。本研究采用改良NHL-BFM-90方案±利妥昔单抗治疗儿童及青少年BL,现对其远期疗效进行分析和总结。
回顾性分析2010年7月至2018年6月郑州大学附属肿瘤医院和郑州市第一人民医院收治的67例儿童及青少年BL患者的临床资料,包括基本信息、临床诊断及分期、危险因素、治疗分组等。治疗前常规检查患者血常规、肝肾功能、乳酸脱氢酶(LDH)水平、EB病毒(EBV)和人类免疫缺陷病毒(HIV)检测等。所有患者监护人或患者(年龄≥16岁)知情同意后开始治疗。
所有患者均经组织病理以及免疫组化检查,并具备两家及以上三级甲等医院病理专家会诊并确诊。按世界卫生组织(WHO)2016造血与淋巴组织肿瘤的病理诊断和分型标准进行诊断和分型[6],骨髓侵犯的患者同时行骨髓流式细胞术检测。治疗前常规进行血常规、肝肾功能、LDH水平、EBV和HIV检测等。根据病史、体检、LDH水平、骨髓和脑脊液、B超、CT和(或)MRI和(或)全身PET/CT等检查结果,按照国际常用的儿童及青少年BL的St.Jude分期标准进行临床分期[7]。
根据临床分期、初诊时血清LDH水平和2个疗程后疗效将患者分为低危组(Ⅰ期和Ⅱ期)、中危组(Ⅲ期或Ⅳ期伴血清LDH<500 U/L)、高危组(Ⅳ期伴血清LDH≥500 U/L或2个疗程后疗效≤ PR的中危组患者)。所有患者治疗前及治疗期间均采用水化、碱化、别嘌呤醇、利尿等;首次化疗前均进行预治疗,预防肿瘤溶解综合征。参考文献[3]对方案的命名方式,根据危险度进行分层治疗(表1):低危组接受V-AA-BB-AA-BB方案化疗共4个疗程;中危组接受V-AA-BB-AA-BB-AA-BB方案化疗共6个疗程;高危组患者接受V-AA-BB-CC-AA-BB-CC方案化疗共6个疗程,每个疗程间隔21 d。所有患者均建议采用利妥昔单抗联合治疗(除非家中经济极差),利妥昔单抗于首次化疗结束后,于疗程开始前静脉输注,每疗程375 mg/m2,共6~8个疗程。化疗方案结束后第3天开始根据血常规情况皮下注射粒细胞集落刺激因子(G-CSF)维持中性粒细胞水平。本研究的改良NHL-BFM-90方案与标准NHL-BFM-90文献[3]不同之处:原方案中大剂量(HD)甲氨蝶呤(MTX)5 g/m2,本研究降至4 g/m2;原方案中甲酰四氢叶酸(CF)解救开始于MTX治疗后42 h,本研究提前至36 h,以降低MTX治疗的肝肾损害和黏膜炎等的相关毒性,增加患者治疗耐受性。鞘内注射药物组成及剂量:3~10岁:MTX 12 mg、阿糖胞苷(Ara-C)20 mg、地塞米松(DEX)4 mg;>10岁:MTX 15 mg、Ara-C 30 mg、DEX 5 mg。鞘内注射的频率按表1进行。
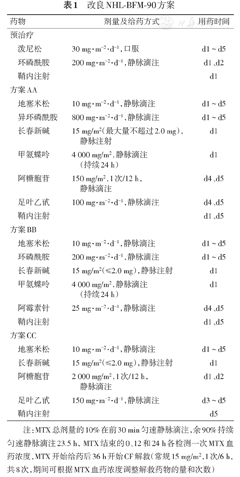
改良NHL-BFM-90方案
改良NHL-BFM-90方案
| 药物 | 剂量及给药方式 | 用药时间 | |
|---|---|---|---|
| 预治疗 | |||
| 泼尼松 | 30 mg·m-2·d-1,口服 | d1~d5 | |
| 环磷酰胺 | 200 mg·m-2·d-1,静脉滴注 | d1、d2 | |
| 鞘内注射 | d1 | ||
| 方案AA | |||
| 地塞米松 | 10 mg·m-2·d-1,静脉滴注 | d1~d5 | |
| 异环磷酰胺 | 800 mg·m-2·d-1,静脉滴注 | d1~d5 | |
| 长春新碱 | 15 mg/m2(最大量不超过2.0 mg),静脉注射 | d1 | |
| 甲氨蝶呤 | 4 000 mg/m2,静脉滴注(持续24 h) | d1 | |
| 阿糖胞苷 | 150 mg/m2,1次/12 h,静脉滴注 | d4、d5 | |
| 足叶乙甙 | 100 mg·m-2·d-1,静脉滴注 | d4、d5 | |
| 鞘内注射 | d1、d5 | ||
| 方案BB | |||
| 地塞米松 | 10 mg·m-2·d-1,静脉滴注 | d1~d5 | |
| 环磷酰胺 | 200 mg·m-2·d-1,静脉滴注 | d1~d5 | |
| 长春新碱 | 15 mg/m2(≤2.0 mg),静脉注射 | d1 | |
| 甲氨蝶呤 | 4 000 mg/m2,静脉滴注(持续24 h) | d1 | |
| 阿霉素针 | 25 mg·m-2·d-1,静脉滴注 | d4、d5 | |
| 鞘内注射 | d1、d5 | ||
| 方案CC | |||
| 地塞米松 | 10 mg·m-2·d-1,静脉滴注 | d1~d5 | |
| 长春新碱 | 15 mg/m2(≤2.0 mg),静脉注射 | d1 | |
| 阿糖胞苷 | 2 000 mg/m2,1次/12 h,静脉滴注 | d1、d2 | |
| 足叶乙甙 | 150 mg·m-2·d-1,静脉滴注 | d3~d5 | |
| 鞘内注射 | d5 | ||
注:MTX总剂量的10%在前30 min匀速静脉滴注,余90%持续匀速静脉滴注23.5 h,MTX结束的0、12和24 h各检测一次MTX血药浓度,MTX开始给药后36 h开始CF解救(常规15 mg/m2,1次/6 h,共8次,期间可根据MTX血药浓度调整解救药物的量和次数)
按国际淋巴瘤疗效评价标准进行,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。总生存(OS)期定义为从治疗开始至任何原因导致的死亡或随访终点的间隔时间。无进展生存(PFS)期定义为从治疗起至首次发现疾病进展、患者死亡或随访终点的间隔时间。按美国国立癌症研究所(NCI)标准进行不良反应评价。
停止治疗后第1年每3个月随访一次,第2年每6个月随访一次,第3年及以后每年随访一次。随访时行瘤灶影像学检测(包括B超、CT或PET-CT)、肝功能及LDH检测,发病初有骨髓侵犯的行骨髓细胞形态学检测,随访截止日期为2018年6月30日。失访患者生存期计算至末次随访日。
采用Mac的GraphPad Prism (6.00版)软件进行数据分析及制图。年龄和各项临床检测指标采用中位数(范围)表示,不同分类的病例数采用例数(百分率)表示。用Kaplan-Meier法计算生存率并绘制生存曲线。并用Log-rank检验进行统计学分析,P<0.05为差异有统计学意义。
67例患者中,男58例(86.57%),女9例(13.43%),中位年龄8(3~18)岁;≤14岁59例(88.06%),>14岁8例(11.94%)。53例(79.10%)采用PET-CT进行分期和疗效评估。Ⅰ、Ⅱ、Ⅲ和Ⅳ期分别为4例(5.97%)、9例(13.43%)、38例(56.72%)和16例(23.88%);低危组15例(22.39%),中危组30例(44.78%),高危组22例(32.84%):肠道侵犯40例(59.70%),其中以肠梗阻为首发症状的25例(37.31%);骨髓侵犯18例(26.87%),骨侵犯8例(11.94%),中枢神经系统侵犯2例(2.99%),其他侵犯部位包括浅表淋巴结、肾脏、胰腺、齿龈、鼻咽、扁桃体、纵隔等;中位血清LDH水平为326(113~2 007)U/L。67例患者HIV检测均为阴性。41例患者进行EBV相关检查,其中EBER阳性患者3例,1例血清EBV阳性。67例患者均接受改良NHL-BFM-90方案化疗(表1),55例(82.09%)联合利妥昔单抗(美罗华)治疗,其中Ⅲ/Ⅳ期患者37例(67.27%),低危11例(20%),中危26例(47.27%),高危18例(32.73%)。67例患者具体临床症状及体征见表2。

67例儿童及青少年伯基特淋巴瘤患者的临床特征[例(%)]
67例儿童及青少年伯基特淋巴瘤患者的临床特征[例(%)]
| 项目 | 结果 | |
|---|---|---|
| 年龄(岁) | ||
| ≤14 | 59(88.06) | |
| >14 | 8(11.94) | |
| 性别 | ||
| 男 | 58(86.57) | |
| 女 | 9(13.43) | |
| 分期 | ||
| Ⅰ期 | 4(5.97) | |
| Ⅱ期 | 9(13.43) | |
| Ⅲ期 | 8(56.72) | |
| Ⅳ期 | 16(23.88) | |
| 危险分层 | ||
| 低危 | 15(22.39) | |
| 中危 | 30(44.78) | |
| 高危 | 22(32.84) | |
| 治 | 疗方案 | |
| 联合利妥昔单抗 | 55(82.09) | |
| 单纯化疗 | 12(17.91) | |
| 疗效 | ||
| CR | 64(95.52) | |
| PR | 3(4.48) | |
| 肠道侵犯 | ||
| 是 | 40(59.70) | |
| 否 | 27(40.30) | |
| 骨髓侵犯 | ||
| 是 | 18(26.87) | |
| 否 | 49(73.13) | |
| 中枢神经系统侵犯 | ||
| 是 | 2(2.99) | |
| 否 | 65(97.02) | |
注:CR:完全缓解;PR:部分缓解
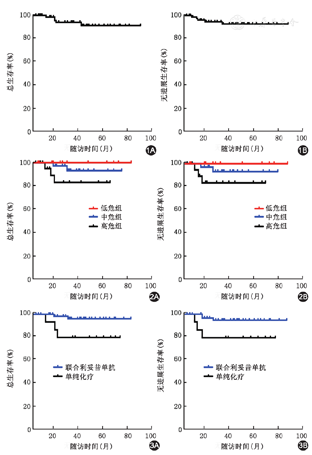
化疗2~3个周期后,64例(95.52%)获CR,3例(4.48%)PR,总有效率(CR+PR)100%。1例脑膜侵犯的患者6周期化疗后行自体造血干细胞移植。67例儿童或青少年BL患者中位随访时间44(3~89)个月,3年和5年OS率分别为92.54%和88.98%,3年和5年PFS率均为90.34%(图1)。儿童患者(≤14岁)优于青少年(>14岁)(5年OS为95.1%对82.3%,P=0.039;5年PFS为94.6%对82.5%,P=0.031)。低、中和高危BL患者5年OS(分别为100%、91.7%和80.0%)(P=0.048),5年PFS(分别为100%、91.5%和81.1%)(P=0.061)(图2)。与单纯化疗组的5年OS和PFS分别为74.3%和78.6%相比,利妥昔单抗联合化疗组BL患者的5年OS和PFS分别为95.2%和95.5%,显示出明显的生存优势(P值分别为0.021和0.036)(图3)。67例患者中,4例(5.9%)患者死亡,死亡原因分别为疾病进展或复发,其中3例未采用利妥昔单抗治疗。1例发病初为Ⅱ期,化疗2周期后达PR,6周期后出现疾病进展,行残留病灶放疗并联合化疗,过程中出现多脏器功能衰竭死亡;1例发病初肠梗阻,腹腔广泛侵犯,因家中经济极差,采用单纯化疗,3周期达PR,1年后疾病复发,放弃治疗死亡;1例为17岁男性,发病初为Ⅳ期(侵犯骨髓和中枢神经系统),利妥昔单抗联合化疗,2周期后达PR,后病情快速进展,全身广泛侵犯,放弃治疗死亡;另1例患儿发病初为Ⅳ期(侵犯骨髓),化疗2周期达CR,化疗过程中均重度骨髓抑制,经剂量调整后完成6周期化疗,半年后骨髓形态学检测为急性髓系白血病(M5型),行IA(去甲氧柔红霉素+阿糖胞苷)方案诱导化疗达CR;MA(米托蒽醌+阿糖胞苷)和HA(高三尖杉酯碱+阿糖胞苷)方案巩固化疗2周期,后因重度肠道感染死亡。

100%患者发生骨髓抑制,其中CC方案Ⅳ度骨髓抑制的发生率为100%,经G-CSF及积极对症支持治疗后恢复,发生肺部和腹腔重度感染4例(5.9%)。黏膜炎及肝肾损伤主要发生在AA和BB方案中,Ⅲ/Ⅳ级黏膜炎16例(23.88%),经四氢叶酸钙解救及对症处理均恢复,10例(14.93%)出现不同程度肝损伤,2例(2.98%)患者发生重度肝损伤;1例(1.49%)发生重度肾功能不全,血液透析治疗后恢复;未发生肿瘤溶解及治疗相关的死亡。
BL临床表现为起病急、疾病进展快和对化疗敏感。预后不良因素包括:年龄、LDH水平≥正常上限2倍、骨髓和中枢神经系统侵犯、早期治疗反应差、高危细胞遗传学等。欧美国家剂量密集的脉冲式多药联合强化疗方案,极大改善了患者的疗效和预后[1,2,3],但治疗相关的致命性毒性不可忽视。患者年龄与预后密切相关,儿童和青少年BL患者的远期生存率优于年轻成人,老年患者的预后最差[2,8,9]。导致成年患者生存率低的原因可能主要与治疗相关毒性增加导致化疗强度下降有关。近期一项研究采用低剂量化疗方案联合利妥昔单抗(EPOCH-R方案)治疗成人BL与高强度化疗取得类似疗效[10]。表明即使在化疗剂量减低的情况下,联合利妥昔单抗治疗可进一步改善成年BL的预后[4,5,10,11,12]。这也为改善儿童及青少年BL的疗效提供研究方向。
多项研究表明克服高强度化疗方案的致命性毒性从而完成整体治疗规划,对改善BL患者的长期生存至关重要。为了增加患者对强化疗方案的耐受性,中山大学肿瘤防治中心采用改良NHL-BFM-90方案治疗儿童及青少年BL和DLBCL,5年OS率为85.8%[13],这对于经济相对落后国家的BL患者已经是不错的治疗选择。由于儿童BL细胞均高表达CD20抗原(表达率为100%),近年来,国外研究报道利妥昔单抗联合强化疗可使儿童高危BL患者生存获益,3年OS达93%[14]。由于发病率低和经济因素,目前国内靶向免疫化疗治疗BL的长期疗效的临床数据仍较少。本研究采用改良BFM-90方案±利妥昔单抗治疗儿童及青少年BL的8年随访结果表明,总有效率100%,CR率95.52%,3年和5年OS率分别为92.54%和88.98%,3年和5年PFS率均为90.34%,并且还发现儿童患者的5年OS为95.1%,明显优于青少年(5年OS 81.3%)。同时,本研究尽管降低了MTX的量,但远期疗效与欧美国家文献报道相似[9,14],表明该方案适合于国人BL患者。更重要的是,本研究82.09%的BL患者在改良BFM-90方案的第一个疗程后联合利妥昔单抗的靶向免疫化疗,患者5年OS和PFS分别为92.9%和93.3%,明显高于本研究单纯化疗组和文献报道的单纯化疗组患者[2,3,9,13],单纯强化疗对于儿童和青少年BL患者已经取得较好疗效,联合利妥昔单抗显示出更佳的生存优势,表明靶向免疫化疗值得进一步普及和推广。
欧美国家的化疗方案情调根据危险因素(如分期和早期疗效评估等)进行分层治疗,以进一步提高高危患者的疗效。因此,精准的检测技术对BL准确的分期和疗效评估至关重要[7,15]。本研究79.10%的患者采用PET-CT进行治疗前分期和2~3周期后的疗效评估,精准分层使得低危组、中危组和高危组患者分别采用不同强度化疗方案以提高疗效,并降低不必要的治疗相关毒性,5年OS分别为100%、91.7%和80.0%,低危组患者显示出明显的生存优势。不可否认这样高强度的化疗,急性毒副反应的处理需要良好的支持治疗和医生丰富的临床经验。我们通过将原方案的HD-MTX适当减量,并检测MTX的血药浓度,在MTX结束后12 h开始CF解救,Ⅲ/Ⅳ级黏膜炎的发生率低于文献报道[3,14]。增加利妥昔单抗后,感染等不良反应的发生率并没有增加,与文献报道相一致[5,10,12]。表明适当减低MTX剂量的靶向免疫化疗并没有影响疗效,而化疗耐受性更佳。另外,肿瘤溶解综合征最常发生于BL患者,特别是伴有巨大腹部肿块及双肾侵犯,原因主要是BL细胞倍增时间短、增殖迅速、自发崩解及对细胞毒药物极其敏感。因此,本研究对所有患者在治疗早期均进行预治疗,治疗前及治疗期间充分水化、碱化、别嘌呤醇和利尿等措施,无一例患者发生肿瘤溶解综合征,也无治疗相关死亡。
总之,本研究采用改良NHL-BFM-90方案±利妥昔单抗治疗儿童及青少年BL疗效满意,8年随访结果显示联合利妥昔单抗的靶向免疫化疗显示出更好地长期生存获益。更多的靶向联合化疗,如MYC抑制剂、PI3K抑制剂等的新疗法可能是将来进一步改善BL预后的治疗趋势。
所有作者均声明不存在利益冲突



























