
探讨多模态影像融合技术在肝内胆管癌(ICC)诊断与治疗中的应用价值。
采用回顾性描述性研究方法。收集2018年1—9月南方医科大学珠江医院收治的11例ICC患者的临床病理资料;男5例,女6例;年龄为(55±12)岁,年龄范围为30~74岁。收集患者上腹部增强CT检查和钆塞酸二钠(Gd-EOB-DTPA)增强MRI检查数据,构建基于CT-MRI融合图像的肝脏3D模型。根据不同模态影像学检查技术制订术前规划。吲哚菁绿(ICG)分子荧光成像技术和增强现实手术导航系统分别运用于肝切除术中。观察指标:(1)术前评估。(2)术中情况。(3)不同模态影像学技术制订手术规划方案与实际手术方式的比较。(4)随访情况。采用门诊或电话方式进行术后随访,随访患者术后并发症发生情况。随访时间截至2018年11月。正态分布的计量资料以Mean±SD表示,偏态分布的计量资料以M(范围)表示。计数资料以绝对数或百分比表示,比较采用配对χ2检验。
(1)术前评估:增强CT检查清晰显示门静脉、肝静脉系统三级及以上分支血管比例,肿瘤边界比例分别为11/11和4/11,MRI检查分别为5/11和11/11,两种检查上述指标比较,差异均有统计学意义(χ2=4.16,5.14,P<0.05)。增强CT检查显示肝脏病灶11个,增强MRI检查显示病灶13个(含增强CT检查未显示的2个病灶,最大直径≤10 mm)。基于CT-MRI融合图像的肝脏3D模型:均能立体、直观、全面显示肝脏病灶位置、数目、浸润范围(肿瘤边界),肝内血管走行、变异情况以及与病灶的空间关系。(2)术中情况:11例患者中,术中肉眼探查发现11个病灶;通过ICG分子荧光影像技术检查出13个病灶,包含2个术前MRI检查肝胆特异期提示的低摄取病灶,病理学检查为肝内转移癌。11例患者中,结扎肝门相应血管出现肉眼可见明显缺血分界线6例;使用ICG分子荧光影像技术检查显示10例行解剖性肝切除术患者的肝段或半肝边界,其中正染法2例、反染法8例。11例患者中,行左半肝切除术3例(1例联合肝Ⅷ段转移灶局部切除术),左肝外叶切除术2例,右半肝切除术2例,扩大右半肝切除术、右肝后叶切除术、部分肝Ⅷ段切除术、肝中叶切除术各1例。11例患者中,7例联合区域淋巴结清扫,4例行单纯淋巴结活组织检查。11例患者中,1例术中诊断为肝脏断面胆汁漏,予以4-0 Prolene线缝扎处理;10例未发生术中胆汁漏。11例患者手术切缘均为阴性,手术时间为(240±118)min,术中出血量为(275±249)mL,住院时间为(13±8)d,围术期均未输血治疗。(3)不同模态影像学技术制订手术规划方案与实际手术方式的比较:CT、MRI检查和基于CT-MRI融合图像的肝脏3D模型手术规划方案与实际手术方式一致分别为6、9、11例。(4)随访情况:11例患者术后均获得随访,随访时间为2~10个月,中位随访时间为6个月。3例患者发生术后并发症,Clavien-Dindo Ⅰ、Ⅱ级并发症2例,其中胸腔积液1例,胸腔积液+腹腔积液1例,均经保守治疗后好转;Clavien-Dindo Ⅲ级并发症1例(术后腹腔出血),行经皮股动脉穿刺选择性动脉栓塞术治疗后好转。11例患者均未发生术后胆汁漏、肝衰竭和死亡。
多模态影像融合技术可优化术前手术规范方案,术中能实时辅助识别肝脏重要血管并为肝切除术实时导航,提高手术安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝内胆管癌(intrahepatic Cholangiocarcinoma,ICC)发病率占肝脏恶性肿瘤的第2位,仅次于肝细胞癌,肝切除术是首选治疗方式[1]。ICC具有浸润性生长,易发生卫星灶和肝内转移的特性[2]。术前和术中检出肝脏全部病灶并准确判断肿瘤边界,充分了解肿瘤和肝脏血管的空间解剖关系,达到R0切除,能提高ICC患者的远期生存率[3]。虽然近年来医学影像技术不断发展,但是目前单一模态的影像学技术均存在局限性:增强CT检查对直径≤10 mm的微小病灶诊断率低,当肿瘤分化程度低时难以清楚显示肿瘤边界;增强MRI检查扫描时间长,呼吸运动伪影可能导致肝内血管显示不清晰;术中缺乏对微小病灶的识别并实时指导肝切除的影像检查方法。因此,无法在术前和术中完全实现对ICC的精确诊断与治疗,为R0切除带来困难。多模态影像融合技术通过联合多种成像技术,融合不同模态图像信息,从而实现影像信息的互补、丰富与完善,为外科医师提供更为全面的辅助信息,可实现疾病的精确诊断与治疗。本研究回顾性分析2018年1—9月南方医科大学珠江医院收治的11例ICC患者的临床病理资料,旨在探讨多模态影像融合技术在ICC诊断与治疗中的应用价值。
采用回顾性描述性研究方法。收集11例ICC患者的临床病理资料,男5例,女6例;年龄为(55±12)岁,年龄范围为30~74岁。本研究通过我院医学伦理委员会审批,批号为2018-GDYK-001、2018-GDYK-003。患者及家属均签署检查和手术知情同意书。
纳入标准:(1)术后病理学检查结果示ICC。(2)术前未发现肿瘤远处转移。(3)肝功能Child-Pugh分级为A、B级。(4)虚拟手术肝切除,剩余肝脏体积>30%,如有肝硬化等基础肝脏疾病患者剩余肝脏体积>40%[4]。
排除标准:(1)术前接受放化疗。(2)ICC手术治疗后肝内肿瘤复发需再手术治疗。
采用256层螺旋CT(购自荷兰Philips Brilliance公司)扫描,收集平扫期、动脉期、门静脉期和肝静脉期薄层CT检查图像数据[5]。
注射对比剂Gd-EOB-DTPA后采用3.0T TX扫描仪(购自荷兰Philips Achieva公司) 扫描,收集平扫期、动脉期、门静脉期和肝胆特异性期MRI检查图像数据[6]。
将收集的CT、MRI检查数据导入腹部医学三维可视化图像系统(笔者团队自主研发的MI-3DVS软件)。使用CT检查数据构建肝脏、肿瘤及肝脏血管(肝动脉、门静脉、肝静脉)3D模型。使用MRI检查数据构建肝脏、肿瘤及门静脉的3D模型。使用以门静脉为约束的算法将CT和MRI检查数据构建的3D模型进行配准、融合,构建基于CT-MRI融合图像的个体化肝脏3D模型[5]。
通过增强CT、增强MRI检查图像数据分辨肿瘤在肝内的空间位置以及与肝内血管的解剖关系,根据肿瘤所在肝段位置,分别制订手术方案。使用MI-3DVS软件,根据个体化肝脏3D模型进行个体化肝分段、虚拟肝切除,计算功能肝脏体积、肝肿瘤体积、剩余肝脏体积,制订手术方案[7]。
术前24 h使用灭菌注射用水将ICG充分溶解,标准浓度为2.5 g/L,以0.05~0.10 mg/kg剂量经外周静脉注射。术中使用PINPOINT分子影像学手术系统(购自加拿大NOVADAQ公司)检查肝脏表面异常荧光聚集区,并确定肿瘤边界,使用正染法或反染法指导解剖性肝切除[8]。最后观察肝断面是否存在胆汁漏。
将CT-MRI融合图像的个体化3D模型数据导入增强现实手术导航系统(笔者团队与中国科学院深圳先进技术研究院合作研发),使用该系统将术前个体化肝脏3D模型与术中肝脏及血管进行实时融合显示,导航肝脏重要血管的解剖和肝切除。
腹腔镜或开腹探查腹腔无肿瘤远处转移后,游离肝脏,使用PINPOINT分子影像手术系统扫描肝脏及周围脏器。检查肝脏表面是否存在异常荧光聚集区,验证增强MRI检查发现的肝内小病灶,并确定肝脏肿瘤位置和边界。在局部肝切除中沿ICG分子荧光边界1~2 cm处切除肿瘤;在解剖性肝切除中根据肿瘤位置对目标切除肝脏的肝蒂进行解剖分离,使用ICG正染法或反染法显示肝段或半肝荧光分界线,标定肝脏预切线。使用增强现实手术导航系统将患者肝脏3D模型与术中真实肝脏进行配准、融合,实时辅助肝脏血管的辨识和解剖。手术结束前,再次使用ICG分子荧光影像系统检查肝断面,根据荧光聚集灶和纱布擦拭结果判断是否存在胆汁漏。术中超声检查肝脏深部病灶。手术切除标本均送病理学检查。
观察指标:(1)术前评估增强CT、MRI检查和基于CT-MRI融合图像的肝脏3D模型对肝脏脉管系统、肿瘤边界、肿瘤数目的显示情况。(2)术中情况:术中ICG分子荧光影像技术检查对肿瘤数目、肝段或半肝分界的显示情况,手术方式,淋巴结清扫情况,术中胆汁漏情况,手术切缘、手术时间、术中出血量、住院时间、围术期输血治疗情况。(3)不同模态影像学技术制订手术规划方案与实际手术方式的比较:CT、MRI检查和基于CT-MRI融合图像的肝脏3D模型手术规划方案与实际手术方式的比较。(4)随访情况:获得随访的患者例数、随访时间、随访期间术后并发症情况。
评价标准:并发症采用Clavien-Dindo并发症分级系统评估术后并发症发生情况[9]。采用"50-50标准"判断术后肝衰竭情况[10]。
采用门诊或电话方式进行术后随访,随访患者术后并发症发生情况。随访时间截至2018年11月。
应用SPSS 25.0统计软件进行分析。正态分布的计量资料以Mean±SD表示,偏态分布的计量资料以M(范围)表示。计数资料以绝对数或百分比表示,比较采用配对χ2检验。P<0.05为差异有统计学意义。
增强CT检查清晰显示门静脉、肝静脉系统三级及以上分支血管比例,肿瘤边界比例分别为11/11和4/11,MRI检查分别为5/11和11/11,两种检查上述指标比较,差异均有统计学意义(χ2=4.16,5.14,P<0.05)。增强CT检查显示肝脏病灶11个,增强MRI检查显示病灶13个(含增强CT检查未显示的2个病灶,最大直径≤10 mm)。见图1。
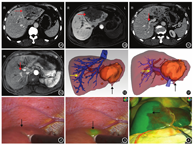

基于CT-MRI融合图像的肝脏3D模型:均能立体、直观、全面显示肝脏病灶位置、数目、浸润范围(肿瘤边界),肝内血管走行、变异情况以及与病灶的空间关系。见图1。
11例患者中,术中肉眼探查发现11个病灶(图2);通过ICG分子荧光影像技术检查出13个病灶(图3),包含2个术前MRI检查肝胆特异期提示的低摄取病灶,病理学检查为肝内转移癌。11例患者中,结扎肝门相应血管出现肉眼可见明显缺血分界线6例;使用ICG分子荧光影像技术检查显示10例行解剖性肝切除术患者的肝段或半肝边界,其中正染法2例、反染法8例(图4)。11例患者中,行左半肝切除术3例(1例联合肝Ⅷ段转移灶局部切除术),左肝外叶切除术2例,右半肝切除术2例,扩大右半肝切除术、右肝后叶切除术、部分肝Ⅷ段切除术、肝中叶切除术各1例。11例患者中,7例联合区域淋巴结清扫,4例行单纯淋巴结活组织检查。11例患者中,1例术中ICG分子荧光影像技术检查联合纱布擦拭诊断为肝脏断面胆汁漏,予以4-0 Prolene线缝扎处理;10例未发生术中胆汁漏。11例患者手术切缘均为阴性,手术时间为(240±118)min,术中出血量为(275±249)mL,住院时间为(13±8)d,围术期均未输血治疗。
CT、MRI检查和基于CT-MRI融合图像的肝脏3D模型手术规划方案与实际手术方式一致,分别为6、9、11例。见表1。

不同模态影像学技术制订手术规划方案与实际手术方式的比较
不同模态影像学技术制订手术规划方案与实际手术方式的比较
| 病例 | 性别 | 年龄(岁) | CT检查制订的手术规划方案 | MRI检查制订的手术规划方案 | 基于CT-MRI融合图像的3D肝脏模型制订的手术规划方案 | 实际手术方式 | 原因 |
|---|---|---|---|---|---|---|---|
| 1 | 女 | 41 | 右半肝切除术 | 右半肝切除术 | 右肝后叶切除术 | 右肝后叶切除术 | 行右半肝切除术虚拟剩余肝脏体积≤40%(患者合并肝硬化) |
| 2 | 男 | 69 | 右三肝切除术 | 右三肝切除术 | 扩大右半肝切除术 | 扩大右半肝切除术 | 行右三肝切除术虚拟剩余肝脏体积≤30% |
| 3 | 男 | 57 | 左肝外叶切除术 | 左肝外叶切除术 | 左肝外叶切除术 | 左肝外叶切除术 | |
| 4 | 男 | 74 | 左肝外叶切除术 | 左肝外叶切除术 | 左肝外叶切除术 | 左肝外叶切除术 | |
| 5 | 女 | 61 | 部分肝Ⅷ段切除术 | 部分肝Ⅷ段切除术 | 部分肝Ⅷ段切除术 | 部分肝Ⅷ段切除术 | |
| 6 | 女 | 57 | 左肝外叶切除术 | 左半肝切除术 | 左半肝切除术 | 左半肝切除术 | 增强MRI检查提示肿瘤边界越过肝矢状部,术中改行左半肝切除术 |
| 7 | 女 | 53 | 右半肝切除术 | 右半肝切除术 | 右半肝切除术 | 右半肝切除术 | |
| 8 | 男 | 55 | 右半肝切除术 | 右半肝切除术 | 右半肝切除术 | 右半肝切除术 | |
| 9 | 女 | 30 | 左半肝切除术 | 左半肝+肝Ⅷ段病灶切除术 | 左半肝+肝Ⅷ段病灶切除术 | 左半肝+肝Ⅷ段病灶切除术 | 术中吲哚菁绿和病理学检查证实肝Ⅷ段转移癌 |
| 10 | 女 | 55 | 左半肝切除术(包括肝尾状叶) | 左半肝切除术(包括肝尾状叶) | 左半肝切除术(包括肝尾状叶) | 左半肝切除术(包括肝尾状叶) | |
| 11 | 男 | 57 | 肝Ⅷ段局部切除术 | 肝中叶(肝Ⅳ、Ⅴ、Ⅷ段)切除术 | 肝中叶(肝Ⅳ、Ⅴ、Ⅷ段)切除术 | 肝中叶(肝Ⅳ、Ⅴ、Ⅷ段)切除术 | 术中吲哚菁绿和病理学检查证实肝Ⅳ段转移癌 |
11例患者术后均获得随访,随访时间为2~10个月,中位随访时间为6个月。3例患者发生术后并发症,Clavien-Dindo Ⅰ、Ⅱ级并发症2例,其中胸腔积液1例,胸腔积液+腹腔积液1例,均经保守治疗后好转;Clavien-Dindo Ⅲ级并发症1例(术后腹腔出血),行经皮股动脉穿刺选择性动脉栓塞术治疗后好转。11例患者均未发生术后胆汁漏、肝衰竭和死亡。
肝切除术是ICC目前唯一可能获得远期生存的有效治疗方式,肝内病灶完全切除是保证手术质量的关键因素[11]。ICC病灶常呈多灶性及肝内浸润的特点。术前应充分了解肝脏病灶位置、数目、浸润范围(肿瘤边界)、肝内脉管系统的分布、走行、变异及其与病灶的毗邻关系。术前应针对病灶的可切除性及切除范围进行精准评估和可靠预测。CT、MRI是ICC的常规检查方法。CT血管成像技术能够清晰提供肝脏血管信息,肝内门静脉和肝静脉可精细显示至4~5级分支。但CT检查对直径≤1.0 cm的肝内微小癌灶诊断率不高,且当肿瘤分化程度低、包膜不完整时,难以实现对肿瘤边界的准确显示。肝脏特异性造影剂Gd-EOB-DTPA增强MRI扫描检查具有清晰地显示肿瘤边界以及检测肝内微小病灶的优势[12]。但因MRI成像时间长,患者易因呼吸不配合出现伪影而影响肝内血管显示质量。
CT、MRI成像存在时间顺序和空间位置上的差异,医师如果仅凭主观经验对CT-MRI图像进行信息融合和三维认识,由于经验的局限性和不确定性,难以达到肝脏、肿瘤及肝内脉管信息的精确融合,可能导致术前规划出现误差。笔者团队在前期肝脏三维可视化研究基础上,将ICC患者术前CT血管成像信息和MRI肝脏肿瘤信息进行分割、配准、融合,构建CT-MRI融合图像的3D肝脏模型。该 3D模型实现了CT和MRI图像在时间和空间上的统一,不仅能够更全面、精确地显示肝脏ICC病灶的边界、肝内微小病灶情况以及与肝内重要血管的空间位置关系;还可以通过个体化肝脏分段和切除体积预测进行三维动态分析,反复模拟、演练肝切除路径,为准确的术前评估和制订最佳的手术方案提供重要支持[13]。本研究中5例患者在基于CT-MRI融合成像肝脏3D模型评估后改变了CT或MRI检查单一模态二维评估拟订的手术方案,2 例因为剩余肝脏体积不足而缩小了肝切除范围,2例因3D模型提示肝内微小转移灶,为了达到全部病灶切除而扩大了肝切除范围,1例因增强MRI检查和3D模型提示肿瘤边界越过肝矢状部而增加了肝切除范围。
除了精确的术前规划,术中对主要病灶和微小病灶进行准确的识别定位,决定肝脏切除的范围也是ICC彻底清除的关键[14]。ICG分子荧光影像技术是近年来在肝癌外科广泛应用的术中成像方法,运用ICG在肝癌组织中靶向性滞留聚集和经胆道排泄的特点,其在肝内外胆管癌术中可应用于以下4方面:(1)对微小病灶的识别与定位。部分ICC肝内表浅微小转移病灶因未突破肝脏包膜,肉眼观察和正常肝脏组织无明显区别。腹腔镜术中触觉的丧失和术中超声检查微小病灶对于经验的依赖性,导致医师术中精确定位和识别微小病灶存在困难。ICG分子荧光影像技术可检查出最小直径为2 mm 的肝癌病灶[15]。本研究11例患者中,2例术前MRI检查肝胆特异期发现肝脏包膜下低摄取转移癌灶,直径均≤8mm,术中使用ICG分子荧光影像技术可快速识别、定位。由于ICG发出的荧光信号仅能穿透10 mm以内的肝实质,检查肝内深部病灶呈低灵敏度[15]。同时ICG对癌组织判别也存在一定的假阳性率,需要结合术中超声和病理学检查进一步判定[16]。(2)精确判定ICC肿瘤边界及肝切除范围是手术中的关键步骤。本研究中2例患者行肿瘤局部肝切除术时,先运用ICC荧光聚集显影划定肿瘤边界,并在距离肿瘤>1 cm行肝切除范围的界定。肝切除过程中再通过荧光扫描实时确认切缘情况,结合术中冷冻切片病理学检查,保证肝切缘阴性。(3)引导解剖性肝切除。已有的研究结果表明:ICG需行肿瘤所在肝脏至少两个相邻肝段的解剖性肝切除术,其手术安全性才较好,才能改善患者预后[17,18]。ICG荧光成像技术可用于引导肝段为基础的肝切除术,术中通过正染法和反染法注入ICG,可获得肝表面和肝实质内确切持久的荧光染色,实现肝脏表面强烈的可视化分段效果以及肝脏实质的三维染色。使外科医师能够对肝实质内部立体染色区域能更快速直接的理解,引导术中实时、三维、精准的解剖性肝切除术[19]。本研究中4例患者结扎目标切除肝脏肝蒂后,肝脏缺血分界线不能清晰辨识,可与肝脏表面粘连和肝硬化因素相关,使用ICG分子荧光成像技术检查可清晰显示肝脏拟切面分界线,能指导解剖性肝切除术的顺利施行。(4)检查术后胆汁漏。肝切除术后胆汁漏是患者术后腹腔感染、肝衰竭甚至围术期死亡等不良预后的主要危险因素之一,术中发现并及时修补是降低术后胆汁漏风险的关键[20]。术中经胆囊管注射ICG并临时阻断胆总管可检查胆汁漏情况。术中采用ICG分子荧光影像技术扫描肝脏断面,根据荧光聚集也可判断胆汁漏发生情况。
术中出血是影响肝切除术成功和术后患者恢复的重要因素[21]。虽然个体化的肝脏3D模型可以帮助医师在术前充分了解肝内血管走行、变异以及与肿瘤的相互关系;但术前影像资料与实际手术解剖结构存在时间和空间上的分离,仍需医师在术中根据主观判断进行重要血管辨别、解剖。这增加了不确定性和术中出血的风险。基于增强现实的手术导航系统可将患者术前肝脏三维图像投射至术中真实肝脏上,进行同步叠加、融合显示,引导肝切除术[22,23]。笔者团队将该技术应用与ICC肝切除术中,其研究结果显示:肝门部血管解剖时间明显缩短,可在肝切除术中预判重要血管,可减少术中意外损伤出血。但目前肝脏手术导航系统仍然存在肝脏软组织形变、影像资料和实际解剖结构实时匹配校正等科学问题,需要医工交叉进一步研究、完善。
综上,多模态影像融合技术作为重要的辅助手段,能提高ICC的诊断水平,制订合理准确的手术方案,指导精准肝切除术的施行。随着医学和人工智能的融合、发展,图像处理、手术导航等关键科学问题逐渐攻克和临床实践应用的不断深入,多模态影像融合技术在肝癌外科诊断与治疗中将有更加广阔的应用前景。
所有作者均声明不存在利益冲突



























