
总结PICU侵袭性真菌感染(invasive fungal infection,IFI)的临床特点,并分析其危险因素。
回顾性分析2013年1月至2017年12月在我院PICU住院的IFI患儿的临床资料。
标本真菌培养阳性患儿179例,其中IFI患儿49例。男23例,女26例,平均年龄(3.87±2.42)岁。47例患儿存在基础疾病。阳性标本中肺泡灌洗液/痰培养36例,血培养14例,尿培养7例,胸/腹水培养3例,骨髓培养2例,脑脊液培养1例。12例患儿同时存在2个及以上部位感染。共培养出53株真菌:念珠菌45株,曲霉菌5株,马尔尼菲青霉菌3株。4例患儿存在两种真菌感染。存在基础疾病、输血、使用抗生素/糖皮质激素/免疫抑制剂、侵袭性操作、住院时间长是IFI的危险因素(均P<0.05)。药敏分析结果显示,除产朊假丝酵母菌、酿酒酵母菌、葡萄牙假丝酵母菌各1例对伊曲康唑不敏感外,其他菌株对两性霉素B/脂质体、三唑类、棘白菌素类抗真菌药物均敏感。23例患儿联合使用2种抗真菌药物。所有患儿均伴有发热,11例发生多器官功能障碍综合征,6例死亡。
儿童IFI患者临床表现缺乏特异性,病情重,病死率高。念珠菌是最常见的病原菌,肺是最常见的感染部位。对于存在IFI危险因素如基础疾病、输血、使用抗生素/糖皮质激素/免疫抑制剂、侵袭性操作、住院时间长的患儿,应结合实验室检查鉴别诊断,及早诊断并经验性合理使用抗真菌药物。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
侵袭性真菌感染(invasive fungal infection,IFI)是PICU住院患儿常见的感染性疾病。随着广谱抗生素、皮质类固醇等药物的广泛应用以及侵入性操作的增加,IFI呈逐年增多态势[1]。IFI在临床上常继发于各类感染,早期诊断比较困难,延误抗真菌治疗会影响患儿预后,增加病死率。现回顾分析2013年1月至2017年12月在我院PICU住院的IFI患儿临床资料,总结其临床特点,希望能够对临床医生提供帮助。
2013年1月至2017年12月深圳市儿童医院PICU共收治住院患儿4 282例,其中179例患儿送检标本真菌培养结果阳性,符合IFI诊断标准[2,3,4]的确诊患儿共49例,其余考虑定植菌。男23例,女26例,平均年龄(3.87±2.42)岁,其中1个月~1岁17例,1~3岁9例,3~6岁8例,>6岁15例。住院时间最短1 d(死亡),最长129 d,平均住院时间(47.48±32.46)d。
采用回顾性研究方法,总结患儿的临床资料,包括年龄、性别、住院时间、合并感染、实验室检查、抗真菌药物的使用及预后等。所有培养标本首次送检均在抗真菌药物使用前留取,采集后半小时内送检微生物室,常规分离后采用法国生物梅里埃公司的微生物全自动鉴定系统进行菌种鉴定,药敏板条进行药敏试验。
采用SPSS 20.0统计软件,经方差齐性检验后,符合正态分布的计量资料采用均值±标准差(Mean±SD)表示,两组间比较采用t检验;计数资料采用例和率表示,两组间比较采用χ2检验;多因素分析采用Logistic回归分析,P<0.05为差异有统计学意义。
所有患儿均伴有发热,28例伴有呼吸困难,5例出现皮疹,2例血尿,1例腹胀。脓毒性休克18例,脑病4例,肝功能损害4例,肾衰竭3例,DIC 2例,11例患儿发生多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS),死亡6例,病死率12.24%。
院内获得性IFI 37例,社区获得性IFI 12例。47例患儿存在基础疾病,2例无基础疾病患儿均为社区获得性IFI。呼吸系统、血液系统是最常见的基础疾病。见表1。

侵袭性真菌感染患儿基础疾病情况(例)
侵袭性真菌感染患儿基础疾病情况(例)
| 疾病分类 | 社区获得性侵袭性真菌感染(n=12) | 院内获得性侵袭性真菌感染(n=37) |
|---|---|---|
| 呼吸系统 | 支气管肺发育不良(1) | 重症肺炎(5)支气管肺发育不良(2)闭塞性细支气管炎(1)肺结核(1) |
| 血液系统 | 噬血细胞综合征(2)再生障碍性贫血(1) | 噬血细胞综合征(3)急性淋巴细胞性白血病(1)异基因造血干细胞移植术后(1)再生障碍性贫血(1)A型血友病(1) |
| 神经系统 | 难治性癫痫(1)免疫性脑炎(1) | 颅内感染(4)癫痫(2) |
| 心血管系统 | 先天性心脏病(1) | 暴发性心肌炎(1) |
| 外伤 | - | 外伤术后(9)烫伤(1) |
| 免疫缺陷 | 卡介苗病(1)X连锁慢性肉芽肿病(1) | 系统性红斑狼疮(1) |
| 其他 | 粘脂质贮积症Ⅱ型(1) | 先天性肾病综合征(1)重症手足口病(1)21三体综合征(1) |
25例患儿在诊断前1个月内有输血史,输注成分悬浮红细胞22例,血小板19例,血浆17例,冷沉淀5例,其中输注两种以上成分者17例。
44例患儿在发病前1个月内使用过抗生素,第三代头孢菌素38例、碳青霉烯类29例、万古霉素22例。32例患儿发病前1个月内联合使用两种抗生素。抗生素平均使用天数为(16.45±13.83)d。发病前1个月内使用激素(或免疫抑制剂)者13例,4例使用激素(或免疫抑制剂)>30 d,平均使用时间(3.94±2.73)d。
39例患儿有侵袭性操作:留置气管导管32例,留置中心静脉置管22例,留置尿管20例,胃肠外营养16例,留置体腔外引流管(胸腔闭式引流管、腹腔引流管和脑室引流管等)9例。34例有两种以上侵袭性操作。
29例患儿在确诊IFI时同时合并其他病原菌感染,细菌26例,其中革兰阴性菌14例,革兰阳性菌12例;腺病毒2例,肺炎支原体1例。检测出病原菌的标本取材部位分别为:肺泡灌洗液/痰12例,胸腔积液/腹腔积液11例,血/骨髓培养4例,脑脊液2例。
共收集培养阳性病原53株。念珠菌45株,其中白色假丝酵母菌24株,近平滑假丝酵母菌13株,热带假丝酵母菌5株,葡萄牙假丝酵母菌1株,产朊假丝酵母菌1株,酿酒酵母菌1株;曲霉菌5株;马尔尼菲青霉菌3株。4例同时存在2株病原感染。每年的IFI以白色假丝酵母菌最多,其次是近平滑假丝酵母菌(表2)。
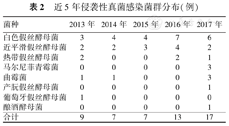
近5年侵袭性真菌感染菌群分布(例)
近5年侵袭性真菌感染菌群分布(例)
| 菌种 | 2013年 | 2014年 | 2015年 | 2016年 | 2017年 |
|---|---|---|---|---|---|
| 白色假丝酵母菌 | 3 | 4 | 4 | 7 | 6 |
| 近平滑假丝酵母菌 | 2 | 2 | 3 | 4 | 2 |
| 热带假丝酵母菌 | 2 | 0 | 0 | 2 | 1 |
| 马尔尼菲青霉菌 | 0 | 0 | 0 | 0 | 3 |
| 曲霉菌 | 1 | 1 | 0 | 0 | 3 |
| 产朊假丝酵母菌 | 0 | 0 | 0 | 0 | 1 |
| 葡萄牙假丝酵母菌 | 1 | 0 | 0 | 0 | 0 |
| 酿酒酵母菌 | 0 | 0 | 0 | 0 | 1 |
| 合计 | 9 | 7 | 7 | 13 | 17 |
肺泡灌洗液/痰培养阳性36例,血培养14例,尿培养7例,胸/腹水培养3例,骨髓培养2例,脑脊液培养1例。10例患儿感染累及两个部位,2例累及3个部位。见表3。
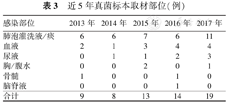
近5年真菌标本取材部位(例)
近5年真菌标本取材部位(例)
| 感染部位 | 2013年 | 2014年 | 2015年 | 2016年 | 2017年 |
|---|---|---|---|---|---|
| 肺泡灌洗液/痰 | 6 | 6 | 7 | 6 | 11 |
| 血液 | 2 | 1 | 3 | 4 | 4 |
| 尿液 | 0 | 1 | 1 | 2 | 3 |
| 胸/腹水 | 0 | 0 | 2 | 0 | 1 |
| 骨髓 | 1 | 0 | 0 | 1 | 0 |
| 脑脊液 | 0 | 0 | 0 | 1 | 0 |
| 合计 | 9 | 8 | 13 | 14 | 19 |
(1)血常规:诊断时白细胞数:>20×109/L 4例,(10~20)×109/L 26例,<10×109/L 19例;中性粒细胞比例:>70% 10例,50%~70% 19例,30%~50% 13例,<30% 7例;血红蛋白:>120 g/L 3例,90~120 g/L 10例,60~90 g/L 29例,<60 g/L 7例。血小板:>300×109/L 21例,100~300×109/L 18例,<100×109/L 10例。9例患儿同时存在两系减少,7例患儿同时存在三系减少。(2)超敏C反应蛋白(hsCRP):诊断时1~10 mg/L 5例,10~50 mg/L 28例,50~100 mg/L 7例,>100 mg/L 9例。(3)降钙素原(procalcitonin,PCT):<0.5 ng/ml 31例,0.5~2.0 ng/ml 7例,2.0~10.0 ng/ml 3例,>10.0 ng/ml 8例。(4)(1,3)-β-D-葡聚糖试验(G试验):行G试验检查的37例患儿中,13例阳性,阳性率35.14%。其中曲霉菌G、马尔尼菲青霉菌、念珠菌试验的阳性率分别为100%(2/2)、33.33%(1/3)、31.25%(10/32)。
根据文献报道,年龄、性别、抗生素/糖皮质激素或免疫抑制剂的使用、侵袭性操作、住院时间、合并感染、基础疾病及输血史是发生IFI的主要影响因素[5,6]。选取同期在我院PICU住院的非IFI患儿,采用整群抽样的方法,每6个月从中随机抽取20例共200例患儿为对照组,进行t检验或χ2检验。结果显示:IFI组患儿与非IFI组患儿相比,两组之间抗生素/糖皮质激素/免疫抑制剂的使用、侵袭性操作、住院时间>10 d、合并感染、基础疾病及输血史差异有统计学意义(P<0.05)(表4)。
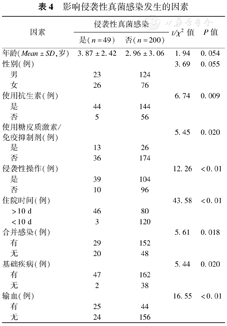
影响侵袭性真菌感染发生的因素
影响侵袭性真菌感染发生的因素
| 因素 | 侵袭性真菌感染 | t/χ2值 | P值 | ||
|---|---|---|---|---|---|
| 是(n=49) | 否(n=200) | ||||
| 年龄(Mean±SD,岁) | 3.87±2.42 | 2.96±3.06 | 1.94 | 0.054 | |
| 性别(例) | 3.69 | 0.055 | |||
| 男 | 23 | 124 | |||
| 女 | 26 | 76 | |||
| 使用抗生素(例) | 6.74 | 0.009 | |||
| 是 | 44 | 144 | |||
| 否 | 5 | 56 | |||
| 使用糖皮质激素/免疫抑制剂(例) | 5.45 | 0.020 | |||
| 是 | 13 | 26 | |||
| 否 | 36 | 174 | |||
| 侵袭性操作(例) | 12.26 | <0.01 | |||
| 是 | 39 | 104 | |||
| 否 | 10 | 96 | |||
| 住院时间(例) | 43.58 | <0.01 | |||
| >10 d | 46 | 80 | |||
| <10 d | 3 | 120 | |||
| 合并感染(例) | 5.61 | 0.018 | |||
| 有 | 29 | 152 | |||
| 无 | 20 | 48 | |||
| 基础疾病(例) | 5.44 | 0.020 | |||
| 有 | 47 | 162 | |||
| 无 | 2 | 38 | |||
| 输血(例) | 16.55 | <0.01 | |||
| 有 | 25 | 44 | |||
| 无 | 24 | 156 | |||
将单因素分析中有统计学意义的因素纳入Logistic回归模型,结果显示抗生素/糖皮质激素/免疫抑制剂的使用,侵袭性操作,住院时间>10 d,合并感染、基础疾病及输血史是发生IFI的独立危险因素(表5)。
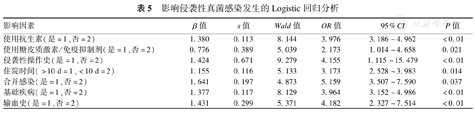
影响侵袭性真菌感染发生的Logistic回归分析
影响侵袭性真菌感染发生的Logistic回归分析
| 影响因素 | β值 | s值 | Wald值 | OR值 | 95%CI | P值 |
|---|---|---|---|---|---|---|
| 使用抗生素(是=1、否=2) | 1.380 | 0.113 | 8.144 | 3.976 | 3.186~4.962 | <0.01 |
| 使用糖皮质激素/免疫抑制剂(是=1、否=2) | 0.776 | 0.389 | 5.039 | 2.173 | 1.014~4.658 | 0.021 |
| 侵袭性操作史(是=1、否=2) | 1.424 | 0.671 | 9.279 | 4.155 | 1.115~15.479 | <0.01 |
| 住院时间(>10 d=1、<10 d=2) | 1.155 | 0.116 | 5.133 | 3.173 | 2.528~3.983 | 0.014 |
| 合并感染(是=1、否=2) | 1.641 | 0.197 | 4.873 | 5.159 | 3.507~7.590 | 0.037 |
| 基础疾病(是=1、否=2) | 1.377 | 0.117 | 8.129 | 3.964 | 3.152~4.986 | <0.01 |
| 输血史(是=1、否=2) | 1.431 | 0.299 | 5.371 | 4.182 | 2.327~7.514 | <0.01 |
本组患儿药敏分析结果显示,除产朊假丝酵母菌、酿酒酵母菌、葡萄牙假丝酵母菌各1例对伊曲康唑不敏感外,其他菌株对两性霉素B/脂质体、三唑类、棘白菌素类抗真菌药物均敏感。本组患儿中,26例单用一种抗真菌药物,平均使用时间(12.10±9.77)d,病死率19.23%(5/26),存活者培养平均转阴时间(10.85±7.18)d;23例联合使用两种抗真菌药物,平均使用时间(23.12±18.55)d,病死率4.35%(1/23),存活者培养平均转阴时间(21.72±19.30)d。
IFI是真菌侵入人体组织、血液,并在其中生长繁殖引起组织损害、器官功能障碍、炎症反应的疾病[2]。随着临床上广谱抗生素、糖皮质激素、免疫抑制剂的应用及近年来移植技术、体外生命支持技术的发展,IFI发病率和病死率不断增长。国外数据显示念珠菌感染病死率为39%,曲霉菌感染病死率为49.3%[7]。国内单中心儿童医院PICU(2007至2009年)报告IFI发生率为16.5/1 000,病死率为20%[8]。本组IFI发病率为11.2/1 000,病死率为12.24%,与其相比较低,但考虑到本组并未纳入微生物培养阴性的IFI患儿,实际的IFI发病率和病死率可能更高。本组患儿中,呼吸道是IFI最容易发生感染的器官,与其他研究结果相符[9,10],原因可能与有创呼吸机使用率较高有关,也有研究认为可能是因为肺循环具有血流量较大、压力和阻力较低的特点,且肺与外界相通有关[11]。
IFI的早期临床表现不具有特征性,及早识别与诊治较为困难。诊断往往需要综合评估宿主危险因素、治疗相关性因素(侵袭性操作、免疫抑制剂使用史等)、临床特征、微生物学检查四部分。研究发现,全静脉营养、手术史、脓毒症、抗生素的大量使用是发生IFI的重要条件[5,6],本研究结果发现,抗生素及糖皮质激素(或免疫抑制剂)的使用,侵袭性操作,住院时间较长,合并感染,基础疾病及输血是发生IFI的独立危险因素,这与其他研究结论相似,其原因可能为患儿正常的生理解剖屏障被破坏,正常的免疫功能被破坏,使定植于正常人体内的真菌产生致病性,从而导致IFI的发生[12,13]。
相比于院内获得性真菌感染,社区获得性真菌感染患儿的先天性疾病所占比例较高,这可能是因为相对于有多种危险因素的院内获得性真菌感染,基础疾病是社区获得性真菌感染的较为单一的危险因素。而患有先天性疾病的患儿可能由于生理解剖屏障未发育健全,从而使定植于正常人体内的真菌易突破生理解剖屏障产生致病性从而导致IFI的发生。呼吸系统、血液系统类基础疾病较为常见,原因可能是由于血液系统疾病与粒细胞缺乏之间关系密切,呼吸系统与环境、基础疾病、侵入性操作等多种因素相关[3,4],因此导致这些患儿免疫功能及生理屏障破坏较为严重,使其易患IFI。
本组大多数IFI患儿(45/49)诊断时血常规白细胞数正常或者轻中度升高(<20×109/L),中性粒细胞分布无明显特点,这与相关研究的结论相似[14,15],原因可能由于药物使用种类较多,时间较长,基础疾病差异较大,合并感染病原种类较为复杂等[16],因此临床表现、白细胞分布及中性粒细胞分布无明显特征。但本组患儿超敏C反应蛋白10~50 mg/L共28例,占57.14%,PCT<0.5 ng/ml共31例,占63.27%,表明较高的CRP和较低的PCT对提示IFI可能具有一定意义[17,18]。原因可能是由于真菌感染释放类型和强度有别于革兰阴性杆菌或革兰阳性菌所诱发的细胞因子以及其他促炎性细胞因子[19,20,21]。另外G试验也可作为早期诊断IFI的重要方法,但有研究认为G试验结果与真菌含量有关,其灵敏度及特异度低于成人,在儿科中的应用有待商议[22]。本组患儿G试验阳性率仅为35.14%,提示G试验诊断儿童IFI的价值有限。
研究显示,念珠菌是PICU中IFI患儿主要的病原,其中白色念珠菌占50%以上。但近年来近平滑念珠菌、热带念珠菌的感染率有所增加[18]。本研究显示我院PICU近5年来感染率排前3位的真菌为白色假丝酵母菌、近平滑假丝酵母菌、热带假丝酵母菌,与国内其他PICU调查类似[8]。与我院2007至2009年进行的真菌感染调查分析比较,真菌感染的例数增加,但仍以白色念珠菌为主,近平滑念珠菌明显增多[23]。
本组药敏显示,除产朊假丝酵母菌、酿酒酵母菌、葡萄牙假丝酵母菌各1例对伊曲康唑不敏感外,其他菌株对两性霉素B/脂质体、三唑类、棘白菌素类抗真菌药物均敏感。尽管耐药率不高,但患儿病死率为12.24%。抗真菌药物联合用药比例占46.94%,是否合理值得商榷。本组患儿中,尽管联合用药组患儿标本培养平均转阴时间长,但比单一用药组患儿病死率降低,分析其原因,一是联合用药组患儿中部分患儿在联合用药前单用一种抗真菌药物干预,效果不好之后改联合用药,延长了转阴时间,也统计到联合用药组中;另外可能是与联合用药组患儿病情本身相对复杂危重,导致转阴时间延长有关。Martín-Peña等[24]研究结果显示,对于严重或难治性IFI,联合用药可取得良好疗效,这可能与药物之间的协同作用有关。也有研究认为,联合用药不仅可在早期预防治疗时扩大菌群覆盖,而且可尽快控制临床症状[25]。但联合用药的患儿选择、联合用药方式等细节还有待于进一步临床研究。
综上所述,PICU患儿IFI并不少见,病情重,容易发生MODS,病死率高。病原菌以念珠菌为主,呼吸道是最常见的感染部位,常合并其他病原菌感染。在临床工作中,特别是对于住院时间长,存在基础疾病、近期内输血、使用抗生素/糖皮质激素/免疫抑制剂、有侵袭性操作等IFI发病危险因素的患儿,应提高警惕,及早识别IFI并经验性使用抗真菌药物,并做好支持治疗,有助于提高救治成功率。有益于IFI临床启动早期经验性治疗的诊断方法仍是未来继续探索的方向。
所有作者均声明不存在利益冲突



























