
探讨大鼠脊髓损伤功能评价指标运动诱发电位(MEP)和Basso-Beattie-Bresnahan (BBB)评分的相关性。
成年雌性SD大鼠16只,采用数字表法随机分为对照组和实验组,每组8只。对照组只施行手术,不给予外力打击。实验组应用PSI-IH装置复制脊髓损伤模型。记录并分析损伤前以及损伤后3 h、1 d、3 d、1周、2周、3周、4周、5周、6周大鼠脊髓运动诱发电位(scMEP)和肌肉运动诱发电位(mMEP),同时采用BBB评分对大鼠后肢运动功能进行评定。6周后观察大鼠脊髓组织学结构变化。
实验组大鼠脊髓损伤后3 h scMEP波幅减小,为正常波幅的32.69%±0.83%,2周后为正常波幅的52.93%±2.23%并处于稳定状态,但均低于对照组(P值均<0.01);损伤后3 h mMEP波形消失,1 d后恢复至正常波幅的1.16%±0.17%,3 d后波幅明显恢复,4周后达正常波幅的48.20%± 3.70%并处于稳定状态,但均低于对照组(P值均<0.01)。实验组大鼠脊髓损伤后3 h和1 d,所有大鼠BBB评分均为0分,3 d后评分(1.38±0.52)分,4周后评分(11.50±0.93)分,达到稳定状态,但均低于对照组(P值均<0.01)。实验组大鼠脊髓损伤后3 h~6周,scMEP与BBB评分均为显著相关(r值为0.732~0.908,P值均<0.05)。实验组大鼠脊髓损伤后1~6周mMEP与BBB评分呈中度至高度相关(r值为0.718~0.951,P值均<0.05)。对照组大鼠以上各指标均无显著变化。
大鼠脊髓损伤发生后,scMEP、mMEP和BBB评分三个脊髓功能指标会先后顺序恢复,而且scMEP、mMEP与BBB评分均存在着一定的相关性。大鼠脊髓损伤后,scMEP、mMEP是较BBB评分更为灵敏的脊髓功能评价指标。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脊髓损伤是指因外伤或病理因素造成的脊髓结构或功能性伤害,导致感觉、运动功能异常,或伴有相关的器官功能降低或丧失。随着社会的发展,交通事故、高空坠落、运动意外、暴力事件高发,导致脊髓损伤的发病率急剧升高。研究脊髓损伤的发生、发展和预后,对提高患者生活质量、降低医疗成本具有重要价值。目前,大鼠脊髓损伤是研究脊髓损伤动物实验最为常用的模型,因其病理变化比较接近于人类,且来源和价格方面又优于灵长类动物[1]。评价脊髓损伤最常用的指标主要有电生理学检测指标如运动诱发电位(motor evoked potential, MEP)[2]和行为学指标如Basso-Beattie-Bresnahan (BBB)评分[3]。电生理学指标比较客观准确,可重复性强,易于定量分析;其缺点是监测不方便,需要特定的仪器设备,要求检查者掌握检测仪器的原理和使用方法。行为学评分比较方便,能够随时反复评定,但主观性较强。因此,两种指标相结合能够更加准确地反映脊髓功能,但它们之间是否具有相关性目前未见报道。本研究拟采用大鼠脊髓损伤模型,对脊髓损伤前、后不同时间脊髓功能进行对比分析,探讨脊髓MEP(spinal cord MEP, scMEP)、肌肉MEP(muscl MEP, mMEP)与BBB评分的相关性,以期为评定临床脊髓损伤患者脊髓功能、判断疾病的预后和指导康复训练提供理论依据。
PSI-IH脊髓打击器(University of New Jersey,美国),MedLab-6生物信号处理系统(南京美易公司),水合氯醛、氯霉素注射液(国药有限公司),多聚甲醛粉末(Sigma,美国),CM1100型冰冻切片机(Leica,德国)。
2月龄成年雌性SPF级Sprague-Dawley(SD)大鼠16只,体质量220~250 g,购自江苏省南京市江宁区青龙山动物繁殖场;生产许可号:SCXK(苏)2017-0011;实验动物质量合格证号:No.201803587。本实验已通过蚌埠医学院动物保护和使用委员会同意,符合实验动物伦理学要求。
动物饲养于清洁笼内,自由饮食饮水,动物房温度22~25 ℃,湿度50%~60%,保持日夜规律变化。采用数字表法将大鼠随机分为对照组和实验组,每组8只。应用水合氯醛(50 mg/kg,腹腔注射)麻醉大鼠。实验组采用文献[4]的方法,以T9脊髓段为中心暴露直径约3 mm圆形区域,使用PSI-IH打击器,用120 kdyn力撞击脊髓,建立脊髓损伤模型。撞击损伤之肌肉和皮肤分层缝合,置于恒定温度和湿度的房间内,每天进行3次人工膀胱排空,直到建立反射性膀胱排空。术后动物每天饮用水中加入氯霉素(50~75 mg/kg)预防感染。对照组只施行手术暴露脊髓,不给予外力打击。
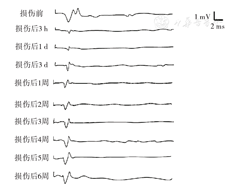
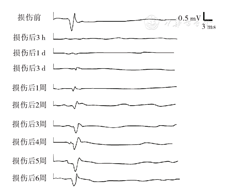
应用MedLab-6生物信号处理系统记录MEP,参考文献[5]方法。刺激方式:单脉冲刺激。刺激参数:强度20 mA,波宽0.1 ms,间隔100 ms。刺激电极:分别置于大鼠头颅中线皮下和硬腭黏膜下。scMEP记录电极:银球电极置脊硬膜外,参比电极刺入脊旁肌。mMEP记录电极:同心圆电极刺入右后肢腓肠肌,参比电极铜片电极置大鼠颈部皮下。分别记录并分析损伤前和损伤后3 h、1 d、3 d、1周、2周、3周、4周、5周、6周大鼠scMEP和mMEP。以上电极阻抗要求小于5 kΩ。放大器:放大倍数4 000倍,带通滤波20~2 000 Hz。大鼠大脑皮层接受刺激后,可以在脊髓记录到scMEP。正常scMEP的波形表现为2个正向P波和负向N波,以P-N波峰峰值波幅计算机自动测量scMEP的大小(图1)。以各大鼠损伤前scMEP波幅为标准值,计算损伤后scMEP占损伤前scMEP的百分比。大鼠大脑皮层接受刺激后,同时可以在肌肉记录到mMEP。正常mMEP的波形表现为一个正向P波和一个负向N波,以P-N波峰峰值波幅计算机自动测量mMEP的大小(图2)。以各大鼠损伤前的mMEP波幅为标准值,计算损伤后mMEP占损伤前mMEP的百分比。


使用BBB运动器对实验大鼠进行行为学评估[4]。在损伤前,以及损伤后1 d、3 d、1周、2周、3周、4周、5周和6周,分别进行BBB评分实验。评估于晚上19∶00—20∶00进行,允许动物在开阔的地面自由行走4 min。大鼠后肢功能评分为0~21分,其中0~7分主要评定大鼠后肢关节活动,8~13分主要评定大鼠后肢步态与协调,14~21分主要评定大鼠运动中爪的精细动作,具体评分标准参考文献[3,6]。评分者为2名经过培训熟悉评分标准的人员,不了解实验分组和进程,独立评分,取其平均值作为行为学评分结果。
脊髓损伤6周后,用过量麻醉法处死动物。取损伤段T9制成10 mm脊髓段,多聚甲醛浸泡过夜,脱水,包埋。将脊髓横断面制成10 μm冠状薄切片,行HE染色。光镜观察组织结构改变。
应用SPSS 13.0统计学软件对数据进行分析。近似服从正态分布的计量数据以 ±s表示,两组间比较采用独立样本t检验。正态分布资料采用Pearson相关,非正态分布资料采用Spearman秩相关法分析。以P<0.05为差异有统计学意义。
±s表示,两组间比较采用独立样本t检验。正态分布资料采用Pearson相关,非正态分布资料采用Spearman秩相关法分析。以P<0.05为差异有统计学意义。
结果表明,实验组大鼠脊髓损伤后3 h scMEP波形不稳定,波幅明显减小,达正常波幅的32.69%±0.83%;2周后恢复达正常波幅的52.93%±2.23%,继而达到稳定状态,但均低于对照组,差异均有统计学意义(P值均<0.01)。而P波和N波的潜伏期无显著改变,对照组大鼠各指标均无显著改变。见图1、表1。
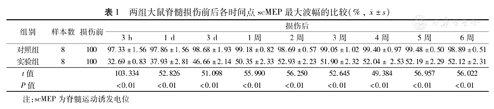
两组大鼠脊髓损伤前后各时间点scMEP最大波幅的比较(%,  ±s)
±s)
两组大鼠脊髓损伤前后各时间点scMEP最大波幅的比较(%,  ±s)
±s)
| 组别 | 样本数 | 损伤前 | 损伤后 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 h | 1 d | 3 d | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | |||
| 对照组 | 8 | 100 | 97.33±1.56 | 97.86±1.56 | 98.68±1.93 | 99.18±0.82 | 98.69±0.57 | 99.05±1.02 | 99.40±0.97 | 99.48±0.50 | 98.89±0.51 |
| 实验组 | 8 | 100 | 32.69±0.83 | 37.93±2.81 | 46.66±2.14 | 50.35±2.33 | 52.93±2.23 | 51.90±2.32 | 52.04± 2.53 | 52.19±2.29 | 52.12±2.31 |
| t值 | 103.334 | 52.826 | 51.098 | 55.990 | 56.250 | 52.645 | 49.384 | 56.957 | 56.022 | ||
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | ||
注:scMEP为脊髓运动诱发电位
结果表明,实验组大鼠脊髓损伤后mMEP波形消失,1 d后再次出现达正常波幅的1.16%±0.17%,3 d后波幅可达正常波幅的8.76%±0.80%,4周后恢复到正常波幅48.20%±3.70%,继而达到稳定状态,但以上各时期mMEP均低于对照组,差异均有统计学意义(P值均<0.01)。而P波和N波的潜伏期无显著改变,对照组大鼠各指标均无显著改变。见图2、表2。
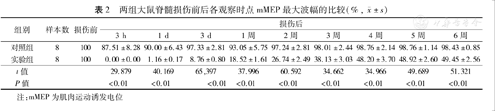
两组大鼠脊髓损伤前后各观察时点mMEP最大波幅的比较(%,  ±s)
±s)
两组大鼠脊髓损伤前后各观察时点mMEP最大波幅的比较(%,  ±s)
±s)
| 组别 | 样本数 | 损伤前 | 损伤后 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 h | 1 d | 3 d | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | |||
| 对照组 | 8 | 100 | 87.51±8.28 | 90.00±6.43 | 97.33±2.81 | 93.05±5.75 | 97.24±2.81 | 98.01±2.44 | 98.76±2.14 | 98.76±1.14 | 98.43±0.85 |
| 实验组 | 8 | 100 | 0.00±0.00 | 1.16±0.17 | 8.76±0.80 | 18.52±1.61 | 26.74±2.49 | 38.13±3.03 | 48.20±3.70 | 48.92±2.60 | 49.45±2.56 |
| t值 | 29.879 | 40.169 | 65,397 | 37.996 | 60.592 | 34.662 | 34.966 | 49.689 | 51.321 | ||
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | ||
注:mMEP为肌肉运动诱发电位
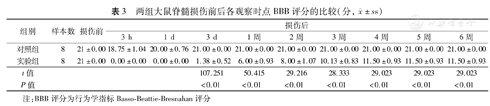
脊髓损伤前所有大鼠BBB评分能达到21分。实验组大鼠脊髓损伤后3 h和1 d,所有大鼠BBB评分为0分;损伤后3 d为(1.38±0.52)分;然后随着观察时间的延长,大鼠的运动功能逐渐恢复,1周、2周后评分分别为(6.00±0.93)分、(8.00±1.07)分。损伤后3周评分为(10.13±0.83)分;4、5、6周后评分达到一个平台,BBB平均为11.50分。以上各时期实验组大鼠BBB评分均低于对照组,差异有统计学意义(P值均<0.01)。对照组大鼠各时期BBB评分均无显著改变。见表3。
两组大鼠脊髓损伤前后各观察时点BBB评分的比较(分, ±ss)
±ss)
两组大鼠脊髓损伤前后各观察时点BBB评分的比较(分, ±ss)
±ss)
| 组别 | 样本数 | 损伤前 | 损伤后 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 h | 1 d | 3 d | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | |||
| 对照组 | 8 | 21±0.00 | 18.75±1.04 | 20.00±0.76 | 21.00±0.00 | 21.00±0.00 | 21.00±0.00 | 21.00±0.00 | 21.00±0.00 | 21.00±0.00 | 21.00±0.00 |
| 实验组 | 8 | 21±0.00 | 0.00±0.00 | 0.00±0.00 | 1.38±0.52 | 6.00±0.93 | 8.00±1.07 | 10.13±0.83 | 11.50±0.93 | 11.50±0.93 | 11.50±0.93 |
| t值 | 107.251 | 50.415 | 29.216 | 28.333 | 29.023 | 29.023 | 29.023 | ||||
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | ||||
注:BBB评分为行为学指标Basso-Beattie-Bresnahan评分
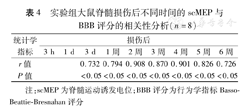
根据脊髓损伤后scMEP和BBB评分的特点,分别选取损伤后的scMEP波幅百分比,与BBB评分作相关性分析。结果表明,实验组大鼠脊髓损伤后3 d~6周,scMEP与BBB评分均为显著相关(r值为0.732~0.908,P值均<0.05),见表4。
实验组大鼠脊髓损伤后不同时间的scMEP与BBB评分的相关性分析(n=8)
实验组大鼠脊髓损伤后不同时间的scMEP与BBB评分的相关性分析(n=8)
| 统计学指标 | 损伤后 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 3 h | 1 d | 3 d | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | |
| r值 | 0.732 | 0.794 | 0.908 | 0.870 | 0.901 | 0.826 | 0.726 | ||
| P值 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | ||
注:scMEP为脊髓运动诱发电位;BBB评分为行为学指标Basso-Beattie-Bresnahan评分
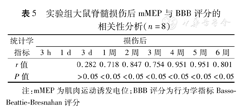
根据脊髓损伤后mMEP的特点,分别选取损伤后的mMEP波幅百分比与BBB评分作相关分析。结果表明,实验组大鼠脊髓损伤后1~6周,mMEP与BBB分呈中度至高度相关(r值为0.718~0.951, P值均<0.05),见表5。
实验组大鼠脊髓损伤后mMEP与BBB评分的相关性分析(n=8)
实验组大鼠脊髓损伤后mMEP与BBB评分的相关性分析(n=8)
| 统计学指标 | 损伤后 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 3 h | 1 d | 3 d | 1周 | 2周 | 3周 | 4周 | 5周 | 6周 | |
| r值 | 0.282 | 0.718 | 0.847 | 0.754 | 0.951 | 0.951 | 0.801 | ||
| P值 | >0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | ||
注:mMEP为肌肉运动诱发电位;BBB评分为行为学指标Basso-Beattie-Bresnahan评分
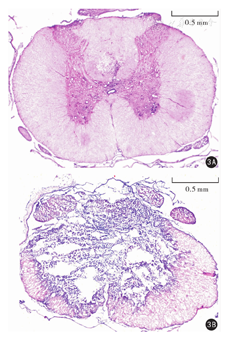
实验组大鼠脊髓损伤6周后,脊髓灰质区部分坏死灶,形成较大空腔,细胞胞浆浑浊。对照组大鼠脊髓组织结构正常。见图3。

目前,临床上脊髓损伤患者运动功能障碍主要是通过检查患者的感觉和运动功能丧失的平面和程度进行诊断。与此同时,针对脊髓损伤实验动物模型,出现了诸多评价手段,比如斜板实验、Tarlov评分法、BBB评分法等。但这些被广泛应用的评价整体运动功能的指标,有一定的缺陷,比如它们不能很好地提供神经机制方面的信息用于科学研究和临床用药,对脊髓严重损伤不能做出客观测试[7],还有不可避免的测试者主观因素的干扰等。
神经电生理检查可较早地客观反映脊髓功能,其中诱发电位(evoked potential, EP)的应用最为广泛。EP是指对神经系统施加刺激,在神经中枢、神经传导通路和效应器(如肌肉)上,可以记录到特定位相的电变化,能够反映神经系统一定部位的功能状态。根据刺激形式,EP可分为外源性刺激相关电位(感觉运动功能)和内源性事件相关电位(认知功能),其中外源性刺激相关电位包括感觉诱发电位(sensory evoked potential, SEP)和MEP。SEP在临床上主要包括躯体感觉诱发电位、视觉诱发电位和听觉诱发电位等[8]。其中躯体SEP最早广泛应用于临床,比如脊髓损伤和脊髓术中电生理监测等,对脊髓感觉上传通路和感觉障碍进行客观分析和量化测定。SEP对脊髓损伤十分敏感,它贯穿于患者出现临床症状的前中后各期,是脊髓损伤鉴定、治疗方案监测、康复预测和指导的重要指标。但是SEP主要反映脊髓感觉上传通路的功能,不能直接反应脊髓运动下传通路的功能,更不能了解躯体肌肉的运动功能。研究表明,有些SEP指标正常患者也会出现运动功能障碍,甚至有些SEP指标异常患者反而不会出现运动功能障碍[9]。因此,监测MEP对判断脊髓损伤患者运动功能的恢复更为重要。
MEP主要包括scMEP和mMEP。大鼠脊髓损伤早期,由于脊髓出血、水肿、坏死,部分中央管断裂,白质纤维变性,部分神经轴索出现排列散乱、髓鞘浊肿等变化[10]。脊髓组织缺血缺氧、缺血-再灌注损伤[11,12],线粒体能量代谢异常[13,14],白细胞介素-1β、肿瘤坏死因子[15]、活性氧簇生成增多[16],加剧细胞损伤。受损细胞释放兴奋性氨基酸递质,激活NMDA受体[17],细胞钙超载,细胞凋亡[18],导致脊髓电生理功能指标异常。本研究结果表明,脊髓损伤后大鼠scMEP波幅减小。受损脊髓休克期过后,脊髓的结构和功能开始恢复,3 h后scMEP部分恢复。随后损伤的神经轴索再生延长,2周后scMEP恢复到正常波幅52.93%±2.23%。生理条件下,腓肠肌的收缩活动受到腓神经的支配。脊髓损伤早期,腓神经对腓肠肌的功能支配和营养作用丧失,mMEP波形消失。随着脊髓功能的恢复,1 d后mMEP再次出现,损伤后3 d可达正常波幅8.76%±0.80%,4周后恢复到正常波幅的48.2%±3.70%。因此,脊髓损伤发生后,scMEP能够早于mMEP监测脊髓功能和恢复情况。
BBB评分是最常用的行为学检测指标[19,20]。作为低等哺乳动物,SD大鼠拥有很强的损伤修复能力。有文献报道,SD大鼠脊髓损伤,只要超过5%的腹侧运动神经纤维残留,就能恢复下肢运动和行走功能。即使大鼠脊髓完全横断伤,感觉运动功能完全丧失,经过20 d左右的恢复,BBB评分仍然可以达到8分水平,十分有利于行为学检测[21]。本研究结果表明:脊髓损伤早期大鼠无自主运动,评分为0分,损伤后3 d可有分值记录,为(1.38±0.52)分;然后随着大鼠脊髓运动功能的逐渐恢复,4周后评分达到一个平台,提示脊髓功能和腓肠肌运动功能均达到稳定状态。但该指标平台期的出现明显滞后于MEP指标。
综上所述,脊髓损伤发生后,scMEP、mMEP和BBB评分三个指标会先后顺序恢复,可能与神经元对肌肉组织除了功能支配作用外,还有重要的营养性作用有关,其具体机制尚需深入探讨。而且scMEP、mMEP均与BBB评分存在着一定的相关性。大鼠脊髓损伤后,scMEP、mMEP是较BBB评分更为灵敏的脊髓功能评价指标。鉴于目前尚无相关的临床资料研究,下一步研究内容主要集中在临床数据收集和分析,以期能够指导临床医生综合考虑患者脊髓损伤程度和部位、实验室检测条件和医生临床目的,合理选择科学的检测指标,从而达到取长补短、优势互补、优化治疗和康复方案的目的,最终实现患者的利益最大化。
所有作者均声明不存在利益冲突



























