
探讨血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)基因单核苷酸多态性(single-nucleotide polymorphism,SNP)位点与新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)的相关性。
选择2014年8月至2016年12月佛山市妇幼保健院和中山大学附属第六医院新生儿重症监护病房收治的Ⅱ期及以上NEC早产儿(NEC组),以及同期住院、胎龄和体重与NEC组相匹配的非NEC早产儿(对照组)为研究对象。应用SEQUENOM MassARRAY基因分型检测技术分析VEGFA rs1005230、rs833067、rs3025010、rs3025035、rs3025036、rs10434和rs6905288基因频率在两组中的分布;酶联免疫吸附试验测定两组血浆VEGFA浓度并比较。数据分析应用SPSS 20.0软件,基因型频率Hardy-Weinberg平衡采用SHISUS软件分析。
NEC组和对照组分别纳入30例和80例早产儿。rs1005230 T次要等位基因和rs833067 C次要等位基因与NEC发生有显著相关性,NEC组rs1005230 C/T(OR=4.810,95%CI 1.742~13.278)和C/T-T/T(OR=4.892,95%CI 1.801~13.246)、rs833067 T/C(OR=4.373,95%CI 1.578~12.129)和T/C-C/C(OR=4.000,95%CI 1.484~10.828)基因型频率高于对照组,差异有统计学意义(P<0.05)。两组含有次要等位基因基因型多态性位点rs1005230和rs833067患儿的血浆VEGFA含量均低于不含次要等位基因的纯合基因型患儿,差异有统计学意义(P<0.01)。
VEGFA rs1005230和rs833067多态性可能与患儿血浆VEGFA含量低及NEC高风险有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是新生儿重症监护病房(neonatal intensive care unit,NICU)最常见的外科急症,也是诱发肠穿孔和全身炎症反应的主要原因之一[1,2]。NEC多见于早产儿,出生体重500~1 500 g的早产儿NEC发生率可达5%~7%[3]。随着NICU监护技术的提高,早产儿存活率明显上升,但NEC发生率无明显下降。近年来越来越多的研究结果显示,基因多态性与NEC的发生密切相关。我们最近研究也发现,血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)相关多态性位点和血浆VEGF水平降低与NEC的发生密切相关[4]。由于VEGFA存在的众多多态性位点与多种疾病有关,因此,本研究在前期研究的基础上[4,5],利用限制性片段长度多态性方法对VEGFA多态性进行检测,探讨VEGFA是否存在与NEC发病有关的多态性位点。
选择2014年8月至2016年12月佛山市妇幼保健院及中山大学附属第六医院NICU收治的早产儿进行前瞻性研究。NEC组纳入标准[6]:(1)胎龄<32周,出生体重<1 500 g;(2)临床以腹胀、呕吐、腹泻、血便为表现,其中腹胀常为首发症状;(3)X线表现为动力性肠梗阻、门脉积气、肠壁囊样积气、腹腔渗液增多、一段肠管扩张固定、气腹;(4)结合临床表现与X线征象诊断为Ⅱ期及以上NEC病例。对照组纳入标准:(1)胎龄<32周,出生体重<1 500 g;(2)无严重并发症。排除标准:伴有先天性心脏病、食道闭锁、肠闭锁、两性畸形等先天性畸形及先天性遗传代谢疾病等。本研究经佛山市妇幼保健院医学伦理委员会审核通过(FSFY-MEC-2014-005),患儿家属均签署知情同意书。
NEC组在临床诊断NEC后4 h内应用EDTA抗凝管采集0.5 ml外周静脉血,4℃ 1 000 r/min平衡离心10 min,小心抽吸上清,分装于200 μl的EP管中,连同下层血细胞一齐置于-80℃冰箱备用。对照组选择与NEC组一致的采血日龄采血,具体要求同上。使用ELISA测定试剂盒(Cuxabo,武汉)测定血浆VEGFA含量。
采用Qiagen试剂盒进行血液基因组DNA提取。所选单核苷酸多态性(single-nucleotide polymorphism,SNP)位点包括rs1005230、rs833067、rs3025010、rs3025035、rs3025036、rs10434和rs6905288。聚合酶链反应(polymerase chain reaction,PCR)引物参考GeneBank数据,利用Primer5自行设计(表1),由上海英骏生物技术有限公司合成。应用SEQUENOM MassARRAY平台(博奥生物,北京)进行基因分型检测。

PCR引物序列
PCR引物序列
| SNP位点 | 1st-PCRP | 2nd-PCRP | UEP SEQ |
|---|---|---|---|
| rs1005230 | ACGTTGGATGGCATATAGGAAGCAGCTTGG | ACGTTGGATGTCAGAGCCCCAACTTTGTTC | AGGTCAGAAACCAGC |
| rs833067 | ACGTTGGATGCTTCTCCGCAGAGAGAAATG | ACGTTGGATGAATTTCCTGACGCCCCTTCT | ctcAGCCCCTGTCACCCCG |
| rs3025010 | ACGTTGGATGTCTTCCCTGTGACAGACATC | ACGTTGGATGTGTCCCCTTCAAGAGAACCA | gTCTCCATGCCTGCCA |
| rs3025035 | ACGTTGGATGTATTCCCAGATACAGCCAGC | ACGTTGGATGAAGTGACCTGGGAGCTAACT | aTAACTGAAGTTACTCTAACCTC |
| rs3025036 | ACGTTGGATGTCAAGAGAGATGAGGCCTAC | ACGTTGGATGGTGAGGGACCATCTCCATTC | CCATGTCCCCTCCCA |
| rs10434 | ACGTTGGATGCCTTCGCTTACTCTCACCTG | ACGTTGGATGATGGGCTGCTTCTTCCAACA | GACATCTGCCAGTGG |
| rs6905288 | ACGTTGGATGAAGTAGAGAGAAGCCATCCC | ACGTTGGATGCCACCCCAAAACTTAGTAGC | ggATTTGCTTACAACTCACTAAA |
注:PCR为聚合酶链反应,SNP为单核苷酸多态性,1st-PCRP为PCR扩增前引物,2nd-PCRP为PCR扩增后引物,UEP SEQ为单碱基延伸反应引物
应用SPSS 20.0统计软件进行数据分析。正态分布的计量资料以 ±s表示,组间比较采用独立样本t检验;计数资料以例(%)表示,组间比较采用Pearson χ2检验;每个SNP位点的等位基因频率、基因型频率Hardy-Weinberg平衡采用SHISUS软件分析,之后应用非条件Logistic回归模型计算每一位点的比值比(odd ration,OR)和95%可信区间(95% confidence interval,95%CI)。应用单倍体软件包(Haploview4.2版)和SHEIS软件评价连锁不平衡和单倍型结构。P<0.05为差异有统计学意义。
±s表示,组间比较采用独立样本t检验;计数资料以例(%)表示,组间比较采用Pearson χ2检验;每个SNP位点的等位基因频率、基因型频率Hardy-Weinberg平衡采用SHISUS软件分析,之后应用非条件Logistic回归模型计算每一位点的比值比(odd ration,OR)和95%可信区间(95% confidence interval,95%CI)。应用单倍体软件包(Haploview4.2版)和SHEIS软件评价连锁不平衡和单倍型结构。P<0.05为差异有统计学意义。
研究期间两家医院的NICU共收治胎龄<32周、出生体重<1 500 g的早产儿387例,诊断Ⅱ期及以上NEC 30例,全部符合入选标准,其中男12例,女18例;胎龄(30.6±0.6)周;出生体重(1 350±110)g。针对每例NEC患儿选择同期胎龄和体重相匹配的非NEC患儿作为对照,共80例,其中男46例,女34例;胎龄(30.3±0.4)周,出生体重(1 240±60)g。两组性别、胎龄、出生体重差异均无统计学意义(P>0.05)。
研究对象经Hardy-Weinberg平衡检验,结果显示具有群体代表性(P>0.05)。对比两组次要等位基因频率,发现rs1005230的次要等位基因T和rs833067的次要等位基因C分别为发生NEC的保护位点和风险位点,见表2。
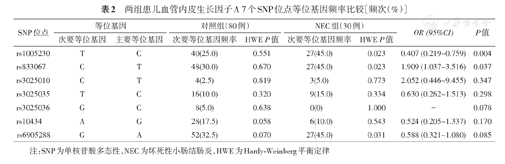
两组患儿血管内皮生长因子A 7个SNP位点等位基因频率比较[频次(%)]
两组患儿血管内皮生长因子A 7个SNP位点等位基因频率比较[频次(%)]
| SNP位点 | 等位基因 | 对照组(80例) | NEC组(30例) | OR (95%CI) | P值 | |||
|---|---|---|---|---|---|---|---|---|
| 次要等位基因 | 主要等位基因 | 次要等位基因频率 | HWE P值 | 次要等位基因频率 | HWE P值 | |||
| rs1005230 | T | C | 40(25.0) | 0.551 | 27(45.0) | 0.023 | 0.407 (0.219~0.759) | 0.004 |
| rs833067 | C | T | 48(30.0) | 0.670 | 27(45.0) | 0.023 | 1.909 (1.037~3.516) | 0.037 |
| rs3025010 | C | T | 4(2.5) | 0.819 | 3(5.0) | 0.773 | 2.052 (0.446~9.455) | 0.347 |
| rs3025035 | T | C | 16(10.0) | 0.320 | 9(15.0) | 0.334 | 0.630 (0.262~1.513) | 0.298 |
| rs3025036 | G | C | 8(5.0) | 0.638 | 0(0) | 1.000 | - | 0.078 |
| rs10434 | A | G | 28(17.5) | 0.058 | 6(10.0) | 0.543 | 0.524 (0.205~1.337) | 0.170 |
| rs6905288 | G | A | 52(32.5) | 0.070 | 27(45.0) | 0.031 | 0.588 (0.321~1.080) | 0.085 |
注:SNP为单核苷酸多态性,NEC为坏死性小肠结肠炎,HWE为Hardy-Weinberg平衡定律
应用非条件Logistic回归模型对rs1005230和rs833067进行分析发现,在共显性模型下,携带rs1005230 CT基因型较携带CC基因型个体NEC患病风险增加了4.810倍、携带rs833067 TC基因型较携带TT基因型个体NEC患病风险增加了4.373倍;在显性模型下,携带rs1005230 CT-TT基因型较携带CC基因型个体NEC患病风险增加了4.892倍、携带rs833067 TC-CC基因型较携带TT基因型个体NEC患病风险增加了4.000倍;在纯合子模型下,携带rs1005230 T等位基因较C等位基因个体NEC患病风险增加了3.079倍、携带rs833067 C等位基因个体较T等位基因个体NEC患病风险增加了2.050倍。见表3。
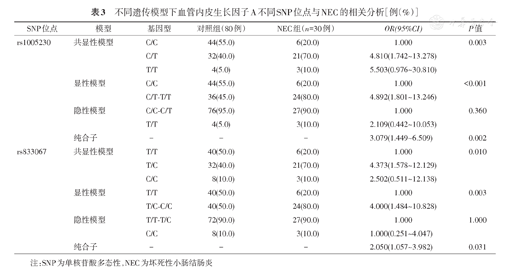
不同遗传模型下血管内皮生长因子A不同SNP位点与NEC的相关分析[例(%)]
不同遗传模型下血管内皮生长因子A不同SNP位点与NEC的相关分析[例(%)]
| SNP位点 | 模型 | 基因型 | 对照组(80例) | NEC组(n=30例) | OR(95%CI) | P值 |
|---|---|---|---|---|---|---|
| rs1005230 | 共显性模型 | C/C | 44(55.0) | 6(20.0) | 1.000 | 0.003 |
| C/T | 32(40.0) | 21(70.0) | 4.810(1.742~13.278) | |||
| T/T | 4(5.0) | 3(10.0) | 5.503(0.976~30.810) | |||
| 显性模型 | C/C | 44(55.0) | 6(20.0) | 1.000 | <0.001 | |
| C/T-T/T | 36(45.0) | 24(80.0) | 4.892(1.801~13.246) | |||
| 隐性模型 | C/C-C/T | 76(95.0) | 27(90.0) | 1.000 | 0.360 | |
| T/T | 4(5.0) | 3(10.0) | 2.109(0.442~10.053) | |||
| 纯合子 | - | - | - | 3.079(1.449~6.509) | 0.002 | |
| rs833067 | 共显性模型 | T/T | 40(50.0) | 6(20.0) | 1.000 | 0.010 |
| T/C | 32(40.0) | 21(70.0) | 4.373(1.578~12.129) | |||
| C/C | 8(10.0) | 3(10.0) | 2.502(0.511~12.138) | |||
| 显性模型 | T/T | 40(50.0) | 6(20.0) | 1.000 | 0.003 | |
| T/C-C/C | 40(50.0) | 24(80.0) | 4.000(1.484~10.828) | |||
| 隐性模型 | T/T-T/C | 72(90.0) | 27(90.0) | 1.000 | 1.000 | |
| C/C | 8(10.0) | 3(10.0) | 1.000(0.251~4.047) | |||
| 纯合子 | - | - | - | 2.050(1.057~3.982) | 0.031 |
注:SNP为单核苷酸多态性,NEC为坏死性小肠结肠炎
连锁不平衡和单倍型分析显示,rs1005230和rs833067位点间存在连锁不平衡(3.5 kb)(D′>1.0,r2>0.847),TC单倍型可使新生儿患NEC的风险增加2.872倍(Z=7.802,OR=2.872,95%CI 1.348~6.092,P=0.005)。
NEC组和对照组中,含有次要等位基因基因型多态性位点rs1005230和rs833067患儿的血浆VEGFA含量均明显低于不含次要等位基因的纯合基因型患儿,见图1。
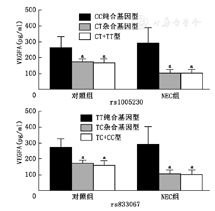

注:VEGFA为血管内皮生长因子A;a与同组纯合基因型比较,P<0.01
目前NEC确切的发病机制及病因尚不清楚,但已明确早产、肠道菌群定植及配方奶喂养是其3大风险因素[7]。此外,影响肠道血流动力学及肠道血管舒缩功能的各种因素也可能促进NEC的发生发展。
VEGFA是VEGF家族成员,在人类位于6p21.3染色体,由8个外显子组成,具有明显的促血管生成、抗凋亡和抗炎等多种效应。目前,至少发现140余种VEGFA多态性位点,其中一些位点与临床疾病密切相关[8,9,10,11,12,13,14]。最近我们研究发现VEGFA rs699947和rs833061位点是NEC的风险位点[4];在此基础上,本研究进一步发现rs1005230的次等位基因T与NEC的风险成负相关,rs833067的次等位基因C与NEC的风险成正相关。但进一步通过不同遗传模型分析,发现rs1005230的CT和CT-TT基因型以及rs833067的TC和TC-CC基因型与NEC的风险密切相关。
我们的前期研究发现,NEC组血浆VEGFA浓度明显低于对照组(210.50 pg/ml比102.50 pg/ml)[4],本研究进一步与血浆VEGFA水平关联分析发现,rs1005230和rs833067多态性位点均与血浆VEGFA水平降低密切相关,而且rs1005230 CT和CT-TT基因型以及rs833067 TC和TC-CC基因型个体无论是否发生NEC,其血浆VEGFA水平均低于相对应的纯合型个体。近年相关研究结果也显示,NEC患儿肠道组织VEGFA蛋白表达下降[15],VEGFA基因过表达,通过促进血管生成、缓解绒毛萎缩和组织水肿,从而降低NEC发生率[16]。因此,结合已有的文献报道[4,15,16],我们考虑VEGFA基因多态性改变可通过降低VEGFA蛋白表达水平、阻碍血管生成,进而增强肠道组织的通透性、参与NEC的发病过程。
本研究未发现rs3025035、rs3025036、rs3025010、rs10434、rs6905288多态性位点与NEC相关。有文献报道rs3025035和rs3025036与膀胱癌风险无关[17]、rs3025010与胶质瘤风险无关,也提示这些位点可能与疾病无明显相关性。相反,Zhao等[18]报道rs3025035可能与胶质瘤风险相关,Almawi等[19]报道rs10434与复发性自发性流产有关,Zhu等[20]报道VEGFA基因中的rs10434与中国人群的B-CLL相关,Castro等[21]报道rs6905288与胆管结石有关,提示不同的SNP位点可能与不同疾病相关。
综上所述,本研究结果显示VEGFA rs1005230和rs833067多态性可能与NEC相关,但限于本研究样本量少,可能对实验数据造成影响,因此需要扩大样本量进一步对VEGFA SNP位点与NEC之间的关联性进行深入研究。
本研究得到中山大学附属第六医院马飞博士的协助
所有作者均声明不存在任何利益冲突



























