
建立先天性巨结肠小肠结肠炎(Hirschsprung’s - associated enterocolitis,HAEC)大鼠模型,为进一步研究HAEC的发病机制及分子生物学机制提供可靠模型。
将120只6~8周龄SD大鼠按随机数字表法平均分为对照组、先天性巨结肠(Hirschsprung’s disease,HSCR)组和HAEC组。将HACE组的大鼠在造模前一周用大肠杆菌JM83按照1×109 CFU/d的剂量灌胃。对照组和HSCR组用相同剂量的生理盐水灌胃。1周后将3组大鼠使用1%的苯巴比妥钠经腔注射麻醉后剖腹,提出结肠并显露直肠末段,HSCR组和HAEC组用0.1% 苯扎溴铵(benzalkonium chloride ,BAC)纱布紧贴包绕直肠末段作用45 min以制作动物模型,对照组使用生理盐水。在造模后的第一、三、五、七周对模型进行大体观察,用髓过氧化物酶(MPO)活性检测评估经BAC或生理盐水处理段直肠的近端结肠组织以评估肠道炎症情况,用RT-PCR检测乙酰胆碱酯酶(AchE)、胶质细胞源性神经营养因子(GDNF)的表达情况。在造模后第五周取直肠末段行病理学检查以检测建模是否成功,并用16S rRNA技术检测各组中小肠、横结肠、直肠中菌群结构的变化。
术后第三周,HSCR组和HAEC组的大鼠逐渐出现腹胀、进食及排便减少。处理段肠道狭窄、近端结肠扩张、大便堆积。术后第五周HAEC组大鼠腹胀程度明显比HSCR组的大鼠明显。病理学检查发现BAC处理段在5周后神经节细胞数量明显减少,于7周后完全消失。MPO活性检测发现在第五周近端结肠组织的MPO活性:HAEC组(10.4±0.43)明显高于HSCR组(7.6±0.35)及对照组(2.8±0.16)(P<0.05),在第七周近端结肠组织的MPO活性:HAEC组(13.2±0.56)与HSCR组(11.2±0.35)的差异无统计学意义(P>0.05)。用RT-PCR检测AchE、GDNF的mRNA表达,结果表明AchE mRNA和GDNF mRNA在HSCR组及HAEC组的表达明显下调,第五周HSCR组和HAEC组的AchE mRNA表达量分别为(0.74±0.09,0.55±0.11);GDNF mRNA的表达量分别为(0.47±0.12,0.40±0.22);第七周HSCR组和HAEC组的AchE mRNA表达量分别为(0.67±0.03,0.46±0.13);GDNF mRNA的表达量分别为(0.51±0.06、0.31±0.09),第五周和第七周AchE mRNA和GDNF mRNA的表达量均较对照组降低,差异具有统计学意义(P<0.05),HSCR组和HAEC组之间的差异在各时间点均无统计学意义(P>0.05)。造模后第五周对HAEC组大鼠的近端结肠切片行HE及免疫荧光染色可见结肠黏膜在镜下呈炎性改变。用16S rRNA技术检测大鼠的小肠、横结肠和直肠三处肠道菌群的分布情况,共发现27种细菌种属。小肠、横结肠和直肠中肠道菌群占比情况:HAEC组以肠杆菌科占比最高,分别为17.3%、22.8%和34.7%,其次为梭菌目,占比分别为8.7%、12.4%和10.4%,粪杆菌属占比分别为6.9%、7.9%、8.6%,梭杆菌属占比分别为7.6%、3.8%和5.6%;在HSCR组中乳杆菌目占比最高,分别为14.5%、9.4%和5.7%,其次为拟杆菌类,占比分别为12.6%、9.4%和6.3%,肠杆菌科占比分别为4.3%、6.3%和7.1%,梭菌属占比分别为6.4%、5.2%和4.6%。
采用0.1%BAC剖腹处理直肠末段结合灌胃大肠杆菌JM83的方法成功建立了先天性巨结肠小肠结肠炎的SD大鼠动物模型,为深入研究先天性巨结肠小肠结肠炎的发病机制及预防提供一个可靠的模型基础。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
先天性巨结肠小肠结肠炎(Hirschsprung’s-associated enterocolitis,HAEC)为先天性巨结肠(Hirschsprung’s disease,HSCR)最常见的并发症之一,临床上表现为腹胀、爆发性腹泻、呕吐、发热、意识模糊,严重时发生休克[1,2]。有研究报道HAEC的发病率为17%~40%,在全结肠型巨结肠患儿中的发病率高达55%,同时也是先天性巨结肠患儿死亡的重要原因之一[3]。既往的研究表明HAEC的发病与肠道黏膜屏障的破坏、异常的免疫应答和菌群失调有关[4,5]。但HAEC的具体发病机制并不清楚,目前尚无HAEC实验动物模型的相关研究报道。本研究通过建立实验性HAEC的SD大鼠模型,为进一步探讨HAEC的发病机制及分子生物学机制提供模型基础。
1%苯扎氯胺(benzalkonium chloride,BAC)(德国Simga-Aldrich公司),DAPI荧光染料(瑞士Roche公司),封闭用山羊血清原液(北京中杉金桥生物技术有限公司),PBS缓冲液(pH=7.4)(北京中杉金桥生物技术有限公司),RNAiso Plus(Trizol液)、Prime ScriPt™ RT reagent Kit、SYBRⓇ Premix Ex Taq™ Ⅱ[宝生物工程(大连)有限公司],大肠杆菌菌株JM83)(美国ATCC公司),AxyPreDNA凝胶回收试剂(美国Axygen公司),细菌裂解缓冲液,琼脂糖凝胶电泳,NanoDrop ND-1000核酸定量仪。
所有实验程序均遵守动物福利道德原则。成年SD大鼠120只,6~7周龄,雌雄均可,体重为(160±10)g,由陆军军医大学实验动物中心提供,许可证号:SCXK(渝)2018-0165。统一环境下(自然光照、温度20℃~25℃、湿度40%~70%)饲养于遵义医学院中心实验室动物房。按随机数字表法分为对照组、HSCR组和HACE组3组,每组40只。
将HACE组的大鼠在造模前一周用大肠杆菌JM83按照1×109 CFU/d的剂量灌胃。对照组和HSCR组用相同剂量的生理盐水灌胃。
开腹手术行造模操作前将三组大鼠禁食24 h,不禁水,排空肠道粪便。使用1% 苯巴比妥钠按照1 ml/100 g的剂量经腹腔注射以麻醉大鼠,麻醉成功后开腹并提出结肠显露直肠末端,使用0.1%的BAC浸湿的纱布块将HACE组和HSCR组的大鼠直肠末端紧贴肠壁包绕一周(被包绕的肠管长度为2 cm),每5 min滴加10滴0.1% BAC溶液于纱布块上,保持湿润,作用45 min后移除纱布,温盐水冲洗腹腔至清亮后关腹。对照组用9 g/L的生理盐水代替BAC浸润肠壁。处理完成后的大鼠继续保持喂养,每日观察一般情况及排便情况。
分别于造模后的第一、三、五、七周记录大鼠的排便以及腹胀情况,每个时间点分别取2只大鼠处死后用以鉴定模型的成模情况。以HAEC组出现腹胀、稀便、大便检查镜下见白细胞、直肠末端神经节细胞基本消失和肠道在形态上出现狭窄以及肠道黏膜呈炎性改变作为成模标志。
处死2只大鼠以观察经处理后的肠段有无狭窄和近端结肠有无扩张,取其近端结肠组织,剪碎后快速冰冻,加入PBS,离心20 min(离心半径为10 cm,转速为3 000转/min),取上清液,参照MPO试剂盒的方法检测近端结肠组织匀浆中的MPO活性。
每组使用随机数字表法抽取2只大鼠,取经BAC或生理盐水处理段直肠进行病理学检查,对石蜡包埋好的结肠组织进行连续切片、脱蜡、水洗和染色;光学显微镜下(×100、×400)观察肌间和黏膜下神经丛形态和结构。
每组分别于造模后的第一、三、五、七周按照随机数字表法抽取2只大鼠处死,取经BAC或生理盐水处理段直肠,冲洗粪便及血液,放入冻存管,置于液氮中快速冷冻,-80℃冰箱保存。参照试剂盒说明书进行操作(中国大连TaKaRa公司RNAiso Reagent),提取总RNA。随机引物法合成cDNA,AchE上游引物:5’-GACTGCCTTTATCTTAATGTG-3’,下游引物:5’-CGGCTGAGATGAGAGATTCATTG-3’;GDNF上游引物:5’-TCCTGACCAGTTTGATGACG-3,下游引物:5’-CTCTGCGACCTTTCCCTCT-3’;反应条件为95℃预变性30 s、95℃ PCR反应5 s,60℃PCR反应30 s,循环40次;50℃~95℃测溶解曲线30 s,循环81次。按照说明(SYBRⓇ Premix Ex Taq™ Ⅱ)取逆转录后的cDNA样本,按照1∶10的稀释倍数分别配置5个稀释浓度梯度以获得AchE和GDNF基因的标准曲线,用来判断相应的扩增效率和引物反应性。分别测定每个样本及其复管AchE、GDNF基因扩增的Ct值,计算基因在该样本中的相对定量2-ddCt值。
分别在造模后的第一、三、五、七周于每组抽取2只大鼠进行处死,取BAC或生理盐水处理段近端约1 cm处的肠壁组织,进行病理学检查,对石蜡包埋好的结肠组织进行连续切片、脱蜡、水洗和染色。以HAEC组的直肠末端神经节细胞基本消失和肠道在形态上出现狭窄以及肠道黏膜的炎性改变作为成模标志。
造模后第五周每组抽取2只大鼠处死后收集小肠、横结肠、直肠内的粪便,提取粪便中的DNA的方法参照Muyzer等[6]的方法,提取粪便菌群总DNA。PCR扩增:以16S rRNA基因的V1-V3区序列为靶目标,扩增肠道菌群DNA。设计V1-V3区引物扩增序列,肠道菌群扩增片段为528 bp:上游引物(27F 5’-CCTATCCCCTGTGTGCCTTGGCAGTCTCAG-3’),下游引物(533R 5’-CCATCTCATCCCTGCGTGTCTCCGACTCAGNN-3’);PCR反应体系:1 μl DNA模板、V1-V3区上下游引物各0.5 μl、12.5 μl 2×Power Taq PCR MasterMix(北京百泰克生物技术有限公司)加去离子水补充到25 μl。PCR反应条件为:94℃、5 min预变性;在94℃、30 s,56℃、30 s和72℃、1 min的条件下各30个循环PCR反应;72℃、8 min溶解曲线分析。PCR完成后,用1.0%琼脂糖凝胶电泳检测产物的完整性,-20℃保存备用。参照Muyzer等[6]的方法,对16S rRNA的V1-V3区序列扩增产物进行DGGE电泳并于2%琼脂糖凝胶电泳切胶回收。采用AxyPreDNA凝胶回收试剂盒回收PCR产物。采用二代高通道测序平台Illumina Miseq进行测序。根据Barcode区分每个样本,得到有效序列,对有效序列进行OUT聚类分析和物种分类学分析。
运用SPSS19.0统计学软件进行统计学分析,计量资料用Mean±SD表示,采用非参数检验,组间比较单因素的方差分析,P<0.05为差异具有统计学意义。
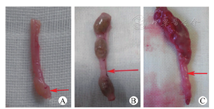
本研究包括120只SD大鼠,对照组40只,3只术中麻醉过量死亡,37只存活;HSCR组40只,3只术中死亡,37只存活;HAEC组40只,3只术中死亡,5只术后6~7周腹泻脱水死亡,4只腹胀死亡,28只存活。术后第五周HSCR组大鼠出现轻微腹胀和排便减少,HAEC组大鼠的腹胀较HSCR组严重,部分大鼠排便次数减少,部分排便呈稀便,大便中见大量白细胞,解剖HAEC组大鼠见BAC处理段直肠狭窄和近端肠管扩张;第七周HSCR组和HAEC组明显腹胀、稀便、部分有血便,解剖发现HSCR组和HAEC组经BAC处理段直肠狭窄痉挛,病变近端肠管扩张明显(图1)。对照组在各时间点肠管无明显变化。

第五周,HAEC组结肠组织MPO活性(10.4±0.43)明显高于HSCR组(7.6±0.35)及对照组(2.8±0.16)(P<0.05);第七周,HAEC组(13.2±0.56)与HSCR组(11.2±0.35)的MPO活性之间的差异无统计学意义(P>0.05)(图2)。
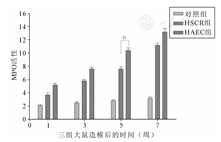

注:a,P<0.05
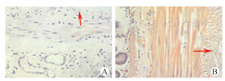
HE染色结果显示第五、七周HSCR和HAEC组肠壁肌间及黏膜下神经节细胞基本消失,镜下未见明显神经节结构,肠壁其他结构完整未见瘢痕形成,第七周在HAEC组见少量炎性细胞浸润(图3)。

第一、三、五、七周,HSCR组直肠末段AchE mRNA表达分别为1.12±0.12、0.98±0.16、0.74±0.09和0.55±0.11,HAEC组的表达分别为1.23±0.08、0.80±0.14、0.67±0.03和0.46±0.13;HSCR组直肠末段GDNF mRNA表达分别为0.73±0.08、0.61±0.11、0.47±0.12和0.40±0.22,HAEC组的表达分别为0.82±0.05、0.64±0.11、0.51±0.06和0.31±0.09。HSCR组和HAEC组大鼠AchE mRNA和GDNF mRNA的表达随着经BAC处理后时间的延长而下降,在第五、七周两组的表达比对照组低(P<0.05),HSCR组和HAEC组之间的差异各时间点无统计学意义(P>0.05)。
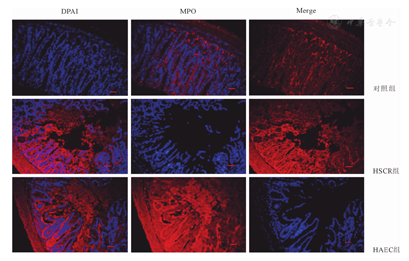
第五周,用HE染色检测肠道炎症情况。光镜下见对照组腺管排列整齐,无炎症细胞浸润和组织坏死;HSCR组见少量炎症细胞浸润,但腺管排列整齐,无组织坏死及脓肿形成;HAEC组呈典型小肠结肠炎改变,表现为黏膜结构明显损伤、黏膜广泛糜烂、肠壁黏膜脓肿形成、腺管排列紊乱、大量炎症细胞浸润,部分标本见组织坏死。MPO分析免疫荧光染色发现HAEC组的炎症程度高于HSCR组及对照组(图4)。

第五周,借助微生物分类数据库(Ribosomal Database Project Classifier)[7]对比微生物的16S rRNA基因组,发现在大鼠肠道的不同部位肠道菌群分布不同,共发现27个种属,在HAEC组中肠杆菌科分布最高,分别在直肠、横结肠、小肠中占比34.7%、22.8%、17.3%,其次为梭菌目,分别在直肠、横结肠、小肠中占比10.4%、12.4%、8.7%,粪杆菌属分别占比8.6%、7.9%、6.9%,梭杆菌属分别占比5.6%、3.8%、7.6%,克雷伯菌属分别占比7.1%、3.1%、4.9%。在HD组中乳杆菌目占比最高,分别在直肠、横结肠、小肠中占比5.7%、9.4%、14.5%,其次为拟杆菌类,分别占比6.3%、9.4%、12.6%,肠杆菌科占比7.1%、6.3%、4.3%,梭菌属4.6%、5.2%、6.4%。正常对照组中乳杆菌目占比最高,分别在直肠、横结肠、小肠中占比15.4%、13.3%、21.6%,其次为拟杆菌类分别占比12.4%、16.2%、16.1%,双歧杆菌占比11.9%、13.2%、14.3%,放线菌属11.6%、8.4%、16.2%。
对HAEC发病机制的深入研究是很有必要的,HAEC是在HSCR的基础上由肠黏膜屏障破坏,肠道致病微生物大量繁殖所导致的[8,9,10]。Sato等[11]在1978年首先报道了利用BAC成功建立大鼠HSCR动物模型,现被广泛用于去神经方面的研究。目前已有大量文献报道BAC运用在建立HSCR动物模型的可靠性[12,13,14]。
HAEC的特征性改变是急性炎症对肠黏膜上皮的损伤,随着对肠道微生物的研究进展,发现粪便潴留导致肠道致病微生物过度繁殖也是导致HAEC发病的一个重要因素[15]。有研究报道通过对基因敲除内皮素受体-β的小鼠的研究认为梭状杆菌和芽孢杆菌与HAEC的发生有关,同时乳酸杆菌属的大量减少导致肠道金黄色葡萄球菌的大量繁殖,从而引起HAEC的发生[16];进一步分类分析发现拟杆菌门、变形菌门减少的同时厚壁菌门增多[17]。但是具体是由哪种微生物导致HAEC发病,目前并不清楚。大家比较认同的是单一的某种细菌感染不能解释小肠结肠炎的发生发展,而肠道微生物组成结构的改变是发生小肠结肠炎的主要因素[18]。目前大量文献报道16S rRNA基因是细菌编码rRNA相对应的DNA序列,存在于所有细菌基因组中,16S rRNA具有高度保守性及特异性,16S rRNA基因检测技术已成为病原菌检测和鉴定的一种强有力工具[19]。本研究通过高通道16S rRNA测序的方法发现梭菌目和克雷伯菌属在HAEC组增多,推测可能与HAEC的发生有关;肠杆菌科在HAEC组明显多于HSCR组与术前灌胃大肠杆菌有关系,大肠杆菌可加重肠道的炎症反应,诱导肠炎的形成,具有良好的模型塑造作用,可缩短HAEC的造型时间,提高模型稳定性;同时发现益生菌如乳杆菌目、拟杆菌门含量明显减少,与许多对于HAEC患儿大便菌群进行的研究结果相符。
综上所述,本研究采用灌胃大肠杆菌JM83联合开腹后BAC包绕直肠制作HAEC大鼠模型,与HAEC患儿在临床症状、病理学检查、肠道菌群变化等方面具有相似的表现和结果。模型具有稳定性高、易于操作和大鼠存活时间长等优点。为深入研究HAEC的发病机制和分子生物学机制提供了可靠的模型基础。
所有作者均声明不存在利益冲突



























