
探讨儿科重症监护病房肺出血的流行病学及临床特点。
回顾性分析2008年1月至2017年9月中国医科大学附属盛京医院小儿重症监护病房收治所有肺出血患儿的发病率、原发病、临床表现、不同原发病导致肺出血的临床特点。
研究期间共有82例符合肺出血诊断标准,同期住院12 440例,肺出血发病率为0.66%。其中9例因资料不全未纳入分析,73例肺出血患儿中,男39例(53.4%),女34例(46.6%);年龄31(5,72)个月;14例好转出院(19.2%),17例在院死亡(23.3%),42例中途退出治疗。引起肺出血的原发疾病为重度心力衰竭17例(23.3%),急性呼吸窘迫综合征(ARDS)12例(16.4%),重度脓毒症10例(13.7%),血液系统疾病10例(13.7%),颅内出血5例(6.8%),心跳呼吸骤停5例(6.8%),凝血功能障碍5例(6.8%),肾脏系统疾病3例(4.2%),其他疾病6例(8.3%)。肺出血患儿中,73例出现呼吸困难、肺部湿啰音、血氧饱和度下降,43.8%(32/73例)合并出血倾向,49.3%(36/73例)合并休克,12.3%(9/73例)出现抽搐,64.4%(47/73例)需心肺复苏。ARDS组的呼气终末正压为(10.2±2.4 )cmH2O(1 cmH2O=0.098 kPa),高于其他组(F=4.59,P<0.01)、吸入氧体积分数为(0.9±0.1)%,高于其他组(F=3.16,P<0.01);重度脓毒症组国际标准化比值为1.9±0.7,高于其他组(F=2.96,P<0.01);血液系统疾病的血小板为(52.0±46.8)×109/L,低于其他组(F=8.23,P<0.01);血红蛋白为(81.6±15.6) g/L,低于其他组(F=5.48,P<0.01)。61例胸部平片提示双肺透过度减低、多发渗出性病变,5例双肺纹理增强。
肺出血是多种疾病的并发症,重度心力衰竭、ARDS、重度脓毒症、血液系统疾病是重症监护病房中肺出血的前4位原发病,不同病因导致肺出血的特点不同,对于存在出血倾向、肺部浸润患儿出现不明原因的心率增快、呼吸困难、肺部湿啰音,需高度警惕肺出血。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肺出血是由于肺泡腔、气管、支气管腔出血导致的急性呼吸道出血性疾病,临床表现为大量咯血或肺泡出血综合征,常见于危重症手足口病并神经源性肺水肿、抗中性粒细胞胞质抗体(antineutrophil cytoplasmic antibodies,ANCA)相关性血管炎、系统性红斑狼疮、严重脓毒症休克、嗜血细胞综合征等疾病,病情进展迅猛、病死率高,是儿童重症监护病房(PICU)中较为凶险的致命并发症。肺出血发病隐匿,早期无特异性临床表现,虽经机械通气等综合治疗,病死率仍较高,所以早期识别、对因治疗成为治疗肺出血的关键。目前针对新生儿肺出血的研究较多,缺氧、酸中毒、严重脓毒症、弥散性血管内凝血、心力衰竭是造成新生儿肺出血的常见危险因素[1]。但对非新生儿期儿童的研究较少,本研究对2008年1月至2017年9月中国医科大学附属盛京医院PICU收治的73例儿童肺出血病例进行回顾性分析,研究造成肺出血的流行病学及不同病因导致肺出血的临床特点,以期为临床诊治提供参考。
选取2008年1月至2017年9月中国医科大学附属盛京医院PICU收治的所有符合肺出血诊断标准[2]患儿。排除标准:排除临床资料不全病例。本研究通过医院医学伦理委员会批准(2019PS442K),患儿监护人均知情同意,并签署知情同意书。
参照肺出血诊断标准[2]:(1)年龄>28 d,<14岁;(2)经气管插管,导管内可见鲜血明确诊断的病例。
一般资料包括性别、年龄、原发病及转归,肺出血前的临床表现及实验室检查结果,呼吸机参数包括吸气峰压(PIP)、呼气末正压(PEEP)、呼吸频率、吸入氧体积分数。病原学包括外周血细菌培养、痰细菌培养结果。影像学为肺出血后2 h内床旁胸片或胸部CT结果。
根据导致肺出血的原发病进行分组,统计各组人数、百分比。统计并比较对发病率在前4位原发病的凝血酶原时间(PT)、活化部分凝血酶时间(APTT)、国际标准化比值(INR)、白细胞、血红蛋白、血小板、PIP、PEEP、呼吸频率、吸入氧体积分数差异是否有统计学意义。
除原发病的治疗及抢救外,所有肺出血患儿均应用呼吸机(常频呼吸机、高频呼吸机)正压通气。呼吸机模式为双水平呼吸道内正压模式。1例H1N1患者给予体外膜肺(ECMO)治疗。所有患儿均分别应用咪达唑仑、苯巴比妥、水合氯醛、盐酸右美托咪定等镇静、镇痛,必要时使用顺苯磺酸阿曲库铵。采用密闭式吸痰方式减少吸痰刺激,出血严重者避免频繁呼吸道吸引。应用维生素K、酚磺乙胺、白眉蛇毒血凝酶对症止血,输注血浆、冷沉淀改善凝血功能,血小板降低的患儿给予间断补充血小板。根据血培养、痰培养及导管培养选用敏感抗生素。
运用Excel建立数据库,采用SPSS 17.0软件进行数据处理。计数资料以例(%)表示,计量资料符合正态分布的以 ±s表示,不符合正态分布的以中位数(P25,P75)表示,符合正态分布的计量资料多组间比较采用方差分析,P<0.05为差异有统计学意义。
±s表示,不符合正态分布的以中位数(P25,P75)表示,符合正态分布的计量资料多组间比较采用方差分析,P<0.05为差异有统计学意义。
2008年1月至2017年9月PICU共有肺出血患儿82例,同期住院12 440例,肺出血发病率为0.66%,其中9例因资料不全未纳入分析,纳入分析的共有73例。其中男39例(53.4%),女34例(46.6%);年龄31(5,72)个月,14例好转出院(19.2%),17例在院死亡(23.3%),42例由于个人原因中途退出治疗。退出治疗患儿原发病包括心力衰竭9例(左向右分流型先天性心脏病7例、暴发性心肌炎2例)、重度脓毒症7例、急性呼吸窘迫综合征(ARDS)5例(急性重型支气管肺炎2例、严重脓毒症2例、酮症酸中毒1例)、颅内出血5例(颅脑外伤3例、维生素K缺乏颅内出血1例、颅内感染1例)、白血病4例、心跳呼吸骤停3例、凝血功能异常3例(3例均为肝衰竭)、噬血细胞综合征2例、肾病综合征1例、其他疾病3例(甲基丙二酸血症1例、重度一氧化碳中毒1例、重症肌无力1例)。73例患儿肺出血时均出现呼吸困难、肺部湿啰音、血氧饱和度下降至90%以下,32例患儿(43.8%)胃管内可抽出咖啡样物或口鼻出血,36例患儿(49.3%)合并休克,9例患儿(12.3%)出现抽搐,47例患儿(64.4%)需接受心肺复苏治疗,57例患儿(78.1%)并低血压,见表1。

重症监护病房肺出血患儿73例病因
Etiology of pulmonary hemorrhage in 73 children in pedia-tric intensive care unit
重症监护病房肺出血患儿73例病因
Etiology of pulmonary hemorrhage in 73 children in pedia-tric intensive care unit
| 原发病 | 例数(%) | 病因 |
|---|---|---|
| 重度心力衰竭 | 17(23.3) | 左向右分流型先天性心脏病10例, |
| 暴发性心肌炎6例,心律失常1例 | ||
| 急性呼吸窘迫综合征 | 12(16.4) | 重型麻疹肺炎2例、重度脓毒症10例 |
| 血液系统疾病 | 10(13.7) | 早幼粒细胞白血病2例、急性淋巴细胞白血病L2型2例、急性髓系白血病M3b型1例、噬血细胞综合征3例,6例肺出血前接受系统化疗治疗,化疗后4(3,12)d出现肺出血 |
| 重度脓毒症 | 10(13.7) | |
| 颅内出血 | 5(6.8) | 颅脑外伤3例、维生素K缺乏颅内出血1例、颅内感染1例 |
| 心跳呼吸骤停 | 5(6.8) | |
| 凝血功能障碍 | 5(6.8) | 急性肝衰竭4例、甲型血友病1例 |
| 肾脏系统疾病 | 3(4.2) | 肾病综合征并无尿2例 |
| 溶血尿毒综合征1例 | ||
| 其他疾病 | 6(8.3) | 重型手足口病1例、甲基丙二酸血症1例、儿童哮喘重度发作1例、肺动静脉畸形1例、重度一氧化碳中毒1例、重症肌无力1例 |
血常规:血红蛋白(102.1±25.3) g/L、血小板(202.3±164.8)×109/L。凝血指标:PT(18.3±9.9) s、APTT(41.5±17.4) s、INR(1.8±1.7)。心肌标志物:肌酸激酶同工酶质量浓度172.6(25,97)U/L。
PIP (28.3±4.5) cmH2O(1 cmH2O=0.098 kPa)、PEEP (8.0±2.5) cmH2O、呼吸频率(28±4.2)次/min、吸入氧体积分数(0.8±0.2)%。
血培养阳性9例(12.3%),包括肺炎链球菌1例、溶血性葡萄球菌1例、唾液链球菌1例、表皮葡萄球菌1例、鲍曼不动杆菌2例、大肠杆菌2例、肺炎克雷伯杆菌2例、铜绿假单胞菌2例、葱头假单胞菌1例、弗氏柠檬酸杆菌1例。痰细菌培养阳性10例(13.7%),包括肺炎克雷伯杆菌5例、鲍曼不动杆菌4例、嗜麦芽杆菌1例、大肠埃希菌1例、铜绿假单胞菌1例、葱头假单胞菌1例、嗜麦芽寡氧单胞菌1例、烟曲霉菌1例、白色念珠菌1例。
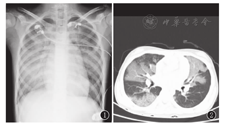
73例患儿中,66例肺出血后2 h内完善床旁胸片或CT。61例胸部平片提示双肺透过度减低、多发渗出性病变(其中4例并胸腔积液,2例并气胸,5例高密度斑片影以左肺为主,4例高密度斑片影以右肺为主)。5例双肺纹理增强。图1为1例暴发性心肌炎并肺出血胸片,图2为相同患者的CT。

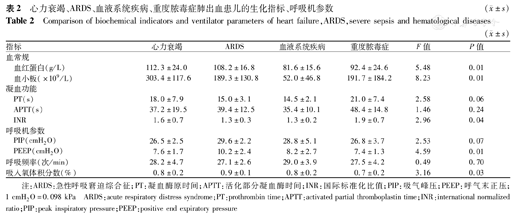
ARDS组的PEEP、吸入氧体积分数高于其他组(均P<0.01);重度脓毒症组INF高于其他组(P<0.01);血液系统疾病的血小板、血红蛋白低于其他组(均P<0.01)(表2)。
心力衰竭、ARDS、血液系统疾病、重度脓毒症肺出血患儿的生化指标、呼吸机参数( ±s)
±s)
Comparison of biochemical indicators and ventilator parameters of heart failure,ARDS,severe sepsis and hematological diseases( ±s)
±s)
心力衰竭、ARDS、血液系统疾病、重度脓毒症肺出血患儿的生化指标、呼吸机参数( ±s)
±s)
Comparison of biochemical indicators and ventilator parameters of heart failure,ARDS,severe sepsis and hematological diseases( ±s)
±s)
| 指标 | 心力衰竭 | ARDS | 血液系统疾病 | 重度脓毒症 | F值 | P值 | |
|---|---|---|---|---|---|---|---|
| 血常规 | |||||||
| 血红蛋白(g/L) | 112.3±24.0 | 108.2±16.8 | 81.6±15.6 | 92.4±24.6 | 5.48 | 0.01 | |
| 血小板(×109/L) | 303.4±117.6 | 189.3±130.8 | 52.0±46.8 | 191.7±184.2 | 8.23 | 0.01 | |
| 凝血功能 | |||||||
| PT(s) | 18.0±7.9 | 15.0±3.1 | 14.5±2.1 | 21.0±7.4 | 2.58 | 0.06 | |
| APTT(s) | 37.2±19.5 | 39.4±12.5 | 35.4±10.1 | 48.4±14.8 | 1.46 | 0.24 | |
| INR | 1.6±0.7 | 1.3±0.3 | 1.3±0.2 | 1.9±0.7 | 2.96 | 0.04 | |
| 呼吸机参数 | |||||||
| PIP(cmH2O) | 26.5±2.5 | 29.6±2.2 | 28.8±5.1 | 26.8±3.7 | 2.53 | 0.07 | |
| PEEP(cmH2O) | 7.6±1.7 | 10.2±2.4 | 8.2±2.7 | 7.4±1.3 | 4.59 | 0.01 | |
| 呼吸频率(次/min) | 28.2±4.7 | 27.1±2.6 | 29.0±3.9 | 27.5±4.2 | 0.49 | 0.70 | |
| 吸入氧体积分数(%) | 0.8±0.2 | 0.9±0.1 | 0.8±0.2 | 0.7±0.2 | 3.16 | 0.03 | |
注:ARDS:急性呼吸窘迫综合征;PT:凝血酶原时间;APTT:活化部分凝血酶时间;INR:国际标准化比值;PIP:吸气峰压;PEEP:呼气末正压;1 cmH2O=0.098 kPa ARDS:acute respiratory distress syndrome;PT:prothrombin time;APTT:activated partial thromboplastin time;INR:international normalized ratio;PIP:peak inspiratory pressure;PEEP:positive end expiratory pressure
肺出血常是某些疾病的终末期表现,是由于肺泡毛细血管内皮细胞损伤和肺泡炎症导致肺泡腔内广泛出血的急性出血性疾病,常表现为突然出现的呼吸困难、发绀、肺部湿啰音增多,多伴口、鼻或气管插管内溢出血性液体,起病突然、来势凶险,虽然发生率不高,但病死率高达33%~80%,预后较差[3]。本研究中23.3%的患儿在院死亡,仅有19.2%好转出院。常见肺出血的病因包括ANCA相关性血管炎、系统性红斑狼疮、白血病、重度脓毒症、凝血功能障碍、心力衰竭、肺动脉高压、肺动静脉畸形、ARDS、免疫缺陷、重症手足口病等疾病[4,5,6,7]。本中心造成肺出血发病率前4位原发病为重度心力衰竭(23.3%)、ARDS(16.4%)、血液系统疾病(13.7%)、重度脓毒症(13.7%),占肺出血总数的67.1%,是导致肺出血的主要疾病。不同时间、不同中心报道的肺出血的病因不同。有研究发现先天性心脏病、白血病、严重脓毒症在儿童肺出血中的发病率较高,其中肺出血原发病为先天性心脏病的发生率达到36.6%[3,8]。本中心引起肺出血的首位因素为重度心力衰竭,包括左向右分流型先天性心脏病10例、暴发性心肌炎6例。本研究所有先天性心脏病患儿均为左向右分流型心脏病并重度心力衰竭,心室收缩力降低易导致肺间质和肺泡渗出增多,从而引起肺出血[9]。暴发性心肌炎入院时常并心源性休克、心跳呼吸骤停而需要心肺复苏,复苏时间越长,心外按压对心肺造成的附加损伤越重,引起心肌损伤、肋骨骨折、肺组织挫裂而造成肺出血[10]。所以对于严重心功能异常需心肺复苏的患儿,在复苏过程中需要密切注意致死性肺出血的发生。
白血病患儿常并多种导致肺出血的高危因素,如高白细胞状态、白细胞溶解、化疗药物、严重多重感染、血小板减少等,白血病患儿肺浸润发生率为29%~62%,病死率高达50%[11,12,13,14,15]。本中心血液系统疾病患儿共10例,其中6例接受系统化疗,化疗可以引起肺泡毛细血管内皮损伤、白血病细胞破坏及炎性因子释放导致肺出血。有研究发现,急性髓性白血病患者化疗期间,8%的患者在化疗后的2周内出现呼吸衰竭,病死率高达73%[16]。白血病化疗后肺出血一般出现在化疗后6~16 d,本研究中白血病患儿发生肺出血的时间为化疗诱导治疗后4(3,12)d,早于报道发生时间[17]。真菌可以侵袭肺泡腔内血管,释放具有溶血性质的真菌内毒素,导致肺组织损伤、出血、血栓形成和血行传播,常发生在中性粒细胞减少的骨髓抑制期和化疗诱导期[18]。由于化疗导致的免疫抑制和高级抗生素治疗,侵袭性肺曲霉菌、肺炎链球菌、大肠杆菌和铜绿假单胞菌是白血病化疗诱导、巩固期间常见感染病原,本研究中痰细菌培养可见烟曲霉菌、白色念珠菌生长[19]。此外,白血病患儿常伴有血小板降低,虽经过积极治疗原发病、补充血小板,但血小板降低发生率仍较高,导致血液凝集过程异常,在其他肺出血因素的共同作用下,易引发威胁生命的肺部出血。所以,对于高白细胞、化疗、严重多重感染、血小板降低的白血病患儿需要注意在治疗过程中出现危及生命的出血风险。
不同病因导致的肺出血生化指标、呼吸机参数各有不同。ARDS并发弥散性肺泡出血后通换气功能明显下降,肺部氧合能力明显降低,较其他组患儿需要更高的呼吸机参数维持正常机体氧合功能。重度脓毒症休克患儿存在明显的出血倾向,如皮肤出血点、消化道咖啡样物、黑便、血尿,肺出血是较为危重的并发症。白血病患儿的血小板较其他组明显降低,存在导致肺出血的高危因素[20]。不同生化指标、呼吸机参数有助于临床辅助判断肺出血病因,当怀疑肺部出血,需要根据血流动力学、凝血过程、感染状态、呼吸机参数、影像学综合判断病因。
对于急性肺出血,治疗目标是稳定和抑制活动性出血,保证呼吸道通畅、有效的肺通气和肺换气是治疗的基础。机械通气期间的PEEP压可产生压塞效应以限制毛细血管出血。早期诊断,早期气管插管是治疗的关键。一旦怀疑肺出血,吸氧不能改善低氧血症时应早期行气管插管、机械通气,在保持呼吸道通畅的前提下,尽量避免频繁吸痰。严重出血需要输注适量红细胞改善贫血、输注血浆、输注血小板改善凝血功能。除对症治疗外,对因治疗是控制肺出血的关键,也是影响预后的重要因素。如对于先天性心脏病合并心力衰竭患儿,需要限制液体负荷,限制输液速度,改善心功能进而减轻肺出血倾向,对自身免疫性血管炎患儿需使用激素治疗、免疫抑制剂及血浆置换等治疗措施[21]。近年来发现肺内重组因子Ⅶa肺内给药可以改善出血,有助于撤离呼吸机,提高长期生存质量,对儿童肺出血有效、安全[22]。此外,随着ECMO在小儿重症监护病房的普及,应用ECMO对肺出血患儿进行循环、呼吸支持能明显改善机体缺氧状态,对肺出血严重,呼吸机难以维持氧合的病例可采用ECMO作为挽救性治疗,本研究1例H1N1感染并ARDS患儿应用ECMO治疗,机体氧合状态明显改善,但因原发病以及继发感染最终死亡。虽然儿童肺出血原因很多,病死率高,但只要对肺出血的病因适当分类,诊断及时,早期治疗,抢救成功率还是有望提高的。
综上所述,心力衰竭、ARDS、重度脓毒症、白血病是PICU中肺出血的前4位疾病,对于存在出血倾向、肺部浸润的患儿出现突发呼吸困难、肺部湿啰音以及血氧饱和度下降甚至循环衰竭,需高度警惕肺出血,早期诊断并对因治疗。
所有作者均声明不存在利益冲突



























