
贫血是早产儿的常见并发症之一。虽然有多种因素均可导致早产儿贫血(AOP),但促红细胞生成素(EPO)缺乏是AOP的主要病因之一。早产儿体内EPO水平不足及其发生机制是目前国内外AOP相关研究的热点,合理采用EPO进行AOP的防治意义已成国际共识,临床也已获显著疗效。现就近3~5年国内外关于AOP发病机制、EPO与AOP的相关性以及EPO防治AOP的临床应用及疗效等方面的最新进展进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
贫血是早产儿常见并发症之一。胎龄越小,成熟度越低,发生贫血的可能性越大。有关文献报道极低出生体质量儿(VLBWI)极易继发早产儿贫血(AOP)[1,2]。引起AOP的主要原因包括促红细胞生成素(EPO)水平相对不足、医源性失血、体内储存铁不足、生长过速、红细胞寿命短及早产儿造血系统不成熟等,其中EPO产生不足是最主要的病因[1,3,4,5]。多年来,对于严重AOP的主要治疗方法为输注红细胞[6,7],但存在下列风险:(1)病毒、细菌、寄生虫等感染;(2)移植物抗宿主病、输血相关的急性肺损伤等输血相关并发症;(3)电解质紊乱;(4)血型不合和溶血等[7,8]。而EPO可通过正负反馈机制提升血红蛋白(Hb)水平,已成为目前AOP治疗的有效方法[4,9]。现就近3~5年来国内外有关EPO防治AOP的意义、方法及疗效等研究进展进行相关文献综述,为临床诊治AOP提供参考及后续进一步开展AOP相关研究提供理论依据。
AOP的定义为早产儿外周血Hb水平低于同龄儿童正常范围,伴网织红细胞计数减少和循环EPO水平降低[10]。不同于早产儿出生后早期(出生1周后)出现的生理性贫血,AOP属于病理性,贫血出现时间晚,常于出生后3~4周开始,至4~6周达最低值,且程度较重,并可伴相关临床表现[9]。AOP的严重程度与胎龄、出生体质量呈负相关,目前国际推荐的AOP诊断依据包括出生体质量范围、Hb水平和红细胞比容(Hct)等[9,10],见表1。
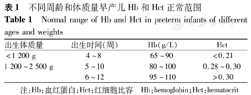
不同周龄和体质量早产儿Hb和Hct正常范围
Normal range of Hb and Hct in preterm infants of different ages and weights
不同周龄和体质量早产儿Hb和Hct正常范围
Normal range of Hb and Hct in preterm infants of different ages and weights
| 出生体质量 | 出生时间(周) | Hb(g/L) | Hct |
|---|---|---|---|
| <1 200 g | 4~8 | 65~90 | <0.21 |
| 1 200~2 500 g | 5~10 | 80~100 | 0.28~0.30 |
| 6~12 | 95~110 | >0.30 |
注:Hb:血红蛋白;Hct:红细胞比容 Hb:hemoglobin;Hct:hematocrit
AOP的主要发病机制[1,2,3,4,11,12]:(1)EPO水平相对不足。胎儿期体内EPO主要由肝脏合成,出生3~4个月逐渐由肝脏过渡到肾脏。因此,早产儿出生后数月内,体内EPO仍主要由肝脏合成,但由于肝脏对于Hb下降和组织缺氧等反馈调节的刺激因素相对不敏感,易导致EPO生成不足,故AOP多见于出生后4~12周,早期主要表现为正细胞性正色素性贫血。(2)胎儿红细胞寿命短。早产儿出生时,胎儿血红蛋白(HbF)可占80%~90%,红细胞生存时间短(40~60 d,而成人为120 d),可导致Hb迅速下降。(3)体内铁储存不足。孕晚期(出生前3个月)是母体经胎盘为胎儿提供储存铁的主要时间段,因早产儿失去了铁储备的关键时期,且在最初的6~8周原先储存的铁会迅速耗尽,而导致缺铁性贫血(IDA),表现为小细胞低色素性贫血。IDA一般于早产儿出生2个月后多见。(4)医源性失血。早产儿出生早期合并症较多,需要更多的监护和治疗,常可因过多实验室采血导致医源性失血。较大样本资料报道显示,住院早产儿每周平均失血量为11~22 mL/kg,相当于总血容量的15%~30%[11]。(5)生长过速。早产儿出生后体格增长速率明显高于足月儿,对红细胞生成的需求较高,更易发生因EPO水平或Hb合成所需营养素绝对或相对缺乏引起的贫血。因为EPO水平不足所致骨髓红系造血下降是AOP的主要病因,所以采用EPO防治AOP具有充分理论依据。对于伴铁缺乏的AOP,可采用EPO联合铁剂治疗。
EPO基因位于7号染色体(g22)长臂中央区域,是促进红系造血的激素类造血生长因子。AOP分子结构为唾液酸糖蛋白,由165个氨基酸残基组成,相对分子质量35 000~39 000[9]。EPO是机体红细胞生成的主要调节物,影响血浆EPO水平的主要因素包括:(1)与Hb水平呈负相关:贫血时EPO的增加促进了红细胞生成,在严重贫血时,血浆中EPO水平可增高约1 000倍。而红细胞数量增多时,EPO分泌则减少。(2)与组织缺氧程度呈正相关:低氧诱导因子(HIF)蛋白在组织缺氧的情况下变得稳定,上调EPO基因,从而促进EPO的产生[7,9,13]。出生后,新生儿从子宫中的相对低氧状态转变为环境相对高氧状态,改善的氧合作用使EPO生成相对减少。且胎龄<30周时,EPO的产生部位主要是在肝脏,由于肝脏对组织缺氧相对不敏感,导致EPO生成减少,从而引起AOP的发生[13]。
目前,已有大量关于临床应用红细胞生成刺激剂(ESA)的报道,其中重组人促红细胞生成素(rHuEPO)是治疗AOP的时间最长、疗效最为确切、技术相对成熟的疗法。临床随机对照试验也已充分显示采用rHuEPO治疗AOP的有效性和安全性[3,4]。目前rHuEPO在AOP中的应用主要具有治疗和预防两方面的意义,但rHuEPO的使用剂量、开始时间及持续时间有待探索和统一。现将近5年国内外有关rHuEPO治疗AOP的研究进行归纳,见表2。

rHuEPO在早产儿贫血中的随机对照研究
A randomized controlled study of rHuEPO in anemia of prematurity
rHuEPO在早产儿贫血中的随机对照研究
A randomized controlled study of rHuEPO in anemia of prematurity
| 作者 | 年份 | GA、BW | 例数 | 剂量(U/kg) | 开始时间 | 持续时间 | 结果 |
|---|---|---|---|---|---|---|---|
| Yasmeen等[7] | 2015 | <1 500 g | 60 | 200 | 第7天开始 | 3次/周,2周 | 联合铁剂、叶酸治疗减少了输血频率及概率 |
| <35周 | |||||||
| <7 d | |||||||
| Qiao等[12] | 2017 | 28~34周 | 96 | 400 | 2次/周,2周 | 早期肠外补铁联合EPO可预防AOP | |
| Lim等[14] | 2017 | <1 500 g | 68 | 250 | 3次/周,6周 | 频繁的给药可使网织红细胞计数上升 | |
| <33周 | 750 | 1次/周,6周 | |||||
| Basiri等[15] | 2015 | <1 500 g | 60 | 250 | 日龄>6 d | 3次/周,3周 | 提高红细胞生成参数水平 |
| 24~31周 |
注:rHuEPO:重组人促红细胞生成素;EPO:促红细胞生成素;AOP:早产儿贫血;GA:胎龄;BW:出生体质量 rHuEPO:recombinant human erythropoietin;EPO:erythropoietin;AOP:anemia of prematurity;GA:gestational age;BW:birth weight
有关rHuEPO在AOP的剂量与疗程目前尚未完全统一。最新版《实用新生儿学》具有精确的剂量推荐,胎龄<30周和出生体质量<1 000 g的早产儿尽早使用750~1 500 IU/(kg·周)rHuEPO,以最大限度减少输血要求[16]。2015年最新版国际指南中指出:rHuEPO治疗AOP的推荐剂量为750 U/kg,皮下注射,每周3次×6周,而开始治疗的最佳时间国际上无明确的定义[17]。但是,2017年的一项研究报道称使用rHuEPO 750 U/kg,皮下注射,每周1次×6周治疗AOP,效果低于250 U/kg,皮下注射,每周3次×6周[14]。此外,也有报道认为可采用大剂量rHuEPO[1 000 U/(kg·次)],不仅有助于促进红系造血,同时具有神经保护作用[4,18]。所以,采用rHuEPO治疗AOP具有充分理论依据,疗效确切,已为国内外指南普遍推荐,但剂量与疗程尚未统一,有待后续研究予以明确和完善。
最新版《实用新生儿学》推荐低于28~32周和出生体质量<1 000 g的早产儿预防性使用rHuEPO,并同时给予铁剂4~8 mg/(kg·d)和摄入足够的蛋白质以获得最佳疗效[16]。文献报道也指出出生体质量<1 000 g的超低出生体质量儿(ELBWI)和孕周<32周的早产儿可使用rHuEPO预防贫血,建议皮下注射每周3~5次,每次250 IU/kg (阿法依泊汀/倍他依泊汀)[9]。使用时间取决于胎龄和临床症状(生长不良,嗜睡或反复发作的呼吸暂停和需氧量增加)[9]。同时,每天需补充元素铁3~5 mg/kg及适量维生素E。研究表明,早期肠外补铁联合EPO可有效预防AOP[12]。国内外研究均表明使用rHuEPO预防AOP有效,但仍需大样本研究以明确使用剂量及疗程[9,12]。
在使用EPO之前,输注红细胞是治疗AOP的主要方法,但输注红细胞存在诸多风险,故现已提出多项措施来减少红细胞输注,包括延迟脐带结扎、挤压脐带血、严格遵守输血指南、减少医源性失血及采用EPO。其中采用EPO进行临床干预为目前国内外研究热点。关于EPO能否减少AOP输血量及频度,已有大量随机对照试验表明,EPO能够显著减少早产儿输血频度和输血量[3],早期使用疗效可能更为显著。例如,Ohlsson和Aher[3]报道指出,早期(出生8 d内)使用EPO(3 643例早产儿)可减少输血频度及输血量,而晚期(出生8~28 d)使用EPO(1 651例早产儿)可减少输血频度,但不会减少输血量[4]。同时因纳入的早产儿有部分在试验之前已接受红细胞输血,因此使用EPO虽然有统计学意义,但临床参考意义可能有限。
目前也已有一些临床证据表明,EPO可减少新生儿其他重要并发症,包括脑室内出血(IVH)、脑室周围白质软化(PVL)和坏死性小肠结肠炎(NEC)[3,4]。且早期使用EPO可降低喂养不耐受的发生率,增强对神经系统的保护和预防NEC。EPO的上述潜在临床效应是否确切及其机制有待进一步研究予以验证。
对于rHuEPO治疗AOP的不良反应在早产儿中报道较少。Aher和Ohlsson[4]指出,成人中报道rHuEPO的不良反应包括高血压、骨痛、皮疹及痉挛,并未在VLBWI中出现。新生儿中只报道了短暂的中性粒细胞减少症的发生。但对于rHuEPO治疗AOP后的并发症研究较多,最常见的是早产儿视网膜病变(ROP)。动物和人类观察研究均支持EPO治疗与ROP发展间的关联。我国一项Meta分析显示,早期使用大剂量rHuEPO增加了ROP的风险[19]。但在2017年Ohlsson和Aher[3]就指出,早期使用EPO(出生8 d内)时,ROP(≥3期)的发生率无显著增加。而Aher和Ohlsson[4]指出,晚期使用EPO(出生8~28 d),会增加ROP(≥3期)的风险。因此,仍需大量随机对照研究来进一步评价rHuEPO对于ROP的安全性。
近年来,长效型ESA(如阿法达贝汀)也已应用于临床研究。阿法达贝汀是在EPO原始蛋白分子结构的基础上,通过修饰5个氨基酸以产生2个额外的碳水化合物结合位点,从而显著增加药物循环半衰期和有效性,是一种新型的长效ESA。达贝汀的血清半衰期较rHuEPO延长约3倍,从而减少用药次数,体内药效也更强[3,4]。2015年关于阿法达贝汀的管理报道显示,5 μg/(kg·次)和10 μg/(kg·次),1周1次,皮下注射,均能减少早产儿的输血次数[20]。但由于阿法达贝汀问世时间有限,其确切疗效与安全性,仍有待于进一步研究和评价。
足月儿体内总铁含量约为75 mg/kg,胎儿体内铁的80%来源于孕晚期,早产儿由于失去了体内储铁的关键时期,其总铁含量、Hb、血清铁及储存铁水平均降低。出生后6~8周,早产儿铁的利用率增加,以及可能的医源性失血,进一步导致铁缺乏[21]。同时,在使用EPO治疗AOP期间,由于红细胞生成和Hb合成增加,体内铁的利用速率增高,可进一步导致体内储存铁(如血清铁蛋白水平)降低。因此在使用EPO治疗AOP的同时需要补充铁剂,推荐剂量范围为元素铁1~10 mg/(kg·d),也有文献推荐剂量为3~5 mg/(kg·d)[3,4]。
综上,EPO产生不足是引起AOP的主要原因之一。目前国际上对于使用ESA防治AOP是否能够减少输血已有大量研究,研究结果均表明使用ESA能有效减少输血频度(平均0.78次)及输血量(6~7 mL/kg)[20]。Aher和Ohlsson[4]指出治疗VLBWI AOP使用的EPO的剂量范围较广[90~1 400 IU/(kg·周)]。在我国使用的rHuEPO剂量范围包含在国际研究范围内。因此,国内参照《实用新生儿学》第4版推荐剂量用以防治AOP是可行的,且能够减少输血频度、输血量。虽然EPO防治AOP的剂量范围已明确,但对于使用EPO的具体剂量、开始时间、持续时间仍无明确的指南。且对于使用EPO的不良反应报道仍较少;其并发症如ROP等也仍存在一系列的争议。相信通过大样本的深入研究,EPO治疗AOP的剂量、疗程、疗效、不良反应及并发症等将能得到更进一步的明确。
所有作者均声明不存在利益冲突



























