
针对一起于2016年6—9月发生在江阴市新桥镇的伤寒疫情开展暴发确认和传播因素分析。首先收集分离自确诊病例的14株伤寒沙门菌;再采集与疫情相关的外环境样本65份和食品样本13份,运用实时荧光PCR法检测样本中伤寒沙门菌特异基因,采用常规分离培养法分离伤寒沙门菌。对所有伤寒沙门菌分离株进行药敏试验及脉冲场凝胶电泳(PFGE)分析。从外环境样本(K熟食店加工厂井水)中分离得到1株伤寒沙门菌。15株伤寒沙门菌均对萘啶酸耐药,经脉冲场凝胶电泳后共获得2种带型,其中13株病例分离株和环境分离株的PFGE指纹图谱完全一致,另外1株病例分离株的PFGE带型存在1个条带的差异。结合流行病学调查和实验室检测结果,判定本次暴发疫情是由同一伤寒沙门菌遗传克隆的传播而导致,食品加工厂应属于是传播环节之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
伤寒是由伤寒沙门菌引起的全身感染性疾病,典型症状为发热、寒战、腹痛和肝脾肿大等[1]。该病主要通过受污染的食物和水传播,世界各地均有伤寒病例报道,但暴发和流行多集中在发展中国家卫生条件较差的地区[2,3,4]。中国云南、广西、贵州为疫情高发省份[5,6,7],近年来江苏伤寒发病率呈上升趋势[8],部分地区伤寒疫情时有发生。2016年6月起,江阴市多镇出现伤寒病例,主要症状为发热、畏寒、头痛、呕吐、腹泻、肝脾肿大等,病例呈现时空聚集性[9]。其中新桥镇发病明显增多,通过病例对照研究结果显示,新桥菜场购买的熟食、蔬菜感染风险高[8]。无锡市疾病预防控制中心进一步针对新桥镇疫情,通过流行病学调查分析,采集相关食品标本、外环境标本和分离自病例的伤寒沙门菌送至中心实验室开展病原学检测和脉冲场凝胶电泳(pulsed field gel electrophoresis,PFGE)分析。现将相关情况报告如下。
14株伤寒沙门菌菌株分离自疫情期间确诊的伤寒病例,病例发病时间从2016年6月2日至8月20日,其中包括首发病例,主要分布于新桥镇(8例)、华士镇(3例)、顾山镇(1例)和城区(2例)。详见表1。
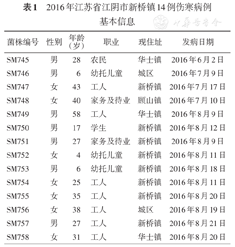
2016年江苏省江阴市新桥镇14例伤寒病例基本信息
2016年江苏省江阴市新桥镇14例伤寒病例基本信息
| 菌株编号 | 性别 | 年龄(岁) | 职业 | 现住址 | 发病日期 |
|---|---|---|---|---|---|
| SM745 | 男 | 28 | 农民 | 华士镇 | 2016年6月2日 |
| SM746 | 男 | 6 | 幼托儿童 | 城区 | 2016年7月9日 |
| SM747 | 女 | 43 | 工人 | 新桥镇 | 2016年7月17日 |
| SM748 | 女 | 40 | 家务及待业 | 顾山镇 | 2016年7月10日 |
| SM749 | 男 | 58 | 工人 | 华士镇 | 2016年8月9日 |
| SM750 | 男 | 17 | 学生 | 新桥镇 | 2016年8月12日 |
| SM751 | 男 | 27 | 家务及待业 | 新桥镇 | 2016年8月9日 |
| SM752 | 女 | 4 | 幼托儿童 | 新桥镇 | 2016年8月11日 |
| SM753 | 男 | 6 | 幼托儿童 | 新桥镇 | 2016年8月18日 |
| SM754 | 女 | 25 | 工人 | 新桥镇 | 2016年8月11日 |
| SM755 | 女 | 35 | 工人 | 新桥镇 | 2016年8月20日 |
| SM756 | 女 | 38 | 工人 | 城区 | 2016年8月19日 |
| SM757 | 男 | 27 | 工人 | 新桥镇 | 2016年8月21日 |
| SM758 | 女 | 31 | 工人 | 华士镇 | 2016年8月20日 |
于2016年9月20—27日,采集食品样本13份,主要为新桥镇菜场在售蔬菜;采集外环境样本65份,包括病例就诊医院的污水(8份);病例家化粪池水(2份),及其周边井水(8份);熟食加工厂井水(1份),及其周边池塘水(2份)、沟渠水(1份)、河水(3份)、井水(5份)和化粪池水(1份);W熟食店加工厂井水(1份)和化粪池水(1份),及其附近池塘水(4份)、沟渠水(2份)、河水(2份)、井水(3份)和化粪池水(1份);新桥菜场自来水(2份)和下水沟污水(1份);新桥镇蔬菜种植地附近池塘水(4份)、河水(9份)、化粪池水(3份)和鸡鸭粪便(1份)。
(1)试剂:沙门菌显色培养基、Swarm Agar购自上海科玛嘉公司;亚硒酸盐胱氨酸增菌液(selenite cystine broth,SC)、脑心浸液肉汤(brain heart infusion broth,BHI)、Mueller-Hinton(M-H)琼脂购自北京陆桥技术有限公司;沙门菌诊断血清购自丹麦SSI公司;GN鉴定卡购自法国生物梅里埃公司;药敏纸片购自英国Oxoid公司;核酸提取试剂盒MagNA Pure LC Total Nucleic Acid isolation Kit购自瑞士Roche公司;荧光定量试剂盒Premix Ex Taq、限制性内切酶Xba Ⅰ、蛋白酶K购自大连宝生物公司;琼脂糖Seakem Glod Agarose购自美国Lonza公司。(2)仪器:VITEK 2 Compact全自动微生物鉴定仪购自法国梅里埃公司;全自动核酸分离纯化及加样系统(MagNA Pure LC 2.0)购自瑞士Roche公司;ABI 7500荧光定量PCR仪购自美国ABI公司;CHEF Mapper脉冲场凝胶电泳仪、Gel Doc XR凝胶成像仪购自美国Bio-Rad公司。
(1)食品样本:按照《食品安全国家标准食品微生物学检验沙门氏菌检验》(GB4789.4-2010)[10]无菌操作取待检样本25 g,接种至225 ml SC增菌液,于37 ℃,150 r/min振荡培养4 h。取增菌液1.5 ml,13 000×g离心5 min,弃上清,沉淀加入300 μl生理盐水悬浮,采用核酸提取试剂盒提取核酸。(2)外环境样本:水样取500 ml,6 600×g离心20 min,弃上清,取带沉淀的水样5 ml左右,转种至50 ml SC增菌液,于37 ℃,150 r/min振荡培养4 h。粪便样本取10 g用10 ml生理盐水洗涤,取悬液5 ml转种至50 ml SC增菌液,于37 ℃,150 r/min振荡培养4 h。取上述富集的培养液1.5 ml,13 000×g离心5 min,沉淀加入300 μl生理盐水悬浮,采用核酸提取试剂盒提取核酸。上述核酸模板按文献[11]中方法,进行伤寒沙门菌和甲型副伤寒沙门菌特有基因的检测。反应体系(20 μl):2×Premix Ex 10 μl,引物ST71-F、ST71-R各2 pmol,ST71-p 1 pmol,引物SPA-F、SPA-R各2 pmol,SPA-P 2 pmol,模板2 μl。反应条件:95 ℃ 30 s;95 ℃ 5 s,65 ℃ 25 s,共40循环,每个循环末端检测荧光。PCR检测阳性标本进一步参照《食品安全国家标准食品微生物学检验沙门氏菌检验》(GB4789.4-2010)[10]进行沙门菌的分离鉴定。
参照2013年美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)发布的抗菌药物敏感性试验执行标准[12],采用K-B纸片扩散法进行伤寒沙门菌药物敏感性试验,质控菌株为大肠埃希菌ATCC25922(美国典型培养物保藏中心)。抗生素包括氨苄西林(mpicillin,AMP)、阿莫西林/克拉维酸(amoxicillin/clavulanic acid,AMC)、头孢噻呋(ceftiofur,CEF)、萘啶酸(nalidixic acid,NAL)、环丙沙星(ciprofloxacin,CIP)、四环素(tetracycline,TET)、磺胺甲恶唑/甲氧苄啶(trimethoprim/Sulfamethoxazole,SXT)、氯霉素(chloromycetin,CHL)、庆大霉素(gentamicin,GEN)和链霉素(streptomycin,STR)。
参照PulseNet China分子分型网络中沙门菌PFGE标准操作程序[6],对15株伤寒沙门菌进行分子分型。选用沙门菌标准株H9812为相对分子质量标记,使用限制性内切酶Xba Ⅰ,置于37 ℃酶切2 h。电泳参数:2.16~63.8 s,电泳时间18.5 h。用BioNumerics 6.0软件对15株菌的电泳图谱进行数据分析,同时在PulseNet China数据库中与江苏省历年分离的伤寒沙门菌带型进行比对,并绘制聚类分析树状图。聚类算法选择非加权组平均法,电泳条带位置优化值1.5%,相似度100%判定为同一PFGE带型。
78份样本增菌液均检测出了STY1633基因,CT值小于30,其余标本中未检测到荧光信号。PCR阳性样本经进一步分离培养、生化鉴定和血清分型,检出并分离出1株伤寒沙门菌。
15株伤寒沙门菌对AMC、CEF、SMZ、CHL和STR敏感率为100.0%,所有菌株均对第一代喹诺酮类抗生素NAL耐药,其中7株菌株共耐2种抗生素,未见耐3种抗生素的菌株。
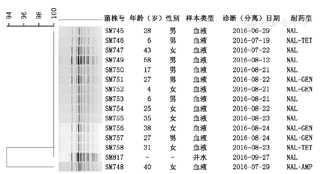
15株伤寒沙门菌经Xba Ⅰ酶切后分为2种带型,其中13株病例分离菌株和K熟食店加工厂井水分离菌株带型完全一致,为优势带型。另外1株病例分离菌株的PFGE带型与优势带型存在1个条带的差异,相似度在94%左右。详见图1。江苏省内2014年来分离的伤寒沙门菌中,江阴市分离的菌株与此次样本菌株PFGE图谱不一致,但苏州2株和南通2株菌株带型与此次疫情株相同。

本研究共涉及14例病例,时间历时近3个月。结合现场流行病学调查,由新桥镇菜场购买的凉拌菜、熟食、蔬菜为危险因素[9],实验室针对医院排污水、菜场供给的蔬菜、蔬菜种植地周围水源及熟食店加工厂及周边井水、池塘水等展开检测。检测外环境水样时,采取离心浓缩方式富集病原。不同样本增菌则参照吕晓萌等[13]的推荐方法,短时高效增殖病原,并采用灵敏度高的实时荧光PCR方法进行初筛,阳性样本进一步针对性的分离目标菌,提高了病原检出率,并成功从K熟食店加工厂井水中分离到1株伤寒沙门菌。
本研究分离的伤寒沙门菌耐药现象尚不严重,未见多重耐药株,仅对NAL 100.0%耐药,对AMC、CEF、SMZ、CHL和STR敏感率为100.0%,耐药谱与江苏地区往年分离株略有不同[14],也不同于贵州[15]、大连[16,17]等地菌株。PFGE是病原菌分子分型的金标准,在疫情暴发调查和传播途径追踪中发挥重要作用[18,19]。本研究PFGE分析结果显示,15株伤寒沙门菌同源性高,14例病例是由同一株传播引起的。本次检测涉及的首发病例和最晚报告的病例,时间跨度近3个月,14个病例分布在3个镇和市区。以上分析提示该菌外环境生存能力、传播能力和致病性强,在过去3个月内一直在该地区存在,传播范围广。同时通过PulseNet China数据库搜索分析,江阴市往年分离的菌株与此次样本菌株PFGE图谱不一致,但与江苏其他市往年分离的菌株带型一致,提示此次疫情伤寒沙门菌可能非本地流行株。
K熟食店加工厂井水中分离的伤寒沙门菌带型与分离自病例的菌株带型完全一致,虽然调查和采样、获得菌株时,疫情已发生4个月,但这个加工厂在疫情出现前及在疫情流行期间,一直供应熟食到新桥市场。流行病学证据结合实验室分子分型结果能推断该起疫情为熟食和蔬菜污染所致、食品加工厂水样是传播媒介之一。
实验室在本次伤寒疫情中扮演"确证"和"溯源"两个角色。首先,通过实时荧光PCR联合传统培养方法,快速、特异、灵敏检测出伤寒沙门菌,确证外环境存在伤寒沙门菌菌株;其次,通过PFGE,确证病例菌株具有相同或及其相似的分子型别,确定为同一伤寒沙门菌遗传克隆的传播引起的病例异常增多;第三,通过PFGE揭示患者菌株和外环境菌株为同一菌株,确定K熟食店加工厂水样是传播媒介之一,即本次疫情存在水源性传播。
江阴市疾病预防控制中心张宏宾对本实验提供的帮助
所有作者均声明不存在利益冲突



























