
总结应用新型准分子激光冠状动脉斑块消融术(excimer laser coronary atherectomy, ELCA )治疗冠状动脉钙化病变及慢性完全阻塞(chronic total occlusion, CTO)病变的初步经验。
本研究为横断面、单臂、观察性试验,连续入选2015年3月至2017年12月于首都医科大学附属北京安贞医院心内科采用ELCA行经皮冠状动脉介入治疗(percutaneous coronary intervention, PCI)的复杂冠状动脉疾病患者106例(111处病变)。男性85例,女性21例,年龄(62.5±10.8 )岁,不稳定心绞痛患者79例,占74.5%。病变类型为冠状动脉钙化病变(73处,65.8%)或CTO病变(38处,34.2%),所有病变均为经过常规处理后球囊不能通过(52处,46.8%)或不能扩张(59处,53.2%)病变。
共111处病变(106例患者)拟在常规PCI基础上行ELCA辅助治疗,随后行冠状动脉支架置入或药物球囊扩张。89处(80.2%)病变应用直径0.9 mm激光导管,22处(19.8%)病变应用直径1.4 mm激光导管进行斑块消蚀。能量为(52.0±7.5)mJ/mm2,范围为(45~60)mJ/mm2,频率为(49.0±21.3)Hz,范围为(25~80)Hz,消融次数为(3.0±1.6)次。
主要观察指标为手术即刻成功率、术中并发症发生率和1个月时临床成功率。手术即刻成功定义为术中由血管造影证实使用ELCA后球囊可通过并扩张病变血管,PCI术后靶病变残余狭窄<50%,溶栓试验血流分级(thrombolysis in myocardial infarction,TIMI) 3级且无术中并发症。术中常见并发症包括冠状动脉血栓形成、无复流、夹层、急性闭塞和穿孔等。临床成功为手术即刻成功且术后1个月无主要不良事件发生。主要不良事件包括全因死亡、非致死性心肌梗死和靶血管再次血运重建。
106例患者共111处病变拟行ELCA治疗,104处病变(99例患者)成功通过激光导管后行球囊扩张,其中92处病变置入药物洗脱支架,12处病变行药物球囊扩张。7例患者(7处病变)因激光导管未能通过病变而手术操作失败。术中并发症3例(2.8%)。ELCA手术即刻成功96例(90.6%)。除2例失访外(随访率98.1%),其余患者出院后1个月内无不良心血管事件(全因死亡、非致死性心肌梗死和靶血管再次血运重建)发生,1个月时临床成功94例(88.7%)。
ELCA是球囊失败的冠状动脉钙化或CTO病变介入治疗的一种选择,其安全有效,但远期疗效有待进一步观察。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着人口老龄化,经皮冠状动脉介入治疗(percutaneous coronary intervention ,PCI)的复杂程度和难度逐渐增加。钙化病变、慢性完全阻塞(chronic total occlusion, CTO)病变、支架内再狭窄(in-stent restenosis, ISR)病变等由于病变组织坚硬,球囊难以通过或难以充分扩张,常导致PCI失败,并增加远期不良事件风险[1,2,3]。现有的治疗方法(如高压球囊和切割球囊等)效果有限,冠状动脉旋磨术也存在一定风险和禁忌,所以针对此类病变,迫切需要一种更为安全有效的PCI手段。
准分子激光治疗动脉粥样硬化性血管性疾病始于20世纪80年代。在冠状动脉球囊扩张时代,管腔再狭窄甚至闭塞风险很高,准分子激光斑块消融技术可用于球囊扩张后再狭窄和闭塞病变治疗。但由于早期准分子激光相应设备和技术不完善,PCI成功率和安全性还有待进一步提高,因而未能广泛推广[4,5]。药物洗脱支架(drug eluting stent, DES)的出现明显降低PCI术后管腔再狭窄风险,但随着近年来PCI适应证和难度逐渐增加,部分严重钙化、CTO和ISR病变使得球囊难以通过或扩张,无法置入DES。为此,研究者通过改良准分子激光技术和器械,研发出一种新型准分子激光冠状动脉斑块消融术(excimer laser coronary atherectomy,ELCA)[6]。ELCA应用波长更短的紫外线冷光源,采用脉冲性的发射方式,应用外径更小的导管,故安全性较高。在欧美及日本已经开始应用在钙化、CTO、ISR及桥血管等复杂冠状动脉病变PCI中,其有效性和安全性得到了初步验证[7,8,9]。据国外研究报道,ELCA在球囊不能通过或不能扩张的钙化及CTO病变中成功率在91%以上,发生冠状动脉穿孔、夹层等并发症的风险在4%以下[7]。首都医科大学附属北京安贞医院自2015年开展ELCA技术以来,已累计完成复杂PCI手术106例,主要为球囊不能通过或不能扩张的钙化及CTO病变,现报道如下。
连续入选2015年3月至2017年12月于首都医科大学附属北京安贞医院心内科采用ELCA治疗的复杂冠状动脉疾病患者106例(111处病变)。入选对象均有ELCA治疗适应证。其中男性85例,女性21例;年龄(62.5±10.8)岁;不稳定心绞痛患者79例,占74.5%,冠状动脉搭桥术后患者均处理病变血管(表1)。病变类型为冠状动脉钙化病变73处,CTO病变38处,球囊不能通过52处、不能扩张59处(表2)。研究方案经首都医科大学附属北京安贞医院伦理委员会批准。
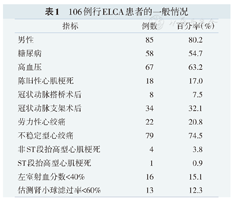
106例行ELCA患者的一般情况
106例行ELCA患者的一般情况
| 指标 | 例数 | 百分率(%) |
|---|---|---|
| 男性 | 85 | 80.2 |
| 糖尿病 | 58 | 54.7 |
| 高血压 | 67 | 63.2 |
| 陈旧性心肌梗死 | 18 | 17.0 |
| 冠状动脉搭桥术后 | 8 | 7.5 |
| 冠状动脉支架术后 | 34 | 32.1 |
| 劳力性心绞痛 | 22 | 20.8 |
| 不稳定型心绞痛 | 79 | 74.5 |
| 非ST段抬高型心肌梗死 | 4 | 3.8 |
| ST段抬高型心肌梗死 | 1 | 0.9 |
| 左室射血分数<40% | 16 | 15.1 |
| 估测肾小球滤过率<60% | 13 | 12.3 |
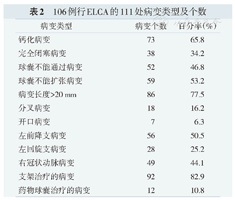
106例行ELCA的111处病变类型及个数
106例行ELCA的111处病变类型及个数
| 病变类型 | 病变个数 | 百分率(%) |
|---|---|---|
| 钙化病变 | 73 | 65.8 |
| 完全闭塞病变 | 38 | 34.2 |
| 球囊不能通过病变 | 52 | 46.8 |
| 球囊不能扩张病变 | 59 | 53.2 |
| 病变长度>20 mm | 86 | 77.5 |
| 分叉病变 | 18 | 16.2 |
| 开口病变 | 7 | 6.3 |
| 左前降支病变 | 56 | 50.5 |
| 左回旋支病变 | 28 | 25.2 |
| 右冠状动脉病变 | 49 | 44.1 |
| 支架治疗的病变 | 92 | 82.9 |
| 药物球囊治疗的病变 | 12 | 10.8 |
本研究中ELCA治疗的适应证包括球囊不能通过或不能扩张的钙化和CTO病变。钙化病变定义为:冠状动脉内注射造影剂前可见冠状动脉血管影和走形,注射造影剂后在相应冠状动脉节段可见管腔狭窄。CTO病变定义为:冠状动脉闭塞血管段前向血流TIMI 0级,且闭塞时间至少3个月。
本研究中ELCA治疗的禁忌证包括严重的肾功能不全、造影剂过敏、解剖结构不适合介入治疗。
术前准备同常规的冠状动脉造影及PCI方案。根据患者临床情况,术前顿服阿司匹林300 mg和氯吡格雷300 mg或替格瑞洛180 mg,签署冠状动脉造影同意书;根据患者临床情况和冠状动脉造影结果,由术者确定是否行ELCA治疗,并与患者签署PCI同意书和ELCA同意书。
采用6~ 7 Fr指引导管,经桡动脉或者股动脉入路。术中普通肝素抗凝(500~ 1 000 U/kg),活化凝血时间(activated coagulation time,ACT) > 250 s,必要时(不常规)应用血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂。当导丝通过钙化或CTO病变后,球囊不能通过或者不能扩张病变时考虑应用ELCA。术中激光成功消融后,均根据标准手术方案行球囊扩张以完成治疗过程,根据病情需要选择支架或药物球囊治疗。由术者决定是否行血管内超声(intravascular ultrasound, IVUS)或光学相干断层扫描(optical coherence tomography, OCT)检查。术后立即拔除鞘管。
步骤一:放置指引导管和导丝
经外周血管入路置入合适的指引导管于冠状动脉开口,根据造影显示的靶病变特点选择合适的通用型或CTO导丝,操作导丝通过靶病变置入靶血管远端,CTO导丝通过靶病变后需更换为通用型操作导丝。
步骤二:ELCA准备
根据靶血管直径和靶病变情况选择合适的激光导管,一般使用0.9 mm或1.4 mm激光导管(rapid exchange型),使用前预热ELCA激光机(CVX-300 Spectranetics) 5 min,并用肝素生理盐水冲洗激光导管内腔。将激光导管末端连接至激光操纵台,进行校准后备用。
步骤三:ELCA治疗
将激光导管沿导丝缓慢向靶病变部位推进。接近靶病变时设置激光参数,初始能量为30 mJ/mm2,初始脉冲为25 Hz。由近及远推送激光导管,为增加斑块消融效果,推进速度要控制在1 mm/s以内。在消融过程中,助手需同时向冠状动脉内推注生理盐水用于冷却激光导管。全程透视观察导管前进过程,观察患者心电、血压和指引导管压力。每次消融10 s后冷却5 s,如此反复进行。根据病变的坚硬程度及激光导管的可通过性,逐级增加能量及脉冲频率。最大能量为80 mJ/mm2,最大频率为80 Hz。
步骤四:球囊扩张及支架置入
激光导管撤出后,根据标准手术方案行球囊扩张或支架置入。如球囊通过或扩张仍有困难可考虑增加能量或频率进行再次消融。针对钙化或CTO病变,主要以增加频率为主。每次消融持续10 s,冷却5 s,反复进行。
ELCA手术即刻成功定义为ELCA术后球囊可通过并扩张病变,PCI术后靶病变残余狭窄<50%,溶栓试验血流分级(thrombolysis in myocardial infarction, TIMI)[10]3级且无术中并发症。
临床成功为达到手术即刻成功以及术后1个月无主要不良事件发生。主要不良事件包括全因死亡、非致死性心肌梗死和靶血管再次血运重建。
ELCA术中常见并发症包括冠状动脉血栓形成、无复流、夹层、急性闭塞和穿孔等[9]。
指冠状动脉内出现新的造影剂充盈缺损,而对硝酸甘油无明显反应。处理措施应保留导丝,使用球囊扩张或机械抽栓,配合使用血小板糖蛋白Ⅱb/Ⅲa受体拮抗剂。
指介入治疗解除管腔局部阻塞后下游心肌仍得不到有效灌注。预防和处理措施包括远端栓塞保护装置、直接置入支架、系统输注血小板糖蛋白Ⅱb/Ⅲa受体抑制剂以及冠状动脉内输注血管扩张剂或抗栓、溶栓药物。
是指冠状动脉内膜撕裂或者冠状动脉壁内出血造成的内膜和中膜分离。病情稳定且较小的夹层可保守治疗,血流动力学不稳定或严重的夹层需尽快将导丝置入真腔并置入支架。
是指PCI术中或术后冠状动脉主支或边支血流减慢(TIMI 1级或2级)或血流停滞(TIMI 0级)。较小边支闭塞无需特殊处理,主支或较大边支闭塞需及时操作导丝找回真腔,恢复前向血流。
可根据血管外造影剂的漏出而诊断。处理应紧急采用球囊封堵,必要时可使用鱼精蛋白中和肝素,严重冠状动脉穿孔应急诊开胸处理。
术后常规给予低分子肝素抗凝(0.4~ 0.6 mg ,12 h/次,持续1~ 2 d),患者出院后需行12个月的双联抗血小板治疗以及长期的冠状动脉粥样硬化性心脏病二级预防治疗。术后1个月时于门诊随访,常规检查血常规、生化、花生四烯酸(arachidonic acid, AA)和腺苷二磷酸(adenosine diphosphate, ADP)诱导的血小板聚集率及超声心动图等,同时了解主要不良心血管事件(全因死亡、非致死性心肌梗死和靶血管再次血运重建)发生情况。
统计学分析软件使用SPSS 20.0。年龄和ELCA设定参数为正态分布的计量资料,以均数±标准差( ±s)表示;患者一般情况(左室射血分数和估测肾小球滤过率采用二分类法表示)、病变类型和介入治疗特点、并发症、手术效果和临床转归为计数资料,以例数(率)表示。
±s)表示;患者一般情况(左室射血分数和估测肾小球滤过率采用二分类法表示)、病变类型和介入治疗特点、并发症、手术效果和临床转归为计数资料,以例数(率)表示。
共计111处病变(106例患者)行ELCA治疗。89处(80.2%)病变应用0.9 mm激光导管,22处(19.8%)病变应用1.4 mm激光导管进行斑块消融。应用最大能量为(52.0±7.5) J/cm2,范围为(45~60)J/cm2,最大频率为(49.0±21.3)Hz,范围为(25~80) Hz,消融次数为(3.0±1.6)次。
104处病变(99例患者)成功通过激光导管后行球囊扩张,其中92处(82.9%)病变置入DES(图1),12处病变(10.8%)行药物球囊扩张。7例(6.6%)患者(7处病变)手术操作失败,均为激光导管未能通过病变,其中5例成功行冠状动脉旋磨术并置如支架,另外2例给予药物治疗。
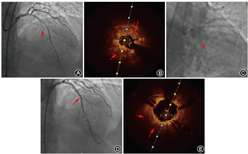

注:患者女性,62岁,胸痛10年加重24 h入院,诊断非ST段抬高型心肌梗死,既往高血压、PCI病史,射血分数61%,因球囊通过后无法充分扩张钙化病变故行ELCA治疗。A图为冠状动脉造影显示左主干末段至中段弥漫狭窄伴管腔重度钙化,箭头所示为前降支中段狭窄最重处;B图为OCT提示钙化(箭头所示)角度>270 °,厚度>1 mm,管腔面积1.20 mm2;C图为1.4 mm激光导管(箭头所示)消融3次(1次40 Hz 50 J/cm2, 2次60 Hz 60 J/cm2)后成功置入直径2.5 mm、长度33 mm和直径3.0 mm、长度23 mm的2枚药物洗脱支架;D图为造影显示残余狭窄<10%,箭头所示为术前前降支中段狭窄最重处;E图为复查OCT示狭窄最窄处,管腔面积明显增加,支架膨胀、贴壁良好,钙化斑块被支架完全覆盖(箭头所示)
术中并发症3例(2.8%)。1例患者前降支重度钙化迂曲,激光导管推送时发生冠状动脉夹层,由于夹层较小未予处理;1例患者回旋支CTO病变ELCA术中出现冠状动脉穿孔,采用球囊封堵成功;1例患者前降支分叉病变合并管腔钙化,术中出现边支急性闭塞,由于边支较小未予处理。ELCA手术即刻成功96例,成功率90.6%,冠状动脉夹层、急性闭塞和穿孔发生率均为0.9% (1/111),无冠状动脉血栓形成无复流发生。
除2例失访外,其余患者出院后均随访1个月,随访率98.1%(104/111),随访期间无不良事件(全因死亡、非致死性心肌梗死和靶血管再次血运重建)发生,1个月时94例成功,临床成功率88.7%。
PCI技术的普及拓展了PCI适应证,增加了PCI难度。目前需行血管成形术患者中12%存在严重钙化病变,10%存在CTO病变,这类复杂病变行介入治疗时常出现球囊无法通过或无法扩张的情况,统称球囊失败,导致手术成功率降低,术中和远期手术风险均升高[1,2,3,12]。本研究证实,ELCA为球囊失败的钙化或CTO病变提供一种安全有效的PCI方法。
本研究中冠状动脉钙化病变占65.8% (73/111处),CTO病变占34.2% (38/111处)。国外一项研究纳入ELCA治疗人群更广,119例接受ELCA治疗的冠状动脉疾病患者中,32例(26.9%)为CTO病变,25例(21%)为钙化病变,40例(33.6%)为大隐静脉桥血管病变,15例(12.6%)为ISR病变,7例(5.9%)为急性心肌梗死[8]。由此可见,ELCA目前在临床主要用于复杂冠状动脉病变介入治疗。除了ELCA说明书中提及的无保护左主干病变为ELCA相对禁忌证外,ELCA无特殊的绝对禁忌证。
ELCA一大优势即消融导管可以联用0.014 in(1 in=0.0254 m)通用型导丝,操控性较好,并发症风险较低。常用的激光导管有4种型号,分别为0.9、1.4、1.7和2.0 mm。前两者可用于桡动脉6 Fr指引导管,0.9 mm激光导管最常运用于CTO病变中,而1.4 mm激光导管常应用于ISR病变中。对于支架置入后膨胀不良引起的再狭窄,则需要更大直径的激光导管,以便使支架内纤维组织充分消融,从而使支架完全膨胀[13]。ELCA在消融粥样硬化斑块同时兼有促进血栓溶解和抗血小板聚集作用,因此可用于急性冠状动脉综合征时血栓性病变,以及大隐静脉桥血管富含脂质斑块病变介入治疗[2]。
ELCA作用机制主要与光化学效应、光热效应和光机械效应有关。ELCA以惰性卤化物为激光介质,发射出波长为309 nm的高强度单向光波紫外线,作用于血管内组织和血栓处,使细胞的碳键断裂、结构弱化,同时会使细胞内水分温度升高而产生水蒸气使细胞破裂。导管末端水蒸气的产生使组织损伤变为可控的,并且组织汽化产生的压力能对血管内栓塞物质产生更强的破坏作用。消融产生的副产品是水、气体和微小物质(超过91%的物质直径不到10 μm)。由于避免了血管内栓塞,所以相对于旋磨,ELCA降低无复流及围手术期心肌梗死等并发症风险,这也是旋磨禁用于血栓性病变和桥血管病变的主要原因[6]。
但ELCA对于严重钙化病变疗效劣于旋磨[6],旋磨仍然是目前临床上严重钙化病变优先考虑的治疗方案。但旋磨术操作较为复杂,旋磨导丝操控性较差,对于部分严重钙化狭窄的病变可能难以通过,且并发症风险较高;而ELCA学习曲线更短,应用常规0.014 in导丝,并发症风险较低。对于严重钙化病变,有学者提出"RASER技术",即预先使用ELCA对病变预处理后再行旋磨治疗,初步研究成果显示出良好的有效性和安全性[14,15]。
本研究中激光导管在钙化病变及CTO病变的即刻手术成功率为90.6% (96/106例),并发症风险为2.8% (3/106例),包括1例冠状动脉夹层、1例冠状动脉穿孔和1例冠状动脉急性闭塞,总体有效性和安全性与既往国外研究结果相似。Bilodeau等[6]研究纳入100例病变,其中钙化病变占80% ,CTO病变占28%,手术成功率93%,冠状动脉夹层风险为5.3 %;美国一项多中心注册研究纳入2012—2016年11个医学中心701例患者合并球囊无法通过的CTO病变(718处),ELCA应用比率为18%,器械和手术成功率均为95%,居各种治疗策略成功率之首[16]。LEONARDO研究入选80例患者(96处病变)中ACC/AHA冠状动脉病变分型B2/C占95%,其中钙化病变占57%,球囊失败病变占32%,手术成功率91.7%,并发症风险为1.1 %(仅1例非Q波型心肌梗死)[7]。Ichimoto等[17]近期评价了ELCA治疗ISR长期预后,研究者纳入81例PCI患者,23例接受ELCA治疗患者多合并复杂病变,58例未行ELCA治疗,平均随访30个月,结果显示两组间主要不良心血管事件发生率无显著差异,证实了ELCA用于冠状动脉复杂病变斑块修饰的长期有效性。
进一步提高ELCA手术成功率并降低并发症风险,需要严格把握激光导管操作原则,即选择激光导管直径小于血管直径的2/3,前进速度缓慢小于1 mm/s,助手同时推注盐水冷却激光导管[18]。若选择导管直径过大,对于支架边缘病变、不对称病变或成角病变消融时可能增加血管夹层或穿孔风险;激光导管推送速度过快,助手配合盐水输注中断,或盐水中混杂造影剂也可能增加血管夹层或穿孔风险。本研究中,夹层或穿孔并发症的发生率为0.9%(1/111),低于旋磨并发症风险(3.2%)[19]。此外,激光发挥消融作用的能力与激光的能量和脉冲频率有关,同时能量与脉冲频率的增加也导致血管夹层或穿孔并发症风险性增加,如果病变难以通过需要增加能量和脉冲时以先增加脉冲后增加能量为宜。国外研究显示,应用高能量的激光消融(80 J/cm2,80 Hz )可以提高通过病变能力,且不增加并发症发生率[12]。
本研究为横断面、单臂、观察性设计,由于为初步安全性和有效性探索性研究,故纳入患者和病变例数较少,缺乏对照,且随访时间较短,其长期疗效有待于进一步验证。本中心应用ELCA初步经验提示,在球囊失败的冠状动脉钙化或CTO病变中,ELCA成功率较高,并发症较低,应用前景值得期待。
相对于其他斑块修饰技术,ELCA独特优势在于其使用0.014 in通用型导丝,学习曲线更短。近年来ELCA应用于复杂冠状动脉病变PCI比例逐渐增加,其短期有效性和安全性得到了证实,但远期有效性和安全性还需要更多的临床证据支持。此外,ELCA对于严重钙化病变治疗效果有限,而联合ELCA和旋磨或旋切术可充分利用两种不同斑块修饰技术特点,其治疗严重钙化病变效果值得期待。



























