
探讨去铁胺、去铁酮治疗重型β-地中海贫血铁过载患者的临床疗效。
选择2015年6月1日至2016年5月31日,广西贵港市人民医院血液科收治的52例重型β-地中海贫血铁过载患者为研究对象。按照采取的去铁治疗方法,将其分为去铁胺组(采用去铁胺治疗,n=17)、去铁酮组(采用去铁酮治疗,n=20)和联合治疗组(采用去铁胺联合去铁酮治疗,n=15)。采用回顾性研究方法,观察3组患者治疗前、治疗12个月后的心、肝MRI T2*值变化,以及治疗前和治疗3、6、9、12个月后的血清铁蛋白(SF)值变化。组内治疗前、后比较采用配对样本t检验,3组间比较采用单向方差分析,两两比较采用最小显著差异(LSD)法。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求。
①治疗12个月后,去铁胺组、去铁酮组和联合治疗组患者心MRI T2*值分别为(22.71±2.57)、(26.50±3.32)和(34.93±8.26)ms,分别较治疗前的(13.76±3.85)、(13.60±3.73)、(14.30±2.95)ms显著升高,差异均有统计学意义(t=-11.697、-11.352、-9.449,P<0.001、0.001、0.001);3组患者治疗12个月后心MRI T2*值比较,总体差异有统计学意义(F=23.885,P<0.001)。其中,联合治疗组患者心MRI T2*值,分别高于去铁胺组及去铁酮组,并且差异均有统计学意义(联合治疗组比去铁胺组:LSD-t=5.806,P<0.001;联合治疗组比去铁酮组:LSD-t=5.213,P<0.001)。②治疗12个月后,去铁胺组、去铁酮组和联合治疗组患者肝MRI T2*值分别为(8.30±1.07)、(8.27±1.25)和(9.04±1.01)ms,均较治疗前的(4.27±1.06)、(4.24±1.01)、(4.23±0.99)ms显著升高(t=-12.378、-13.384、-12.619,P<0.001、0.001、0.001)。治疗12个月后,3组患者肝MRI T2*值比较,总体差异无统计学意义(F=2.423,P=0.099)。其中,联合治疗组患者肝MRI T2*值分别大于去铁胺组及去铁酮组,并且差异均有统计学意义(联合治疗组比去铁胺组:LSD-t=-2.339,P=0.026;联合治疗组与去铁酮组比较LSD-t=-2.057,P=0.048)。③治疗12个月后,去铁胺组、去铁酮组和联合治疗组患者的SF值分别为(3 051.88±233.44)、(2 891.70±101.54)、(2 800.60±202.99)μg/L较治疗前的(3 442.88±137.91)、(3 443.30±150.79)、(3 460.27±227.52)μg/L显著降低(t=22.33、6.142、22.744,P<0.001、0.001、0.001)。治疗后12个月,3组患者SF值比较,总体差异有统计学意义(F=7.825,P=0.001)。其中,联合治疗组SF值分别显著低于去铁胺组及去铁酮组,差异亦有统计学意义(联合治疗组比去铁胺组:LSD-t=2.855,P=0.008;联合治疗组比去铁酮组:LSD-t=2.359,P=0.024)。
去铁胺、去铁酮及二者联合治疗均可以有效缓解重型β-地中海贫血铁过载患儿的机体铁负荷。其中,去铁胺和去铁酮联合治疗在降低该类患者SF值、心铁过载效果较单药更优。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
地中海贫血是我国南方地区,特别是广西、广东省的常见常染色体单基因遗传性溶血性贫血。而重型β-地中海贫血为临床最为常见的地中海贫血类型,需长期治疗及随访[1]。虽然研究表明,造血干细胞移植(hematopoietic stem cell transplantation,HSCT)可治愈地中海贫血,但是受家庭经济条件、移植后反应及供者来源等因素限制,仍有极大部分患者选择接受长期、大量输血治疗,以通过大量输血抑制促红细胞生成素的生成,降低骨骼畸形的发生率,维持重型β-地中海贫血患者的正常生长发育[1,2]。但是长期输血易导致铁离子在患者体内过度沉积形成铁过载,造成关节、胰、垂体、心、肝等重要部位及器官的结构性损害,进而引发功能障碍,严重者甚至可导致死亡[2,3]。因此,选择对心、肝铁负荷清除较好的铁螯合剂进行去铁治疗,是重型β-地中海贫血铁过载患者的重要临床治疗措施。本研究采用不同铁螯合剂治疗重型β-地中海贫血铁过载患者,对其心、肝MRI T2*值及血清铁蛋白(serum ferritin, SF)值的变化等相关资料进行回顾性分析,旨在为该类患者选择临床疗效更佳的去铁治疗方法,提供理论依据。现将研究结果报道如下。
选择2015年6月1日至2016年5月31日,广西贵港市人民医院血液科收治的52例重型β-地中海贫血铁过载患者为研究对象。按照去铁治疗方法的不同,将其分为去铁胺组(采用去铁胺治疗,n=17)、去铁酮组(采用去铁酮治疗,n=20)和联合治疗组(采用去铁胺联合去铁酮治疗,n=15)。其中,去铁胺组男性患者为10例,女性为7例,年龄为(13.3±3.6)岁;去铁酮组男性患者为9例,女性为11例,年龄为(13.5±4.2)岁;联合治疗组男性患者为8例,女性为7例,年龄为(13.3±3.1)岁。3组患者的性别构成比、年龄等基线资料比较,差异均无统计学意义(P>0.05)。本研究遵循的程序符合2013年修订的《世界医学协会赫尔辛基宣言》要求。
本研究纳入标准:①符合重型地中海贫血及铁过载诊断标准,②经MRI T2*技术监测心、肝铁过载,③所有患者均签署知情同意书,④治疗前患者SF值>1 000 ng/mL,接受长期足量、规律输血治疗,输血次数≥20次,⑤年龄≥5岁(MRI T2*检查时需要屏气,>5岁患者可以较好地配合检查)。排除标准:①患者对治疗期间所使用药物及试剂耗材等发生变态反应,②有肝炎、反复严重感染、超声心动图示左心室射血分数<56%或有充血性心力衰竭病史,③存在妨碍治疗的全身性疾病,④患者或家属对治疗方案有异议及未签署临床研究知情同意书。
去铁治疗时机:若患者SF值>1 000 ng/mL,或者输血次数为10~20次,即开始进行去铁治疗。3组患者去铁治疗方法分别如下。去铁铵组患者接受持续皮下泵入或静脉滴注去铁铵(批号:LOTSP805,瑞士Novaitis公司),剂量为(30±9)mg/(kg·次)×1次/d×5 d/周×1周。去铁酮组患者口服去铁酮(生产批号:RD7470,加拿大奥贝安可公司),剂量为(72±10)mg/(kg·次)×3次/d×7 d。联合治疗组患者接受持续皮下泵入或静脉滴注去铁铵(30±9)mg/(kg·次)×1次/d×3 d/周×1周+口服去铁酮(72±10)mg/(kg·次)×3次/d×2 d治疗。若患者SF值≤1 000 ng/mL,可暂停去铁治疗。
3组患者接受去铁治疗前及治疗12个月后,使用MRI T2*检测方法检测心、肝铁负荷[6]。MRI T2*检测采用Siemens Sonata 1.5 T型磁共振扫描仪(德国siemens公司)。其中,心肌MRI T2*检测采用门控单次屏气8个回波序列(所有序列满足要求)对肝心铁负荷进行评估;肝MRI T2*评估采用屏气20个回波序列(所有序列满足要求)对肝铁负荷进行评估。
所有患者去铁治疗前、治疗3、6、9、12个月后行SF值检测。标本采集方法:患者于清晨空腹状态下,采集肘静脉血3 mL,待测。SF值检测方法:使用西门子ADVIA Centaur® CP型全自动化学发光免疫分析系统(德国西门子公司)及配套铁蛋白体外诊断试剂盒(批号:11202),采用化学发光法进行SF值检测,检测方法严格按产品说明书进行。对出现发热或其他感染症状、体征的患者,于去铁治疗1周后(+7 d)检测其SF值;对需接受输血治疗的患者,在其输血治疗前、后需检测血常规及SF值。
本研究所得数据使用SPSS 13.0统计软件进行处理。MRI T2*值、SF值等符合正态分布的计量资料采用 ±s表示,各组治疗前、后比较,采用配对样本t检验,3组间比较采用单向方差分析,两两比较采用最小显著差异(least significant difference,LSD)法。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
±s表示,各组治疗前、后比较,采用配对样本t检验,3组间比较采用单向方差分析,两两比较采用最小显著差异(least significant difference,LSD)法。所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
3组患者治疗12个月后,其心MRI T2*值分别较治疗前升高,并且差异均有统计学意义(去铁胺组:t=-11.697,P<0.001;去铁酮组:t=-11.352,P<0.001;联合治疗组t=-9.449,P<0.001)。治疗12月后,3组患者心MRI T2*值比较,总体差异有统计学意义(F=23.885,P<0.001)。其中,联合治疗组患者心MRI T2*值,分别高于去铁胺组及去铁酮组,并且差异均有统计学意义(联合治疗组比去铁胺组:LSD-t=5.806,P<0.001;联合治疗组比去铁酮组:LSD-t=5.213,P<0.001),去铁胺组及去铁酮组患者心MRI T2*值比较,差异无统计学意义(LSD-t=3.244,P=0.570)。3组患者治疗前及治疗12个月后心MRI T2*值比较,见表1。
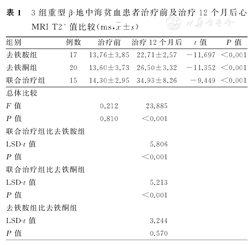
3组重型β-地中海贫血患者治疗前及治疗12个月后心MRI T2*值比较(ms, ±s)
±s)
3组重型β-地中海贫血患者治疗前及治疗12个月后心MRI T2*值比较(ms, ±s)
±s)
| 组别 | 例数 | 治疗前 | 治疗12个月后 | t值 | P值 |
|---|---|---|---|---|---|
| 去铁胺组 | 17 | 13.76±3.85 | 22.71±2.57 | -11.697 | <0.001 |
| 去铁酮组 | 20 | 13.60±3.73 | 26.50±3.32 | -11.352 | <0.001 |
| 联合治疗组 | 15 | 14.30±2.95 | 34.93±8.26 | -9.449 | <0.001 |
| 总体比较 | |||||
| F值 | 0.212 | 23.885 | |||
| P值 | 0.810 | <0.001 | |||
| 联合治疗组比去铁胺组 | |||||
| LSD-t值 | 5.806 | ||||
| P值 | <0.001 | ||||
| 联合治疗组比去铁酮组 | |||||
| LSD-t值 | 5.213 | ||||
| P值 | <0.001 | ||||
| 去铁胺组比去铁酮组 | |||||
| LSD-t值 | 3.244 | ||||
| P值 | 0.570 | ||||
3组患者治疗12个月后,肝MRI T2*值均较治疗前升高,并且差异均有统计学意义(去铁胺组:t=-12.378,P<0.001;去铁酮组:t=-13.384,P<0.001;联合治疗组:t=-12.619,P<0.001)。治疗12个月后,3组患者肝MRI T2*值比较,总体差异无统计学意义(F=2.423,P=0.099)。其中,联合治疗组患者肝MRI T2*值分别大于去铁胺组及去铁酮组,并且差异均有统计学意义(联合治疗组比去铁胺组:LSD-t=-2.339,P=0.026;联合治疗组与去铁酮组比较LSD-t=-2.057,P=0.048),去铁胺组及去铁酮组心MRI T2*值比较,差异无统计学意义(LSD-t=-0.910,P=0.928)。3组患者治疗前及治疗12个月后肝MRI T2*值比较,见表2。
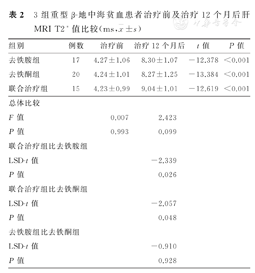
3组重型β-地中海贫血患者治疗前及治疗12个月后肝MRI T2*值比较(ms, ±s)
±s)
3组重型β-地中海贫血患者治疗前及治疗12个月后肝MRI T2*值比较(ms, ±s)
±s)
| 组别 | 例数 | 治疗前 | 治疗12个月后 | t值 | P值 |
|---|---|---|---|---|---|
| 去铁胺组 | 17 | 4.27±1.06 | 8.30±1.07 | -12.378 | <0.001 |
| 去铁酮组 | 20 | 4.24±1.01 | 8.27±1.25 | -13.384 | <0.001 |
| 联合治疗组 | 15 | 4.23±0.99 | 9.04±1.01 | -12.619 | <0.001 |
| 总体比较 | |||||
| F值 | 0.007 | 2.423 | |||
| P值 | 0.993 | 0.099 | |||
| 联合治疗组比去铁胺组 | |||||
| LSD-t值 | -2.339 | ||||
| P值 | 0.026 | ||||
| 联合治疗组比去铁酮组 | |||||
| LSD-t值 | -2.057 | ||||
| P值 | 0.048 | ||||
| 去铁胺组比去铁酮组 | |||||
| LSD-t值 | -0.910 | ||||
| P值 | 0.928 | ||||
治疗12个月后,3组患者SF值分别与治疗前比较均显著降低,并且差异均有统计学意义(去铁胺组:t=22.33,P<0.001;去铁酮组:t=6.142,P<0.001;联合治疗组:t=22.744,P<0.001)。治疗12个月后,3组患者SF值比较,总体差异有统计学意义(F=7.825,P=0.001)。其中,联合治疗组SF值分别显著低于去铁胺组及去铁酮组,差异均有统计学意义(联合治疗组比去铁胺组:LSD-t=2.855,P=0.008;联合治疗组比去铁酮组:LSD-t=2.359,P=0.024),去铁胺组及去铁酮组SF值比较,差异无统计学意义(LSD-t=-1.137,P=0.263)。3组患者治疗3、6、9个月后SF值分别比较,总体差异均无统计学意义(P>0.05)。3组患者治疗前、后SF值比较,见表3。
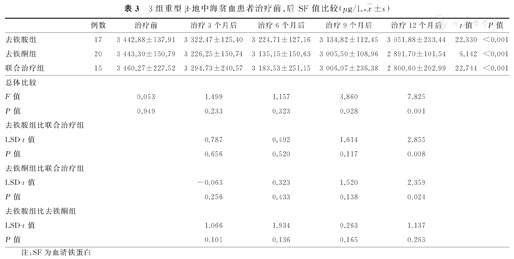
3组重型β-地中海贫血患者治疗前、后SF值比较(μg/L, ±s)
±s)
3组重型β-地中海贫血患者治疗前、后SF值比较(μg/L, ±s)
±s)
| 例数 | 治疗前 | 治疗3个月后 | 治疗6个月后 | 治疗9个月后 | 治疗12个月后 | t值 | P值 | |
|---|---|---|---|---|---|---|---|---|
| 去铁胺组 | 17 | 3 442.88±137.91 | 3 322.47±125.40 | 3 224.71±127.16 | 3 134.82±112.45 | 3 051.88±233.44 | 22.330 | <0.001 |
| 去铁酮组 | 20 | 3 443.30±150.79 | 3 226.25±150.74 | 3 135.15±150.63 | 3 005.50±108.96 | 2 891.70±101.54 | 6.142 | <0.001 |
| 联合治疗组 | 15 | 3 460.27±227.52 | 3 294.73±240.57 | 3 183.53±251.15 | 3 006.07±236.38 | 2 800.60±202.99 | 22.744 | <0.001 |
| 总体比较 | ||||||||
| F值 | 0.053 | 1.499 | 1.157 | 3.860 | 7.825 | |||
| P值 | 0.949 | 0.233 | 0.323 | 0.028 | 0.001 | |||
| 去铁胺组比联合治疗组 | ||||||||
| LSD-t值 | 0.787 | 0.492 | 1.614 | 2.855 | ||||
| P值 | 0.656 | 0.520 | 0.117 | 0.008 | ||||
| 去铁酮组比联合治疗组 | ||||||||
| LSD-t值 | -0.063 | 0.323 | 1.520 | 2.359 | ||||
| P值 | 0.256 | 0.433 | 0.138 | 0.024 | ||||
| 去铁胺组比去铁酮组 | ||||||||
| LSD-t值 | 1.066 | 1.934 | 0.263 | 1.137 | ||||
| P值 | 0.101 | 0.136 | 0.165 | 0.263 | ||||
注:SF为血清铁蛋白
目前,重型β-地中海贫血唯一有效治愈途径是HSCT。由于相合供者来源困难及移植费用高昂,仅有极少该病患者有条件接受HSCT,导致该方法不能在临床广泛应用。因此,长期定期输血成为重型β-地中海贫血患者的主要治疗方案。长期、反复、大量输血可刺激该类患者骨髓红系细胞的造血增加,引起机体铁负荷过重,而过量的铁沉积在心、肝、胰、脾、肾、垂体等多个器官,可进而导致多器官功能障碍,甚至出现功能衰竭危及生命,并且最终导致死亡。其中,铁过载所致的心力衰竭是导致重型β-地中海贫血患者死亡的主要原因之一[7]。因此,在进行长期、定期输血治疗过程中,各器官的铁过载监测以及适时进行去铁治疗,对于重型β-地中海贫血患儿至关重要。
目前,由于SF临床检测仪器较易普及,检测方法易于操作,因此SF检测成为临床反映重型β-地中海贫血患儿体内铁负荷的较合理并且可广泛推广的重要手段。部分研究表明,SF值与肝铁负荷水平具有密切关系[8,9]。Atiq等[10]研究结果显示,267例SF值均超过正常参考值范围的β-地中海贫血患者中,75例(28%)患者发生心铁过载,其并发心脏病的中位发病年龄为(13.8±5.5)岁。临床单纯SF检测在反映患者机体铁负荷方面,仍存在局限性,因此重型β-地中海贫血患者机体铁负荷,需要多种检测方法结合进行,以提高准确性。机体铁负荷的传统检测方法主要为肝活组织检查,但是该方法为有创性检测,存在出血、感染等风险,以致患者对该方法依从性差,从而导致该方法在临床上难以被广泛推广。近年来,使用MRI T2*技术检测机体铁负荷,在临床广泛应用。该检测方法具有快速、无创等特点[11,12,13,14,15,22],可有效检测机体内各器官铁负荷情况,可对重型β-地中海贫血患者铁过载的并发症进行早期预测,并且对科学指导去铁治疗发挥重要作用。
铁螯合剂的作用机制是通过体内与铁离子特异性结合,形成大分子铁胺复合物,然后通过大、小便排出体外,可防止重型β-地中海贫血患者在定期输血过程中诱发的机体铁过载,以及铁沉积于各器官,减少因为铁超负荷而造成的脂质过氧化及自由基的大量生成,进而减轻患者溶血反应[16]。目前,地拉罗司作为新型口服去铁药物,临床疗效较好,但是由于部分地区存在经济等因素,该药物未能在国内被广泛使用[23,24]。本研究主要采用的铁螯合剂为去铁胺及去铁酮。去铁胺是临床中首个与铁有强亲和力的去铁剂,能够与铁蛋白、游离铁,以及结合含铁血黄素的Fe3+形成铁胺络合物,可以有效清除肝脏铁沉积。国外一项长期随访研究发现,与安慰剂相比,去铁胺能显著降低重型β-地中海贫血铁过载患者的体内铁负荷,并且可显著降低患者器官损害和病死率[17]。由于去铁胺的药物半衰期仅约为25 min,给药方式要求皮下泵入或者静脉滴注,给药时间为至少连续输注8~12 h/次×5次/周,有研究发现,约60%患者对该药物的治疗依从性较低[18]。去铁酮是一种与铁以3∶1摩尔比键合的二齿配位体,其活性成分为3-羟基-1,2-二甲基-4-(1H)-吡啶酮。去铁酮的给药方式为口服,虽然可显著改善去铁胺患者依从性较差的问题,但是其不良反应亦较为明显,部分学者认为其安全性问题使该药的临床价值并未明显优于去铁胺[19]。去铁胺与去铁酮联合用药,进行去铁治疗,具有协同作用。其具体机制为,去铁酮容易进入细胞并与细胞内的铁螯合,并将结合物转运至血浆与去铁胺结合,进而对机体铁过载发挥协同去铁作用。国外一项重型β-地中海贫血患者心肌铁沉积的随机双盲研究表明,与单独使用去铁胺相比,去铁胺与去铁酮联合治疗能显著降低心肌铁负荷[20]。这一结果对去铁酮、去铁胺的联合用药具有指导意义。本研究通过使用血清SF值、肝及心MRI T2*值反映不同去铁治疗方法对重型β-地中海贫血铁过载患者的临床疗效差异。本研究结果显示,3组患者治疗12个月后,心及肝MRI T2*值、血清SF值分别与治疗前比较,均显著改善,并且差异均有统计学意义(P<0.05);治疗12个月后,3组患者的心MRI T2*值、血清SF值比较,总体差异均有统计学意义(P<0.05);其中,联合治疗组患者心MRI T2*值分别高于去铁胺组及去铁酮组,血清SF值则显著低于后二者,并且差异亦有统计学意义(P<0.05),去铁胺组和去铁酮组上述指标比较,差异无统计学意义(P>0.05)。该结果与Fisher等[17]和Elalfy等[18]研究结果相符。这表明,去铁胺联合去铁酮治疗重型β-地中海贫血铁过载可获得较好的疗效,并且在去除心铁负荷方面有显著作用。本研究结果还显示,治疗12个月后,3组患者肝MRI T2*值比较,总体差异无统计学意义(F=2.423,P=0.099)。究其原因,可能是由于样本量不足影响统计学结果。此外,两两比较结果显示,联合用药组患者治疗12个月后,肝MRI T2*值较去铁胺、去铁酮组升高,并且差异有统计学意义(P<0.05),这提示去铁胺联合去铁酮在去除肝铁负荷方面仍存在一定优势,但其具体疗效,仍需扩大样本量的进一步随机对照研究证实。
综上所述,相对于去铁胺、去铁酮单药治疗,去铁胺联合去铁酮治疗重型β-地中海贫血铁过载患者的疾病控制效果更佳。该方法能有效降低患者血清SF值,并且减轻铁过载对心、肝等机体器官造成的铁负荷,但是由于本研究为回顾性研究,样本量较小,该方法的有效性及安全性仍需要多中心、大样本量研究进一步验证。
所有作者均声明不存在利益冲突



























