
回顾性分析11个家系PCDH19基因突变相关癫痫的临床和遗传学特点。
对2013年3月至2019年7月郑州大学第三附属医院小儿神经内科确诊的11个家系共13例PCDH19基因突变相关癫痫患者的临床表现和基因突变特点进行分析。
1.PCDH19基因突变结果:11例先证者中,10例携带PCDH19基因点突变,1例为5号外显子缺失。1例男性患儿为PCDH19基因突变嵌合体,为c.840C>A,变异比例为34.27%。家系分析,11例先证者中5例为遗传性突变,6例为新发突变。5例遗传性突变中3例为父源遗传,父亲为无临床症状的半合子;2例为母源遗传,其中1例为患者,1例为表型正常的携带者。2.临床特点:13例中,女12例,男1例。起病年龄均<2岁,临床表型包括:癫痫伴智力低下9例(其中Dravet综合征3例),癫痫不伴智力低下4例。在同一家系内携带相同PCDH19基因突变的女性表型具有明显异质性,少数女性(2例)可不发病。13例癫痫发作均具有丛集性特点,12例有热敏性特点,仅3例有癫痫持续状态。13例中,仅2例达到2年以上无发作,表现为Dravet综合征的3例先后予6~8种抗癫痫药物治疗,仍有频繁发作。
PCDH19基因突变相关癫痫受累者以女性为主,少数男性嵌合体可发病,具有明显的表现异质性,丛集性发作和热敏感为其主要临床特点,多伴智力损伤。PCDH19基因突变可为遗传性突变或新生突变,多数为点突变。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
限于女性的癫痫伴智力低下(epilepsy and mentalretardation limited to females,EFMR)是一种起病于婴儿期和儿童早期的癫痫,发作形式多样、发作具有热敏性和丛集性特点,并可出现认知落后,仅累及女性的癫痫综合征。2008年澳大利亚Dibbens等[1]首先报道本病的致病基因是PCDH19,是一种特殊类型的X连锁遗传的癫痫,通常女性杂合子发病,男性携带者不发病,之后发现男性嵌合体也可发病[2]。国内该基因突变的病例报道较少,本研究对2013年3月至2019年7月郑州大学第三附属医院确诊的PCDH19基因突变相关癫痫患儿进行临床和基因突变特点分析,为临床早期识别该病提供依据。
入选对象为2013年3月至2019年7月在郑州大学第三附属医院小儿神经内科就诊并通过基因检查确诊为PCDH19基因相关癫痫的11个家系共13例患者。其中女12例,男1例,9例为散发患儿,2例有家族史。本研究通过医院医学伦理委员会批准[(2017)医伦审第10号],患儿监护人均签署知情同意书。
总结先证者及家系受累成员的临床表现、辅助检查结果[包括头颅磁共振成像(MRI)、脑电图、基因检测结果]、抗癫痫药物(antiepileptic drugs,AEDs)用药史。
采用靶向捕获二代测序(next generation sequencing,NGS)法筛查先证者PCDH19基因突变,并进行家系来源验证。如测序未发现PCDH19基因突变,高度考虑有大片段缺失的情况下,则进一步采用多重连接依赖的探针扩增技术(multiplex ligation-dependent probe amplification,MLPA)方法筛查PCDH19基因的大片段缺失或重复。如发现未报道过的新突变,则对100例健康对照DNA进行该突变的检测,以排除多态性。
11例先证者中,通过测序证实10例携带PCDH19基因点突变,通过MLPA检测发现1例为5号外显子缺失。10例点突变中仅1例为已报道的突变,9例为新突变。1例男性患儿经NGS检测为PCDH19基因突变嵌合体,为c.840C>A,突变占比为34.27%。结果见表1。

11例先证者PCDH19基因突变的基因型特点
Genotypic characteristics of 11 cases of proband with PCDH19 gene mutation
11例先证者PCDH19基因突变的基因型特点
Genotypic characteristics of 11 cases of proband with PCDH19 gene mutation
| 患儿编号 | 外显子 | PCDH19基因突变 | 氨基酸改变 | 蛋白功能预测 | 突变是否已报道 | 家系验证来源 |
|---|---|---|---|---|---|---|
| 1 | 外显子1 | c.1019A>G | p.Asn340Ser | 可能致病 | 是 | 母源 |
| 2 | 外显子5 | c.2749_2750del | p.Ser917Ter | 可能致病 | 否 | 父源 |
| 3 | 外显子1 | c.344T>A | p.Ile115Lys | 可能有害 | 否 | 父源 |
| 4 | 外显子1 | c.463G>T | p.Asp155Tyr | 可能致病 | 否 | 新发突变 |
| 5 | 外显子5 | 5号外显子缺失 | - | 致病 | 否 | 未做家系验证 |
| 6 | 外显子1 | c.1639G>A | p.Ala547Thr | 临床意义未明 | 否 | 母源 |
| 7 | 外显子1 | c.840C>A(嵌合体,比例34.27%) | p.Tyr280Hyp | 致病 | 否 | 新生变异 |
| 8 | 外显子6 | c.2872C>T | p.Arg958Trp | 可能致病 | 否 | 父源(姐姐杂合,表型正常) |
| 9 | 外显子1 | c.953C>A | p.Ala318>Asp | 可能致病 | 否 | 新发突变 |
| 10 | 外显子1 | c.1605_1612del | p.Lys536fs | 致病 | 否 | 新发突变 |
| 11 | 外显子1 | c.2110A>T | p.Lys704Ter | 致病 | 否 | 新发突变 |
家系分析:11例先证者中5例为遗传性突变(45.5%),6例为新发突变(54.5%)。5例遗传性突变中3例为父源遗传,父亲为临床无症状的半合子;2例为母源遗传,家系1母女均为癫痫患者,家系6母亲为表型正常的携带者,家系8姐姐为表型正常的携带者。结果见表1。
13例患者(11例先证者和先证者1的母亲、先证者2的姐姐)中,女12例,男1例,起病年龄6个月~1岁10个月。临床表现包含癫痫伴智力低下9例(含Dravet综合征3例),癫痫不伴智力低下4例(目前智力运动发育正常,但因年龄尚小,需进一步随访),其中2个家系(家系1母女同患癫痫,家系2姐妹同患癫痫)的患者携带相同的PCDH19基因突变,表现却不同,家系1母亲为轻度智力低下,女儿符合Dravet综合征表型,严重智力低下;家系2姐姐智力正常,仅表现为局灶性发作,妹妹表现为Dravet综合征,严重智力低下。结果见表2。
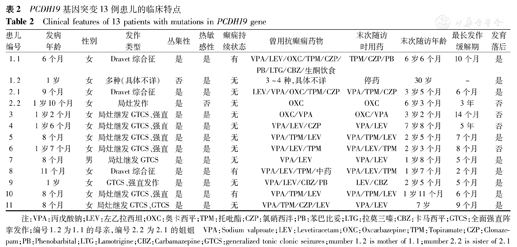
PCDH19基因突变13例患儿的临床特点
Clinical features of 13 patients with mutations in PCDH19 gene
PCDH19基因突变13例患儿的临床特点
Clinical features of 13 patients with mutations in PCDH19 gene
| 患儿编号 | 发病年龄 | 性别 | 发作类型 | 丛集性 | 热敏感性 | 癫痫持续状态 | 曾用抗癫痫药物 | 末次随访时用药 | 末次随访年龄 | 最长发作缓解期 | 发育落后 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1.1 | 6个月 | 女 | Dravet综合征 | 是 | 是 | 有 | VPA/LEV/OXC/TPM/CZP/PB/LTG/CBZ/生酮饮食 | TPM/CZP/PB | 6岁6个月 | 10个月 | 是 |
| 1.2 | 1岁 | 女 | 多种(具体不详) | 否 | 是 | 无 | 3~4种,具体不详 | 停药 | 30岁 | - | 是 |
| 2.1 | 9个月 | 女 | Dravet综合征 | 是 | 是 | 无 | LEV/VPA/OXC/TPM/CZP | VPA/TPM/CZP | 3岁5个月 | 6个月 | 是 |
| 2.2 | 1岁10个月 | 女 | 局灶发作 | 是 | 否 | 无 | OXC | OXC | 6岁3个月 | 3年 | 否 |
| 3 | 1岁2个月 | 女 | 局灶继发GTCS、强直 | 是 | 是 | 无 | OXC/VPA | OXC/VPA | 3岁2个月 | 14个月 | 否 |
| 4 | 1岁6个月 | 女 | 局灶继发GTCS、强直 | 是 | 是 | 无 | VPA/LEV/CZP | VPA/LEV | 7岁8个月 | 5年 | 否 |
| 5 | 8个月 | 女 | 局灶继发GTCS、强直 | 是 | 是 | 无 | VPA/TPM/LEV | VPA/TPM/LEV | 2岁5个月 | 7个月 | 是 |
| 6 | 1岁7个月 | 女 | 局灶继发GTCS、强直 | 是 | 是 | 无 | VPA/LEV/TPM | VPA/LEV/TPM | 2岁3个月 | 8个月 | 否 |
| 7 | 8个月 | 男 | 局灶继发GTCS | 是 | 是 | 无 | VPA/LEV | VPA/LEV | 1岁8个月 | 5个月 | 是 |
| 8 | 11个月 | 女 | Dravet综合征 | 是 | 是 | 有 | VPA/LEV/TPM/中药 | VPA/LEV/TPM | 1岁7个月 | 2个月 | 是 |
| 9 | 1岁 | 女 | GTCS、强直发作 | 是 | 是 | 无 | VPA/LEV/CBZ/PB | LEV/CBZ | 2岁5个月 | 5个月 | 是 |
| 10 | 8个月 | 女 | 局灶继发GTCS、强直 | 是 | 是 | 有 | VPA/TPM/LEV | VPA/TPM/LEV | 1岁11个月 | 6个月 | 是 |
| 11 | 8个月 | 女 | 局灶继发GTCS、GTCS | 是 | 是 | 无 | VPA/TPM/CZP/LEV | VPA/LEV | 7岁 | 9个月 | 是 |
注:VPA:丙戊酸钠;LEV:左乙拉西坦;OXC:奥卡西平;TPM:托吡酯;CZP:氯硝西泮;PB:苯巴比妥;LTG:拉莫三嗪;CBZ:卡马西平;GTCS:全面强直阵挛发作;编号1.2为1.1的母亲,编号2.2为2.1的姐姐 VPA:Sodium valproate;LEV:Levetiracetam;OXC:Oxcarbazepine;TPM:Topiramate;CZP:Clonazepam;PB:Phenobarbital;LTG:Lamotrigine;CBZ:Carbamazepine;GTCS:generalized tonic clonic seizures;mumber 1.2 is mother of 1.1;mumber 2.2 is sister of 2.1
13例均具有丛集性特点,12例有热敏性特点,仅3例有惊厥持续状态。结果见表2。
12例(先证者1的母亲除外)行脑电图检查,急性期(丛集性发作期间或发作结束后24 h内)均有背景活动慢波,4例智力正常者急性期后脑电图背景恢复正常;11例监测到临床发作,9例监测到局灶性起源泛化为双侧全面强直阵挛发作;先证者行头颅MRI检查,均未发现异常。结果见表2。
13例患者的末次随访年龄为1岁7个月~30岁。例1曾先后应用7种AEDs及生酮饮食均无明显效果,发作缓解期最长为10个月,现已6岁6个月,1年来发作逐渐稀少,可独走、独跑,平衡性较差,仅会说2个字的短语,智力重度障碍,其母亲曾应用丙戊酸钠、苯巴比妥等3种药物(具体不详),发作减少,13岁后未再发作,16岁左右停药,智力轻度低下,运动无异常;例2也符合Dravet综合征表型,先后应用6种AEDs均无明显效果,目前发作间期约1个月,智力重度障碍,其姐姐有过2次丛集性发作,予奥卡西平控制,已3年余无发作,现6岁3个月,智力正常,其祖母幼时曾有癫痫发作,具体不详;例3自9月龄至3岁3月龄有3次丛集样发作,予2种AEDs,现有14个月无发作,目前智力正常,其祖母幼时曾有抽搐发作,具体不详;例4予2种AEDs 5年无发作,减药过程中发作后再次加用,近1年无发作,现智力运动均正常;例5、6、7均予2种AEDs,近7~8个月无发作;例8先后予3种AEDs,现仍有发作,最长间隔2个月;例9先后予4种AEDs(未规律用药),现口服卡马西平和左乙拉西坦,近5个月无发作;例10先后3种AEDs,曾有6个月无发作;例11先后给予4种AEDs,现仍有发作,5岁后发作逐渐减轻。
PCDH19基因位于染色体Xq22.1,编码原钙黏蛋白19,属于原钙黏蛋白δ2亚家族一员,有6个外显子,其中第1外显子很大,编码6个胞外域,因此大多数PCDH19基因突变发生在第1外显子[1,3,4]。目前已发现162种PCDH19基因突变类型,包括错义突变、无义突变、碱基缺失或插入突变、剪切位点突变,部分外显子甚至整个基因的缺失或重复[5,6,7],其中c.1019A>G,p.Asn340Ser杂合突变是最常见的错义突变[3],本研究病例1就属于此突变。尽管PCDH19基因突变首先由Dibbens等[1]在限于女性的癫痫伴智力落后家系中报道,但大多报道认为其以新生突变为主,约占50%上[3]。本研究发现11例先证者中6例为新发突变,占54.5%,与既往报道[3,8]类似;5例为遗传性突变,占45.5%(5/11例),5例遗传性突变中3例来自于无临床症状的父亲,2例来自于母亲。
PCDH19基因突变相关癫痫是一种特殊的X连锁遗传方式的癫痫,携带PCDH19基因突变的杂合子女性受累,半合子男性不受累[2],但具有基因突变嵌合体的男性可受累[2]。目前大多数研究认为这种特殊遗传方式为"细胞干扰"机制,即只有PCDH19基因突变细胞和野生细胞共存,才会出现临床症状[9,10]。最新报道的1例Klinefelter综合征(47,XXY)男童同时患PCDH19基因突变相关癫痫也更加支持了"细胞干扰"机制[11]。本研究1例男性患者为PCDH19基因突变嵌合体,同样可用"细胞干扰"机制解释。目前,世界上共有200多例女性患者和10例男性患者被报道,共同的临床特点为:起病较早(6~70个月),具有多种癫痫发作类型(局灶性发作、局灶进展为双侧的强直阵挛发作、强制阵挛发作、强直发作、阵挛发作、肌阵挛发作、失神发作等),发作呈丛集性,并具有热敏性,伴或不伴智力低下,抗癫痫药物治疗困难,可合并精神行为问题,包括孤独症、注意缺陷多动障碍、强迫性或攻击性行为等[3,12,13]。本研究中12例发作均有热敏性、丛集性发作特点,这提示,当遇到婴儿期起病的以热敏性和丛集性发作为特点的癫痫,尤其是女性患者时,需要高度警惕该基因突变。PCDH19基因相关癫痫具有外显率不全和表型异质性特点[14],本研究中也发现了癫痫伴智力低下(含Dravet综合征),癫痫不伴智力低下及无症状携带者的表型。另有研究发现,患者癫痫首次发作年龄与智力低下水平相关,12个月龄以前的癫痫发作患者智力低下更加明显[2,15,16],本研究中3例表现为Dravet综合征者均起病于1岁前,4例目前智力正常的患者起病均于1岁后,与该研究结果一致。
PCDH19基因突变相关性癫痫多具有药物难治性,但一项多中心研究认为,10岁以后癫痫发作频率会逐渐降低[16]。此类癫痫单药通常控制不佳,生酮饮食和皮质激素治疗部分有效[17],本研究中仅1例只应用奥卡西平控制,2例用2种药物,余均尝试多种AEDs治疗。该基因突变所致的癫痫,虽然表现为热敏性难治性癫痫,也可以出现Dravet综合征表型,但与SCN1A基因突变所致的Dravet综合征有所不同[18,19],钠离子通道阻滞剂不加重发作,甚至可能有一定的效果,本研究中1例患者仅用奥卡西平控制发作,另1例患者奥卡西平和丙戊酸钠联用已有1年余无发作。
随着基因测序技术的发展,越来越多的PCDH19基因突变患者被发现,对此病的基因型及表型的认识也更加深入,可以更早的将之从热敏性癫痫患者中识别出来,给予更合理的治疗,并指导遗传咨询和产前诊断。
所有作者均声明不存在利益冲突



























