
与成人相比,儿童甲状腺肿瘤在生物学特性、临床特点及长期预后方面存在明显差异。更为重要的是,研究表明针对成人患者的治疗措施并不能完全适用于儿童。对于儿童甲状腺肿瘤患者,治疗不足和治疗过度均会对其造成更长期的伤害。在2015年美国发布的《儿童甲状腺结节和分化型甲状腺癌管理指南》中,明确指出儿童不是成人的缩小版。然而,国内现有甲状腺结节和甲状腺癌的指南和专家共识均是针对成人患者。为提高我国对儿童甲状腺肿瘤的诊治水平,促进诊疗规范化,制定本共识。共识内容包含儿童甲状腺结节和分化型甲状腺癌的临床特点、系统评估、外科治疗、131I治疗、内分泌治疗、肿瘤分期、术后危险度分级和随访等相关的40条推荐意见,并对这些意见的推荐强度进行了分级。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
儿童甲状腺结节的发病率远低于成人。有国内资料统计,中国儿童及青少年甲状腺癌的年发病率约为0.44/10万,死亡率约为0.02/10万[1]。根据美国国立癌症研究所监测、流行病学和结果数据库(the surveillance,epidemiology,and end results,SEER)的数据,儿童和青少年甲状腺癌年发病率为0.54/10万[2],然而其发病率在逐年上升:1973年至2006年年增长约1.1%[3,4],而2006年至2013年年增长率急剧上升至9.5%[4]。与之类似,北京儿童医院资料显示,2006年至2017年甲状腺癌住院手术患儿逐年上升,10年时间提高3倍以上[5]。因此,甲状腺癌已成为儿童及青少年中较为常见的恶性肿瘤之一。在性别上,青春期前男、女患病比例相似,青春期后男、女患病比例约为1∶4[2,6]。值得关注的是,儿童甲状腺结节恶性风险比例远高于成人[7,8],成人中的恶性率仅为5%~10%[9],而儿童甲状腺结节恶性率可高达22%~26%[10,11]。
儿童分化型甲状腺癌(differentiated thyroid cancer,DTC)包括乳头状癌(papillary thyroid carcinoma,PTC)及滤泡状癌(follicular thyroid carcinoma,FTC)。其中PTC所占比例最高(90%以上),而FTC并不常见。儿童PTC包括经典型、滤泡型、实体型、弥漫硬化型。与成人相比,儿童PTC弥漫硬化型占比较高。儿童FTC的组织学变异包括Hürthle细胞型、透明细胞型和孤立型。甲状腺髓样癌(medullary thyroid carcinoma,MTC)及未分化癌(anaplastic thyroid carcinoma,ATC)在儿童中十分罕见,因此本共识主要针对儿童DTC的诊治。
儿童甲状腺癌在分子、病理和临床表现上均与成人存在较大差异。儿童和青少年PTC存在多灶性、侵袭性强等特点,极易向甲状腺包膜外侵犯,直接累及喉返神经(recurrent laryngeal nerve,RLN)、气管、血管及食道等。并且,儿童PTC在诊断时存在淋巴结转移和远处转移的概率更高,可达40%~80%,术后复发率也更高[12]。与之相反,FTC主要表现为单灶病变,其血行转移至肺组织及骨组织常见,而局部淋巴结转移较为少见。然而,经过规范化治疗后,儿童DTC仍可能获得良好预后。
基于儿童甲状腺结节具有不同于成人的特点,2015年Thyroid发表了美国甲状腺协会(American Thyroid Association,ATA)儿童甲状腺指南编写工作组所制定的儿童甲状腺结节及DTC指南。但截至目前,我国尚没有针对儿童甲状腺结节的指南或共识性文件。为给中国儿童甲状腺结节及DTC的诊疗及管理提供依据,参考国内外的最新指南及最新研究成果,组织头颈外科(甲状腺外科)、内分泌科、核医学科、超声及影像科等相关领域专家充分讨论,制订本共识。
由于人体在18岁前完成生长发育,并且目前多数研究数据是基于儿童与青少年作为一个整体的分析,因此本共识将年龄上限定为18岁。但考虑到生长发育和生理变化对肿瘤生物学行为的影响,本共识重点适用于14岁以下儿童,青少年期患者可综合参考本共识和成人指南进行处理。
本《专家共识》根据循证医学证据和专家意见对中国儿童甲状腺结节及DTC提出推荐意见,推荐级别设定标准见表1。
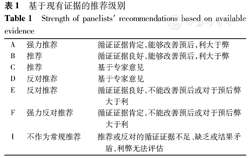
基于现有证据的推荐级别
Strength of panelists′ recommendations based on available evidence
基于现有证据的推荐级别
Strength of panelists′ recommendations based on available evidence
| A | 强力推荐 | 循证证据肯定,能够改善预后,利大于弊 |
| B | 推荐 | 循证证据良好,能够改善预后,利大于弊 |
| C | 推荐 | 基于专家意见 |
| D | 反对推荐 | 基于专家意见 |
| E | 反对推荐 | 循证证据良好,不能改善预后或对于预后弊大于利 |
| F | 强力反对推荐 | 循证证据肯定,不能改善预后或对于预后弊大于利 |
| I | 不作为常规推荐 | 推荐或反对的循证证据不足、缺乏或结果矛盾,利弊无法评估 |
甲状腺结节是甲状腺一组不同临床疾病的表型总称,包括孤立性结节、多结节性甲状腺肿、自身免疫性甲状腺结节等。另外,甲状腺发育不全及甲状舌管囊肿引起的先天性甲状腺功能减退、桥本甲状腺炎(Hashimoto thyroiditis,HT)、辐射及一些甲状腺受累相关遗传综合征等均与儿童甲状腺结节有关。甲状腺自身免疫与癌之间的关系不明。一项自身免疫性甲状腺疾病(autoimmune thyroid disease,AITD )患儿的研究显示,31.5%的患儿有甲状腺结节,而结节中9.6%诊断为甲状腺癌,但在≥1 cm的结节中甲状腺癌比例高达20%。有关儿童甲状腺结节的恶性率研究中,不同文章的报道有所不同,总体平均约为26.4%[13]。但近年来越来越多的证据表明,HT患儿甲状腺结节的恶性率较不伴HT的儿童甲状腺结节高(35%比26%),可能与碘状态(过量的碘摄入)、较高的促甲状腺激素(thyrotropin,TSH)浓度、基因重排等有关[14,15]。
推荐1:对儿童、青少年甲状腺结节的评估需要结合临床资料、体格检查、实验室检查、甲状腺超声及细针抽吸活检等进行综合判断(推荐级别:C)。
推荐2:所有甲状腺结节患儿就诊时均应详细询问颈部放射线接触史、碘摄入情况、甲状腺既往病史及家族遗传史(推荐级别:A)。
病史包括是否来自高碘或缺碘地区,有无甲状腺癌家族史,颈部放射线暴露史及是否存在自身免疫性甲状腺炎病史。需特别注意的是包含甲状腺结节及甲状腺癌表现的遗传综合征,如APC相关性息肉病、家族性肿瘤易感综合征、Carney综合征、DICER1综合征、PTEN错构瘤肿瘤综合征和Werner综合征等。
推荐3:所有甲状腺结节患儿病史中要包括是否存在颈部肿块、吞咽困难、发声障碍、甲状腺功能亢进等症状及其持续时间(推荐级别:A)。
推荐4:所有就诊的甲状腺结节患儿,仔细的体格检查是必需的,包括甲状腺情况、结节情况、淋巴结情况及声带活动情况的检查(推荐级别:A)。
甲状腺肿瘤生长缓慢,绝大多数无特异性临床症状,最常见的首发症状为无痛性颈部肿块。也有小部分以远处转移为唯一首发症状。当触及质硬甲状腺结节或肿大淋巴结及出现压迫、侵袭表现时提示恶性可能性大。儿童淋巴结病变较成人更常见,为儿童甲状腺恶性肿瘤最重要的表现,可出现在80%的病例中,但这并不意味预后不良[12]。
推荐5:推荐所有甲状腺结节患儿进行甲状腺超声检查(推荐级别:A)。
甲状腺超声是甲状腺结节诊断和术后随访的常用手段,是评估结节数量、大小、特征和有无淋巴结转移的首选影像检查[16]。可以指导甲状腺细针抽吸活检(fine needle aspiration biopsy,FNAB),提高穿刺精准性,监测甲状腺切除术后切缘和淋巴结,具有无创、可重复、低成本的优势,但对操作者经验依赖性较强。
儿童DTC的超声特征与成人存在差异,高度怀疑恶性的重要指标包括微钙化、可疑淋巴结及边缘不规则,而成人特异性最高的超声特征为边缘不规则、微钙化及纵横比>1[13,16,17]。纵横比>1在成人诊断中特异性高,在儿童中文献报道较少。低回声特征在诊断成人和儿童甲状腺癌中特异性均不高。儿童及青少年弥漫硬化型PTC所占比例远高于成人,可表现为一侧叶或整个腺体弥漫性肿大,如发现微钙化及可疑颈部淋巴结,则高度提示PTC[18]。若超声提示完全囊性、高回声、边缘规则及边缘血流结节,则良性病变可能性大[16,19]。可疑淋巴结特征包括淋巴结大、变圆、淋巴门消失、强回声、囊性变、微钙化及血流增加,其中微钙化、血流增加的特异性最高,但敏感度均不高。需要指出的是,任何单独一个超声特征的敏感度都不足以评估甲状腺结节的性质及判定淋巴结是否转移[20]。
推荐6:有头颈部辐射暴露史的高危儿童,推荐行甲状腺超声筛查(推荐级别:C)。
发生甲状腺结节的高危人群之一为接受放射治疗的儿童癌症患者,尤其是霍奇金淋巴瘤、白血病和中枢神经系统肿瘤患儿。甲状腺结节在癌症患者中以每年约2%的速度发展,并在暴露后15~25年达到高峰,其中许多结节只能由超声发现。尤其是小年龄患儿在剂量达到20~29 Gy的放射治疗后风险最大。高分辨率超声可以发现小的亚临床甲状腺肿瘤,推荐对这类患儿行甲状腺超声筛查。然而,本推荐基于专家经验,尚没有足够的研究数据表明通过超声和FNAB早期发现甲状腺肿瘤可以延长患者生存时间。
推荐7:不推荐电子计算机断层扫描(CT)作为甲状腺结节的常规检查,也不推荐其作为除外肺部转移的常规方法(推荐级别:D)。
对于甲状腺结节较大、声带麻痹、有巨大转移性淋巴结、考虑病灶侵犯气管或食管等周围结构的患者,CT检查可协助进行解剖学定位和优化手术方案。为不影响术后的131I显像检查和131I治疗,CT检查应尽量避免使用含碘造影剂。此外,不推荐也不反对胸部CT检查以除外肺部转移,可以通过术后刺激性甲状腺球蛋白(thyroglobulin,Tg)水平监测及术后全身诊断性扫描(DxWBS)来替代。另外,CT检查优于磁共振成像(MRI)检查的特点是其成像速度快,对于低龄患儿可以避免镇静药的使用。但由于存在放射线暴露的问题,儿童及青少年应慎行颈部CT检查[10]。
推荐8:对于侵犯范围较大的甲状腺肿瘤,推荐增强MRI作为制定手术方案的辅助检查(推荐级别:C)。
一般不推荐MRI作为甲状腺结节的常规检查。其作用与CT类似,可以为局部侵犯较重或淋巴结转移较多病例提供术前影像学支持,缺点是与CT检查相比,其费用高及成像时间长。但因其无辐射,推荐增强MRI作为广泛局部侵犯及淋巴结转移患儿术前影像学评估方法。
推荐9:不推荐放射性核素扫描检查作为儿童甲状腺结节常规诊断方法(推荐级别:E)。
受显像仪分辨率所限,甲状腺核素显像适用于评估直径>1 cm的甲状腺结节。在甲状腺结节伴血清TSH水平降低时,甲状腺131I核素显像可判断结节是否有自主摄取功能("热结节")。组织学评估发现在这些"热结节"中绝大部分为良性,一般不需要行FNAB,但可有1%~5%的患者为PTC。在儿童及青少年患者中,核素显像一般用于甲状腺功能亢进合并甲状腺结节患者的检查,以及检测异位甲状腺,不作为甲状腺结节的常规检查方法[10]。
同样,有研究表明,放射性核素2-氟-2-脱氧-D-葡萄糖(18F-FDG)正电子发射计算机断层显像(PET/CT)检查诊断甲状腺癌的敏感性、特异性、阳性预测值及阴性预测值分别为77%、62%、57%、81%,与超声相比并没有增加诊断的准确性,而且并非所有的甲状腺恶性结节都会摄取18F-FDG,而某些良性结节也会摄取,因此单纯依靠18F-FDG PET/CT显像不能准确鉴别甲状腺结节的良恶性[21]。
推荐10:推荐FNAB作为术前诊断甲状腺结节性质及可疑淋巴结的常规方法(推荐级别:A)。
FNAB是术前诊断儿童甲状腺结节性质的最佳方法[22,23,24]。普遍认为FNAB适用于甲状腺功能正常或低下、结节最大径>1 cm和超声特征提示可疑甲状腺癌的患儿。然而,由于结节大小会随年龄增长而变化,在儿童中以结节大小作为评估标准具有不确定性[10]。虽然结节最大径<1 cm,如多个证据提示恶性病变可能时,仍需考虑进行FNAB[25]。当存在危险因素,如头颈胸部辐射暴露、甲状腺癌家族史、颈部可疑淋巴结时,推荐行FNAB。
本共识推荐:(1)儿童及青少年甲状腺结节需根据结节大小、超声及临床特征综合评判。(2)鉴于儿童恶性结节的比例较高和再次获取样本的潜在困难,FNAB均应在超声引导下进行。(3)高功能结节无须术前行FNAB。(4)当FNAB结果为细胞学不确定,意义不明确的细胞非典型增生性病变或滤泡性病变时,不推荐重复行FNAB,建议行甲状腺腺叶加峡部切除,术中行冰冻病理检查。每一份甲状腺FNAB结果均形成Bethesda诊断系统报告[26,27,28](表2)。
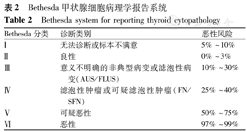
Bethesda甲状腺细胞病理学报告系统
Bethesda system for reporting thyroid cytopathology
Bethesda甲状腺细胞病理学报告系统
Bethesda system for reporting thyroid cytopathology
| Bethesda分类 | 诊断类别 | 恶性风险 |
|---|---|---|
| Ⅰ | 无法诊断或标本不满意 | 5%~10% |
| Ⅱ | 良性 | 0%~3% |
| Ⅲ | 意义不明确的非典型病变或滤泡性病变(AUS/FLUS) | 10%~30% |
| Ⅳ | 滤泡性肿瘤或可疑滤泡性肿瘤(FN/SFN) | 25%~40% |
| Ⅴ | 可疑恶性 | 50%~75% |
| Ⅵ | 恶性 | 97%~99% |
推荐11:推荐甲状腺功能、Tg及甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)作为甲状腺结节术前常规检查,且建议两者同时检测作为初始临床状态及血清学指标基线评估(推荐级别:A)。
甲状腺功能,包括甲状腺激素T3、T4和TSH,可反映甲状腺功能,但不能鉴别甲状腺结节的良恶性。TGAb和抗甲状腺过氧化物酶抗体滴度升高提示甲状腺炎,不能排除恶性病变[10,27]。应警惕,青春期早期少女雌激素对免疫系统的诱导会影响TGAb的水平,同时应注意自身免疫性甲状腺炎患者存在肿瘤性病变的可能。
推荐12:不推荐也不反对分子诊断作为儿童甲状腺癌辅助诊断方法(推荐级别:I)。
在细胞学诊断不明确的病例中,RAS、BRAF、RET/PTC、PAX8/PPARg基因突变均与恶性病变相关,可将FNAB检查的阳性预测值提高近100%,总体敏感性和特异性提高至80%和100%[10]。因此,分子检测联合细胞学检测可以提高FNAB检查的阳性预测值,减少二次手术所致的并发症风险。但并非所有的甲状腺癌都有可检测的基因突变,阴性结果并不足以排除恶性。另外,由于儿童PTC分子病理学特征呈更高的基因重排率及更低的原癌基因点突变率,且其突变谱及突变频率均异于成人,分子诊断的有效性还未得到充分验证,是未来研究的重要方向。
推荐13:儿童甲状腺肿瘤的诊疗需由有经验的甲状腺外科、内分泌、核医学、超声及影像、病理科等专家共同进行(推荐级别:C)。
儿童DTC的诊断和治疗应该在相关学科健全的医疗中心进行。至少需具备有丰富甲状腺手术经验的专科医师、核医学专家、内分泌学专家、重症监护室、超声及影像专家、儿科麻醉医师、病理学专家等。高度重视治疗过度或治疗不足所带来的危害。手术应该由具有丰富甲状腺手术经验的专科医师进行。
推荐14:推荐对FNAB证实为良性、最大径≤4 cm的甲状腺结节进行定期超声随访,当超声检查异常时行甲状腺腺叶加峡部切除术(推荐级别:B)。
FNAB结果为良性征象,最大径≤4 cm时,推荐在6~12个月复查超声,包括甲状腺超声和颈部淋巴结超声。若结节稳定,则每隔1~2年复查超声;若结节增大或出现新的可疑超声特征,考虑结节中存在甲状腺癌的风险,应再次行FNAB。考虑到儿童甲状腺结节恶性风险较成人高,若FNAB结果为意义不明确或可疑,则推荐手术,通常为甲状腺腺叶加峡部切除术[12,19,22]。
推荐15:最大径>4 cm的良性实性结节,生长趋势明显的甲状腺结节及高功能腺瘤推荐行甲状腺腺叶加峡部切除术(推荐级别:A)。
甲状腺高功能腺瘤(毒性甲状腺腺瘤)在儿童中并不少见[12,22],其诊断依靠抑制TSH试验和核医学放射性核素扫描。对于成人患者,高功能性结节的治疗选择包括131I消融、手术切除或乙醇注射[12]。由于放射性碘治疗在儿童的安全性方面存在风险,手术切除应作为儿童患者的首选方法。
推荐16:既不推荐也不反对常规使用左甲状腺素(Levothyroxine,L-T4)治疗儿童良性甲状腺结节(推荐级别:I)。
约30.6%的儿童良性甲状腺结节在L-T4治疗后体积减小50%[29],但其临床价值尚不明确。对于有压迫症状或有辐射暴露史的患者,L-T4治疗的获益可能更大。关于L-T4治疗的长期安全性和潜在不良反应的数据有限[29]。需警惕儿童甲状腺切除术后出现甲状腺功能减退,特别是亚临床甲状腺功能减退,会影响儿童生长发育和心智成熟。但迄今为止仍然缺乏关于L-T4治疗影响的长期研究,特别是对非自身免疫性亚临床甲状腺功能减退症患儿的研究。因此,既不推荐也不反对常规使用L-T4治疗儿童良性甲状腺结节,这与成人指南一致[12,22]。同时应该强调,与成人患者相比,儿童患者出现的内分泌相关并发症更多,因此需要儿童内分泌医师协助制定诊疗方案。
推荐17:儿童DTC的治疗目标是维持低疾病相关死亡率,降低治疗相关潜在并发症发生率(推荐级别:B)。
推荐18:推荐甲状腺全切除术作为DTC首选治疗,对于部分局限于单侧腺体内且不伴有淋巴结转移的肿瘤可选择行腺叶/腺叶加峡部切除(推荐级别:A)。
以往手术方式选择存在争议,包括甲状腺全切除术、甲状腺近全切除术、甲状腺腺叶加峡部切除术及甲状腺腺叶切除术等[12,22]。部分专家认为甲状腺全切除术的风险大于甲状腺近全切除术,且甲状腺全切除及甲状腺近全切除术后均需要甲状腺激素的替代治疗,倾向于相对保守的切除范围[30]。近年来的研究认为,儿童DTC双侧或多灶性肿瘤比例较高(分别为30%和65%),进行部分切除后复发需再次手术的风险明显增加[30,31,32,33,34,35,36],因此,本共识建议对于儿童DTC,首选甲状腺全切除术。对于部分单侧病变、肿瘤局限于腺体内且无颈部淋巴结转移的病例,可选择行腺叶加峡部切除术[32],但术后需密切随访监测对侧腺叶及颈部淋巴结情况。有放射线暴露史或家族史等高危因素的儿童,建议行甲状腺全切除术[12,22]。
推荐19:推荐对于存在明显腺体外侵犯,或发现存在中央区淋巴结转移的患儿,常规行中央区淋巴结清扫(推荐级别:B)。
影响DTC患儿无病生存的危险因素包括:年龄(<16岁)、甲状腺癌家族史、术前淋巴结转移、肿瘤直径及腺体外浸润。已有研究证实术前淋巴结转移和远处转移与甲状腺癌特异性生存率相关[12,22],对存在明显腺体外侵犯,术前或术中发现存在中央区淋巴结转移的患儿,应行中央区淋巴结清扫。
推荐20:推荐对无明显淋巴结转移证据患儿行同侧预防性中央区淋巴结清扫术(推荐级别:C)。
对于中央区淋巴结转移证据不足的患儿,预防性中央区清扫存在争议。有研究表明,甲状腺全切合并预防性颈淋巴结清扫患儿的10年生存率显著提高。但也有相反的证据显示,对于一组甲状腺全切加131I治疗的患儿,任何类型的淋巴结清扫均不会对局部复发及远处转移产生影响。考虑到儿童甲状腺癌较高的术后复发率,且复发后再手术难度显著提高,参考我国成人指南建议及专家经验[10,12,20,22],推荐儿童行常规预防性同侧中央区淋巴结清扫。
推荐21:推荐颈部淋巴结清扫术采用基于淋巴结分区的彻底清扫,而非"摘草莓"式的切除(推荐级别:A)。
基于淋巴结分区的彻底清扫可以大幅降低术后局部复发率及淋巴结复发率[12,22]。此推荐与成人甲状腺癌处理理念相同。
推荐22:单侧甲状腺局灶癌变,推荐先行同侧中央区淋巴结清扫,根据术中情况决定是否再行对侧中央区清扫(推荐级别:C)。
对于单侧甲状腺癌局灶病变,不伴甲状腺外侵犯和/或局部转移的患儿,推荐行同侧预防性中央区淋巴结清扫以减少复发。结合术前评估及术中情况,若患侧Ⅵ区有转移,推荐对侧Ⅵ区预防性清扫,若患侧Ⅵ区转移未获证实,则不推荐也不反对对侧预防性中央区清扫[31,32,35]。
推荐23:只有当影像学或FNAB提供明确转移证据时,才应进行颈侧区淋巴结清扫,且其清扫范围不应小于Ⅱ、Ⅲ、Ⅳ和Ⅴb区(推荐级别:B)。
超声提示可疑淋巴结转移的特征包括淋巴结大、变圆、淋巴门消失、强回声、囊性变、微钙化及血流增加,其中微钙化、血流增加特异性最高。这类患者建议术前行FNAB以确认肿瘤是否转移到颈侧区淋巴结。细胞学提示有颈侧区转移的患儿,应进行颈侧区淋巴结清扫,不建议常规行颈侧区清扫。如果颈侧区转移的细胞学证据不明确,可考虑行FNAB洗脱液Tg检测。颈侧区淋巴结清扫时重点处理Ⅱ、Ⅲ、Ⅳ和Ⅴb区,有助于降低术后肿瘤残留或复发,提高无病生存期(DFS)[12,34,35,36,37]。
推荐24:对于术后低钙血症的高危患儿,推荐早期给予钙剂与骨化三醇,降低症状性低钙血症风险(推荐级别:B)。
甲状腺切除术后最常见的并发症是暂时性或永久性甲状旁腺功能减退,平均发生率为5%~15%,儿童患者这一比例升高,但永久性甲状旁腺功能减退的风险仍小于2.5%。甲状旁腺功能减退与手术范围相关。即使术中确认甲状旁腺并予以保护,术后也可能出现功能减退。对不慎切除或血运不佳,经过冷冻切片确认的甲状旁腺组织迅速进行自体移植,可在一定程度上降低永久性甲状旁腺功能减退的风险。围术期血清钙和全段甲状旁腺激素(intact parathyroid hormone,iPTH)的连续检测可评估术后低钙血症情况。在发生低钙血症的高危患者中,及早(术前)给予钙剂与骨化三醇,可降低症状性低钙血症的发生风险。
推荐25:推荐对年龄<10岁、中央区清扫或再次手术患者进行术中RLN监测(推荐级别:B)。
RLN及喉上神经外支损伤是常见的手术并发症。年龄<10岁患者、存在腺体外侵犯、淋巴结清扫及再次手术均可增加神经损伤风险。有证据表明术中RLN监测可降低此类患者喉上神经及RLN损伤的发生率[22,37]。
推荐26:推荐术前对所有DTC患儿进行TNM分期(推荐级别:A)。
目前多采用美国癌症联合委员会(American Joint Committee on Cancer,AJCC)的TNM分期(表3)。TNM分期系统在描述疾病侵犯,特别是淋巴结受累情况方面,对儿童甲状腺癌风险分层有很大指导作用。不同于成人的是,在本分期系统中儿童甲状腺癌被分为Ⅰ期(无远处转移)或Ⅱ期(有远处转移)。然而,Ⅰ期包含多种情况:甲状腺微小癌、局限于甲状腺的孤立性病变、广泛的局部病变及伴有颈部淋巴结转移等。这些病变处理策略明显不同,需要进一步进行复发风险分层[12,22,38]。
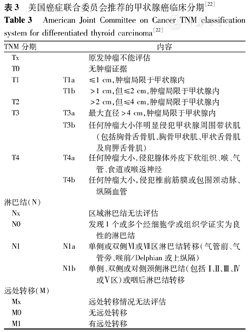
美国癌症联合委员会推荐的甲状腺癌临床分期[22]
American Joint Committee on Cancer TNM classification system for differentiated thyroid carcinoma[22]
| TNM分期 | 内容 | ||
|---|---|---|---|
| Tx | 原发肿瘤不能评估 | ||
| T0 | 无肿瘤证据 | ||
| T1 | T1a | ≤1 cm,肿瘤局限于甲状腺内 | |
| T1b | >1 cm,但≤2 cm,肿瘤局限于甲状腺内 | ||
| T2 | >2 cm,但≤4 cm,肿瘤局限于甲状腺内 | ||
| T3 | T3a | 最大直径>4 cm,肿瘤局限于甲状腺内 | |
| T3b | 任何肿瘤大小伴明显侵犯甲状腺周围带状肌(包括胸骨舌骨肌、胸骨甲状肌、甲状舌骨肌及肩胛舌骨肌) | ||
| T4 | T4a | 任何肿瘤大小,侵犯腺体外皮下软组织、喉、气管、食道或喉返神经 | |
| T4b | 任何肿瘤大小,侵犯椎前筋膜或包围颈动脉、纵隔血管 | ||
| 淋巴结(N) | |||
| Nx | 区域淋巴结无法评估 | ||
| N0 | |||
| 发现1个或多个经细胞学或组织学证实为良性的淋巴结 | |||
| N1 | N1a | 单侧或双侧Ⅵ或Ⅶ区淋巴结转移(气管前、气管旁、喉前/Delphian或上纵隔) | |
| N1b | 单侧、双侧或对侧颈侧淋巴结(包括Ⅰ、Ⅱ、Ⅲ、Ⅳ或Ⅴ区)或咽后淋巴结转移 | ||
| 远处转移(M) | |||
| Mx | 远处转移情况无法评估 | ||
| M0 | 无远处转移 | ||
| M1 | 有远处转移 | ||
推荐27:推荐将儿童DTC按风险等级进行分类(推荐级别:A)。
虽然儿童DTC累及范围一般较成人更广,但多数预后仍然较好。一项全因死亡率研究表明,经过30~50年随访,2/3的死亡由第二原发恶性肿瘤引起(主要是唾液腺癌和白血病),其中3/4的患者接受过某种形式的术后放射性治疗[14]。另一项研究纳入了3 850例儿童和青年DTC患者,其中1 571例接受过放射性碘治疗,有26例患者出现了第二原发恶性肿瘤,高于预期的18.3例[39]。因此,需要确定哪些患者需要积极治疗,并在获益可能性较小的儿童中限制过度治疗[40,41,42,43,44]。基于此,ATA指南将儿童PTC分为3个风险等级(表4),该分层系统主要依据淋巴结转移及病灶局部侵犯程度,更侧重于识别患者持续存在的淋巴结病变风险而非死亡风险。从该分层系统可看出颈侧区淋巴结转移对患者复发风险影响较大。

儿童PTC危险分层及术后管理
American Thyroid Association pediatric thyroid cancer risk levels and postoperative management in children with papillary thyroid carcinoma
儿童PTC危险分层及术后管理
American Thyroid Association pediatric thyroid cancer risk levels and postoperative management in children with papillary thyroid carcinoma
| 风险分层a | 定义 | 初始术后分期b | TSH目标c | 无疾病证据患者监测d |
|---|---|---|---|---|
| 低危 | 病变局限于甲状腺内,N0/Nx或偶发N1a转移(少量中央区颈部淋巴结的镜下转移) | Tge | 0.5~1.0 mIU/L | 超声:术后6个月复查,之后每年1次,持续5年 |
| Tge:服用L-T4下每3~6个月监测1次,持续2年,之后每年1次 | ||||
| 中危 | 广泛的N1a转移或小范围的N1b转移 | 对大部分患者:TSH刺激下Tge水平及诊断性123I扫描 | 0.1~0.5 mIU/L | 超声:术后6个月复查,之后每6~12个月1次,持续5年,之后逐渐降低频率 |
| Tge:服用L-T4下每3~6个月监测1次,持续3年,之后每年1次 | ||||
| 131I治疗过的患者:1~2年检测TSH刺激下Tge水平伴或不伴诊断性123I扫描 | ||||
| 高危 | 区域淋巴结广泛转移(广泛的N1b)或局部侵袭性病灶(T4期),伴或不伴远处转移 | 对所有患者:TSH刺激下Tge水平及诊断性123I扫描 | <0.1 mIU/L | 同中危组 |
注:PTC:甲状腺乳头状癌;TSH:促甲状腺激素;Tg:甲状腺球蛋白;L-T4:左甲状腺素;参考美国癌症联合委员会(AJCC)TNM分期,a"风险"定义为在操作熟练的甲状腺外科医师行甲状腺全切除±淋巴结清扫后出现颈部疾病持续和/或远处转移的可能性,并非死亡风险,在儿科人群中极低;b术后12周内进行初始术后分期;c此处为初始TSH抑制目标,应根据患儿已知或可疑的疾病状态进行调整,对经过3~5年随访后无疾病证据的儿童中、高危患者,TSH抑制水平可以上升到正常低值;d术后监测始于术后6个月延续到认为患者完全无病时,随访的强度和诊断研究的范围由初始术后分期、目前疾病状态及是否进行过131I治疗等因素决定;e假定TGAb(-),对于TGAb阳性患者,除T4或M1患儿外,可以考虑推迟(>12周)术后评估及分期,为TGAb可能的自发清除留出时间 PTC:papillary thyroid carcinoma;TSH:thyrotropin;Tg:thyroglobulin;L-T4:Levothyro-xine;refer to American Joint Committee on Cancer(AJCC)TNM classification system,a"Risk"is defined as the likelihood of having persistent cervical di-sease and/or distant metastases after initial total thyroidectomy-lymph node dissection by a high volume thyroid surgeon and is not the risk for mortality,which is extremely low in the pediatric population;binitial postoperative staging that is done within 12 weeks after surgery;cthese are initial targets for TSH suppression and should be adapted to the patient′s known or suspected disease status,in American Thyroid Association pediatric intermediate- and high-risk patients who have no evidence of disease after 3-5 years of follow-up,the TSH can be allowed to rise to the low normal range;dpostoperative surveillance implies studies done at 6 months after the initial surgery and beyond in patients who are believed to be disease free;the intensity of follow-up and extent of diagnostic studies are determined by initial postoperative staging,current disease status,and whether or not131I was given;eassumes a negative TGAb,in TGAb-positive patients,consideration can be given (except in patients with T4 or M1 disease) to deferred postoperative staging to allow time for TGAb clearance
初始分期常在术后12周内进行。旨在评价其是否仍存在病灶及能否从后续131I治疗中获益。但目前尚未见前瞻性研究验证DTC儿童风险分层的效果[22]。
推荐28:推荐放射性碘(131I)治疗用于手术不能切除的局部摄碘病变;对131I治疗之后仍持续存在的病变,根据临床及前次131I治疗反应进行个体化评估后确定是否需再次进行131I治疗(推荐级别:A)。
治疗机制:甲状腺癌尤其是DTC部分保留了甲状腺滤泡细胞的分化特征,如钠碘转运体(Na+/I-symporter,NIS)等表达,具备摄碘功能,为131I在其治疗中的应用提供了分子生物学依据。
131I治疗前评估:131I治疗前评估是辅助决策131I治疗的重要步骤,旨在明确DTC患者复发及死亡风险,权衡131I治疗的利弊,优化131I治疗决策,为131I个体化精准治疗提供依据[43]。目前131I治疗前评估针对的主要是成年DTC患者,推荐儿童DTC 131I治疗前评估亦可采用其内容和方法,主要包括基于围术期的临床病理学资料进行的单时点静态评估,初步明确TNM分期及风险分层;并结合能够反映术后疾病状态的动态评估体系,进行复发风险及预后实时动态评估及修正。动态评估需要进行血清学(如Tg、TGAb、TSH)及影像学检查[如诊断性123I(或131I)DxWBS、颈部超声、CT、MRI、18F-FDG PET/CT等]。
在血清学评估中,术后血清刺激性Tg水平可作为评估残余甲状腺组织及疾病状态的有效指标。针对儿童DTC术后刺激性Tg水平预测预后的研究仍较少。有研究发现低术后刺激性Tg水平(<2 ng/mL)对无病状态的预测价值高达94.9%[44]。有研究表明术后刺激性Tg水平有助于预测儿童DTC是否达到治疗满意(ER)的界值为37.8 ng/mL(灵敏度及特异度分别为81%及100%);亦有研究提示儿童患者术后刺激性Tg预测远处转移的界值为154.0 ng/mL(灵敏度及特异度分别为87.5%及91.7%)[22];这些界值均高于成人患者中的类似结果。从而推测儿童DTC的生物学行为与临床病理特征与成人存在差异。有关儿童及青少年DTC的疾病状态的关系及相关预测界值仍待进一步研究。
在影像学评估中,DxWBS有助于在131I治疗前探查术后残余甲状腺及可能被其他影像学手段遗漏的可疑摄碘性转移灶,进一步明确患儿的风险分层,并初步预估转移病灶的摄碘能力,为后续131I治疗的决策提供影像学依据。颈部超声简便易行,有助于探测残余甲状腺、发现可疑淋巴结。CT或MRI检查可用于评估颈部复发灶、转移淋巴结及肺等远处转移灶等的部位、大小、数量、与周围结构及器官的相对关系等。18F-FDG PET/CT不常规应用于131I治疗前评估,但在血清Tg/TGAb水平持续增高(如抑制性Tg>1 ng/mL,或刺激性Tg>10 ng/mL,或TGAb≥40 U/mL且呈持续上升趋势)而131I显像阴性时,18F-FDG PET/CT可辅助寻找和定位病灶以及辅助判断病灶可能的碘难治状态。应指出,在目前仍缺乏儿童DTC 131I治疗的明确判断标准及依据的情况下,对131I治疗前评估结果的解读及后续治疗的决策均需要有经验的核医学专家进行综合考量。
推荐29:对中高危风险的患儿,推荐131I治疗前行DxWBS,并结合刺激性Tg来评估术后患儿实时状况;SPECT/CT及其他影像学手段(如B超等)可辅助进一步定位DxWBS摄碘病灶(推荐级别:C)。
适应证:131I治疗主要用于中高危患儿,尤其是手术不能切除的局部摄碘性残存病灶或转移淋巴结及摄碘性远处转移病灶者。值得注意的是,有关儿童的ATA指南(2015版)并不常规推荐以清除残余甲状腺为目的的131I清甲治疗[10,45]。
在131I治疗后的随访及复治决策中,针对131I治疗之后仍持续存在甚至出现进展的病变,根据临床及前次131I治疗反应及可能的远期不良反应等因素进行个体化评估;综合判断患者获益来确定是否需再次进行131I治疗[22]。对于抑制性Tg阳性但颈部超声和DxWBS阴性的患者,可先考虑颈胸部增强扫描(CT/MRI)以探查病灶;除非存在临床疾病进展的证据(如Tg升高等)和前次131I有效的证据(血清学,如Tg/TGAb和/或CT等影像学),不推荐常规经验性131I治疗及将DxWBS用于探查病灶。对于大多数无症状及非进展性131I难治性儿童DTC患者,可在TSH抑制治疗下安全随访。
131I治疗流程:包括准备、给药、给药后扫描等具体步骤。每次131I治疗前的准备工作:停服L-T4至少2周,测定TSH>30 mIU/L;131I治疗前2周低碘饮食。对于131I治疗前体内TSH不足的患儿,ATA指南建议补充重组人TSH,但应指出,目前我国人重组TSH尚未上市。
131I剂量实施:治疗性131I给药剂量通常基于经验性治疗剂量或根据体质量或体表面积折算治疗剂量。目前尚无标准化的131I治疗剂量公式以及使用不同剂量131I的有效性、安全性或长期预后的研究。经验性治疗剂量具有简便易行的优点,根据体质量或体表面积折算[如儿童体质量(kg)/70 kg]131I的剂量,这是基于成人的剂量标准来确定的。一般来说,在病情相似的情况下,15岁的患者需给予成人剂量的5/6,10岁者给予成人剂量的1/2,5岁者则仅需成人剂量的1/3。
对于存在摄碘性弥漫性肺转移灶或其他远处转移灶需要多次131I治疗的患者,或经过之前化疗、放射性治疗已经达到骨髓剂量限值者,应使用全身剂量学计算最大可给予的131I剂量,以确保血液的吸收剂量不超过200 rads(cGy)。在广泛肺转移或存在其他肿瘤负荷较重的远处转移瘤(如骨)等时,也可以通过病灶的吸收剂量来确定有效的131I给予剂量。由于儿童相比成人体质量和碘清除率差异较大,指南建议由经验丰富的医师来确定131I剂量。
不良反应及其处理:131I治疗的急性不良反应主要包括对一些可摄取131I组织的辐射损伤,造成唾液腺炎、口干、龋齿、胃炎、眼干、鼻泪管堵塞等[40,41]。131I治疗后24 h应给予酸性糖果或柠檬汁,并在3~5 d内充分饮水。部分DTC患者可出现急性骨髓抑制,但131I治疗后60 d内血象一般会恢复至正常值。长期骨髓抑制较为罕见。推荐多次131I治疗者需给予一定时间间隔待骨髓功能恢复正常。对于存在肺转移的PTC患儿,当滞留的131I剂量超过80 mCi(3 GBq)时,131I引起肺纤维化的风险显著增高[39,40,41,42,43]。因此,建议在DxWBS观察到转移灶摄碘明显患儿,应根据剂量学确定131I剂量或相应减少131I剂量。生殖系统的不良反应主要为性腺损伤[39,40,41],女性还可出现一过性闭经及月经失调。儿童不涉及短期内的生育问题,但需要注意的是,对于131I累积剂量≥400 mCi(14.8 GBq)的青春期后男性,应考虑预先储存精子等问题[42,43]。由于儿童DTC患者相对较少且生存期较长,目前尚缺乏关于其长期安全性的证据,因此本共识未推荐131I治疗累积剂量的限值,亦未明确131I治疗与继发肿瘤风险之间的联系。
如何从儿童DTC中识别可从131I治疗明确获益的人群,治疗间隔及终止131I治疗的时机仍是今后研究的重点。
推荐30:推荐L-T4用于儿童DTC的术后抑制治疗(推荐级别:A)。
L-T4已用于抑制甲状腺结节生长并降低甲状腺结节的恶性潜能。抑制TSH可降低DTC的复发率。成人DTC已明确了TSH抑制可减缓疾病进程,降低复发率及肿瘤相关病死率,儿科DTC缺乏特异性证据。此外,与成人相比,儿童TSH抑制存在特殊困难:儿童每公斤体质量需更多的L-T4剂量达到完全抑制,同时医源性的亚临床甲状腺功能亢进会影响生长、行为和学习能力。然而,关于L-T4治疗的长期安全性和潜在不良反应的数据很少。
PTC是高分化肿瘤,对TSH刺激有反应,可出现肿瘤生长加速及促进Tg产生。基于这个理由,TSH抑制治疗非常重要,特别是高危组人群[46]。儿童TSH抑制的目标应根据儿童PTC的风险等级,低、中及高风险患儿TSH目标分别为0.5~1.0 mIU/L、0.1~0.5 mIU/L和0.1 mIU/L,如发现或怀疑疾病持续存在,可维持该目标,否则可在监测一段时间后将TSH恢复到正常低值[25]。
推荐31:推荐Tg和TGAb作为儿童DTC术后评估、治疗、长期随访中的敏感肿瘤标志物(推荐级别:A)。
Tg作为儿童DTC评估、治疗、长期随访中的敏感肿瘤标志物,检测时需与TGAb及TSH同时进行;随访过程中最好在同一实验室用相同试剂检测其变化趋势,用以判断疾病状态及变化。
随访中,如TSH刺激后Tg为阴性(TGAb亦阴性),提示该患儿疾病很可能已缓解或达到无病生存状态,可适当放宽TSH抑制水平及随访频率。经手术及131 I治疗后低水平刺激性Tg(Tg为2~10 ng/mL)提示可能为持续疾病状态。对已接受手术和131I治疗的患儿,如TSH刺激后Tg水平显著增高(>10 ng/mL),应寻找病灶或转移灶,并考虑是否需要再次手术和131I治疗[22,25]。
值得注意的是,有研究发现部分接受甲状腺全切术及清甲治疗患者的Tg水平可能会在治疗后数年内逐渐降低,可通过持续监测抑制性Tg和TGAb变化及影像学评估继续对患者进行随访,而不必急于再次行131I治疗。针对TGAb阳性患儿,因其会干扰Tg的检测并使结果被高估或低估影响其准确解读,建议同一检测条件下动态观察TGAb的变化趋势,如果TGAb呈明显上升趋势,则需要进一步的评估。
推荐32:推荐超声检查作为儿童DTC术后评估、长期随访中的常规影像学检查手段(推荐级别:A)。
儿童DTC需终生随访,推荐甲状腺癌患儿术后主要采用颈部超声进行影像学随访,初次手术后6个月行颈部超声检查,此后根据风险分层进行随访,低危者每12个月,中、高危者每6~12个月行颈部超声检查[47]。5年后则根据患者复发风险进行个体化随访。
推荐33:推荐DxWBS检查作为可疑疾病残留病灶的诊断方法(推荐级别:A)。
DxWBS可用于为再次131I治疗及剂量决策提供依据。对于已行131I治疗并经评估提示无病变的患者,DxWBS是证实已无摄碘灶、无需再次131I治疗的重要证据。推荐对已经接受过131I治疗的高危患者行DxWBS,并且至少随访12个月后再行DxWBS检查。
推荐34:对于DxWBS结果为阴性且无持续疾病存在的患儿,随访中不建议常规采用DxWBS探查是否存在疾病复发(推荐级别:F)。
推荐35:对颈部持续/复发的DTC患儿,推荐行个体化处理,优先评估是否可行手术。颈部之前未被清扫的淋巴结更推荐手术治疗;建议术后再次评估患儿131I治疗可能的获益(推荐级别:B)。
对于颈部持续/复发的DTC患儿,推荐根据患儿年龄、初始危险分层、是否存在远处转移灶、诊疗史(包括之前治疗的并发症)等行个体化处理,同时应纳入病灶大小、侵犯范围、解剖位置及摄碘情况进行综合考量。应优先根据上述特点评估是否可行手术,颈部之前未被清扫的淋巴结更推荐手术治疗;建议术后再次评估患儿131I治疗可能的获益。
2015年针对成人的ATA指南正式引入了动态风险评估系统以实时评估疾病的转归,随后多项研究表明该方案或可用于儿童DTC的疾病状态预测及疗效评价,调整后续随访及治疗方案。未来在整合更多的研究数据后指南或可纳入动态风险评估系统以更有效地指导儿童DTC的随访及治疗[21,22,25]。
推荐36:大多数儿童患者具有高度分化的肿瘤组织学类型,大部分对治疗反应良好(推荐级别:A)。
尽管儿童甲状腺癌较成人更具侵袭性,但仍有望获得较好的预后。即便是复发患者,儿童甲状腺癌生存率也不低于成人[48]。在1 753例甲状腺癌儿童随访31年的SEER登记报道中,PTC患者的5年、15年和30年生存率分别为98%、97%和91%。鉴于较高的生存率,治疗重要任务是最大程度降低治疗并发症[49,50,51]。
儿童FTC是一种少见的恶性肿瘤,约占儿童甲状腺癌的不足10%。普遍认为碘缺乏是其发病的主要原因,而电离辐射在FTC发病中作用尚不清楚。
推荐37:不推荐FNAB及术中快速冷冻病理作为FTC的诊断方法(推荐级别:F)。
儿童FTC的临床行为有别于PTC。通常情况下,FTC的局部侵犯和复发率远远小于PTC。FTC少有颈部淋巴结受累,但可能早期出现血行转移。尽管如此,其远期预后仍好于PTC。根据其临床病理表现,可将FTC分为3大类:微小侵犯型、包裹血管浸润型和广泛侵袭型。术中快速冷冻病理检查不能有效区分FTC和良性肿瘤,故不推荐作为FTC的诊断方法[52]。
推荐38:对微小浸润型FTC,推荐行甲状腺腺叶切除或腺叶加峡部切除术(推荐级别:C)。
显微镜下观察肿瘤位于滤泡内,伴/不伴微小的周围微血管侵犯者称之为微小浸润型FTC。手术切除是其最重要的治疗手段[22,52]。但微小浸润型FTC因为FNAB病理显示多为不确定性病变,术中冰冻亦不能有效区分其与良性结节,故术中多行单独的甲状腺腺叶切除或腺叶加峡部切除术[53,54]。术后病理证实为微小浸润型FTC的患儿,无需再补行甲状腺全切除术。
推荐39:对于广泛侵袭型及侵犯超过3条血管、肿瘤直径>4 cm或有远处转移证据的微小浸润型FTC,推荐行甲状腺全切除术[22],术后行放射性碘治疗(推荐级别:C)。
广泛侵袭型FTC是指广泛浸润甲状腺组织及邻近血管者。由于其包囊不完整,对周围甲状腺组织及血管有侵犯,并潜在远处转移可能。故手术时推荐行甲状腺全切除术[54]。全切术后,结合DxWBS及TSH刺激后的Tg水平,行放射性碘治疗[22,54]。
推荐40:对FTC患儿,推荐行PTEN基因检查以除外巨头畸形或PTEN相关错构瘤肿瘤综合征的可能(推荐级别:C)。
(倪鑫 巩纯秀 葛明华 高明 房居高 林岩松 于宝生 王生才 王佳峰 王新利 毛晓健 石文媛 刘戈力 刘丽 刘绍严 刘雅莉 李秀珍 李哲 李晓艳 李超 吴迪 谷奕 辛颖 张彬 陈临琪 陈晓波 陈瑞敏 邰隽 罗小平 郑向前 钟琦 梁萍 梁黎 董治亚 傅君芬 廖泉 熊丰 樊友本 执笔)
参加本共识编写专家:
专家组组长:倪鑫
副组长:巩纯秀 葛明华 高明 房居高 林岩松
专家组成员(按姓氏笔画顺序):于宝生(南京医科大学第二附属医院);王生才(首都医科大学附属北京儿童医院);王佳峰(浙江省肿瘤医院);王新利(北京大学第三医院);毛晓健(广州市妇女儿童医疗中心);石文媛(首都医科大学附属北京儿童医院);刘戈力(天津医科大学总医院);刘丽(广州市妇女儿童医疗中心);刘绍严(中国医学科学院肿瘤医院);刘雅莉(首都医科大学附属北京儿童医院);李秀珍(广州市妇女儿童医疗中心);李哲(首都医科大学附属北京儿童医院);李晓艳(上海交通大学附属儿童医院);李超(电子科技大学医学院附属肿瘤医院);吴迪(首都医科大学附属北京儿童医院);谷奕(首都医科大学附属北京儿童医院);辛颖(中国医科大学附属盛京医院);张杰(首都医科大学附属北京儿童医院);张彬(北京大学肿瘤医院);陈临琪(苏州大学附属儿童医院);陈晓波(首都儿科研究所附属儿童医院);陈瑞敏(福建省福州儿童医院);邰隽(首都儿科研究所);罗小平(华中科技大学同济医学院附属同济医院);郑向前(天津医科大学肿瘤医院);钟琦(首都医科大学附属北京同仁医院);梁萍(中国人民解放军总医院);梁黎(浙江大学医学院附属第一医院);葛文彤(首都医科大学附属北京儿童医院);董治亚(上海交通大学医学院附属瑞金医院);傅君芬(浙江大学医学院附属儿童医院);廖泉(北京协和医院);熊丰(重庆医科大学附属儿童医院);樊友本(上海交通大学附属第六人民医院)
编写组秘书:张雪溪 王嘉丽
所有作者均声明不存在利益冲突



























