
新型冠状病毒肺炎(COVID-19)自暴发以来,以其高致病性和传染性,对全球公共卫生安全造成了巨大威胁。到目前为止,新型冠状病毒(2019-nCoV)的致病机制仍不明确,尚无有效的治疗方法。疫苗作为预防病毒感染最有效的策略之一成为研究热点。基于目前对2019-nCoV的了解,其疫苗的研发几乎涵盖了目前疫苗研究的所有形式,包括灭活疫苗、重组蛋白疫苗、病毒载体疫苗和核酸疫苗(mRNA或DNA疫苗)等。本文就2019-nCoV疫苗的候选靶点、疫苗类型、研发现状及进展等方面进行综述,为后续研究及防治提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
冠状病毒是自然界中广泛存在的一大类病毒,可导致人与动物从普通感冒到更严重的疾病,如严重急性呼吸综合征(SARS)和中东呼吸综合征(MERS)。新型冠状病毒(2019-nCoV)是已知的第三种人畜共患的冠状病毒,感染者常出现发热、咳嗽和疲劳等症状,可导致严重的急性呼吸道感染,甚至急性呼吸窘迫综合征。2020年,新型冠状病毒肺炎(COVID-19)疫情在全球发生大流行,对公共安全构成威胁,世界卫生组织(WHO)已宣布进入公共卫生紧急状态[1,2,3]。
鉴于COVID-19疫情的严重程度,研发出一种安全、有效的疫苗来对抗2019-nCoV感染成为当下研究热点。在SARS冠状病毒(SARS-CoV)和MERS冠状病毒(MERS-CoV)研究的基础上,2019-nCoV疫苗的研发取得了很大突破。但是,由于各种条件的限制,2019-nCoV疫苗的研发依旧面临着很多挑战。本文主要介绍2019-nCoV疫苗的设计靶点,目前正在研发的疫苗种类与优缺点,提高病毒亚单位疫苗免疫原性时所需要的的佐剂系统,以及在疫苗生产中遇到的挑战与对未来的展望。
目前已知有7种可感染人类的冠状病毒:229E、OC43、NL63、HKU1、SARS-CoV、MERS-CoV和2019-nCoV,前4种只会引起轻微的呼吸道疾病;其他3种均属于β-冠状病毒属,会引发人畜共患病,可导致严重呼吸综合征[4,5,6]。
冠状病毒是最大的单正链RNA包膜病毒,其基因组为27~32 kb[7],主要编码4种结构蛋白:刺突蛋白(S)、核衣壳蛋白(N)、膜蛋白(M)、包膜蛋白(E)。S蛋白形成三聚体的结构,在病毒表面形成刺突,负责识别并结合宿主细胞表面的受体,介导病毒与宿主细胞的吸附和融合。N蛋白形成螺旋状衣壳,衣壳位于病毒膜内,保护病毒RNA。M和E蛋白是病毒包膜的重要组成部分,在病毒组装的过程中发挥重要作用[8]。在这4种结构蛋白中,病毒进入宿主细胞的主要介质是S蛋白,SARS-CoV和2019-nCoV表面的S蛋白以血管紧张素转换酶2(ACE2)作为受体进入细胞引起感染,促进病毒繁殖及发病[9],因此ACE2受体在人体内的分布及其与S蛋白的亲和性决定了病毒的毒力和传播强度。S蛋白是一种大型Ⅰ型跨膜糖蛋白,由S1和S2 2个亚基组成,S1亚基的受体结合域(RBD)与宿主的识别与结合有关,S2亚基与病毒包膜和宿主细胞膜之间的融合有关。另外,S蛋白携带有B细胞表位,可以诱导机体产生中和抗体,为机体提供免疫保护。由于S蛋白参与病毒感染,并负责诱导宿主产生免疫应答,所以被认为是疫苗设计的关键靶点。
冠状病毒的N蛋白是合成病毒RNA所必需的,其与病毒RNA结合并形成核衣壳,参与病毒的组装与RNA转录,也同时参与了病毒感染宿主细胞。研究表明,SARS-CoV的N蛋白可以与患者血清发生反应,并且表达SARS-CoV N蛋白的DNA疫苗可以诱导小鼠产生抗体[10]。虽然N蛋白位于病毒内部,抗体反应比较微弱。但也证明了N蛋白可能是疫苗设计的关键靶点。
利用一定的技术与手段,研究者快速鉴定出2019-nCoV的一部分基因表位[11,12]。研究发现,SARS-CoV和2019-nCoV在部分T细胞和B细胞的基因表位上有高度相似性,如果以这些表位作为疫苗设计的靶点,或许能做到对SARS和COVID-19形成交叉保护,也可能对将来持续突变的病毒形成免疫作用。
根据WHO不完全统计,全球2019-nCoV疫苗研发项目已超过100项,基本涵盖了目前疫苗研究的所有方式,包括灭活疫苗、重组蛋白疫苗、病毒载体疫苗、核酸疫苗(mRNA疫苗与DNA疫苗)等,各类型疫苗的研发机构及进展见表1,不同类型疫苗具体信息、特点比较见表2。
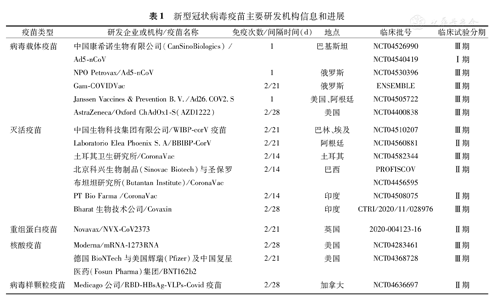
新型冠状病毒疫苗主要研发机构信息和进展
新型冠状病毒疫苗主要研发机构信息和进展
| 疫苗类型 | 研发企业或机构/疫苗名称 | 免疫次数/间隔时间(d) | 地点 | 临床批号 | 临床试验分期 |
|---|---|---|---|---|---|
| 病毒载体疫苗 | 中国康希诺生物有限公司(CanSinoBiologics) /Ad5-nCoV | 1 | 巴基斯坦 | NCT04526990 | Ⅲ期 |
| NCT04540419 | Ⅰ期 | ||||
| NPO Petrovax/Ad5-nCoV | 1 | 俄罗斯 | NCT04530396 | Ⅲ期 | |
| Gam-COVIDVac | 2/21 | 俄罗斯 | ENSEMBLE | Ⅲ期 | |
| Janssen Vaccines & Prevention B.V./Ad26.COV2.S | 1 | 美国、阿根廷 | NCT04505722 | Ⅲ期 | |
| AstraZeneca/Oxford ChAdOx1-S(AZD1222) | 2/28 | 美国 | NCT04400838 | Ⅲ期 | |
| 灭活疫苗 | 中国生物科技集团有限公司/WIBP-corV疫苗 | 2/21 | 巴林、埃及 | NCT04510207 | Ⅲ期 |
| Laboratorio Elea Phoenix S.A/BBIBP-CorV | 2/21 | 阿根廷 | NCT04560881 | Ⅱ期 | |
| 土耳其卫生研究所/CoronaVac | 2/14 | 土耳其 | NCT04582344 | Ⅲ期 | |
| 北京科兴生物制品(Sinovac Biotech)与圣保罗布坦坦研究所(Butantan Institute)/CoronaVac | 2/14 | 巴西 | PROFISCOV | Ⅱ期 | |
| NCT04456595 | |||||
| PT Bio Farma /CoronaVac | 2/14 | 印度 | NCT04508075 | Ⅱ期 | |
| Bharat生物技术公司/Covaxin | 2/28 | 印度 | CTRI/2020/11/028976 | Ⅲ期 | |
| 重组蛋白疫苗 | Novavax/NVX-CoV2373 | 2/21 | 英国 | 2020-004123-16 | Ⅱ期 |
| 核酸疫苗 | Moderna/mRNA-1273RNA | 2/28 | 美国 | NCT04283461 | Ⅲ期 |
| 德国BioNTech与美国辉瑞(Pfizer)及中国复星医药(Fosun Pharma)集团/BNT162b2 | 2/21 | 美国 | NCT04368728 | Ⅲ期 | |
| 病毒样颗粒疫苗 | Medicago公司/RBD-HBsAg-VLPs-Covid疫苗 | 2/28 | 加拿大 | NCT04636697 | Ⅱ期 |
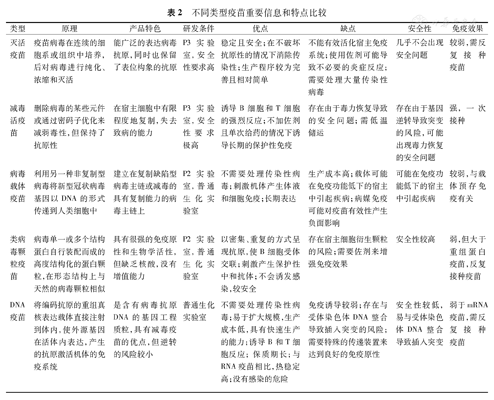
不同类型疫苗重要信息和特点比较
不同类型疫苗重要信息和特点比较
| 类型 | 原理 | 产品特色 | 研发条件 | 优点 | 缺点 | 安全性 | 免疫效果 |
|---|---|---|---|---|---|---|---|
| 灭活疫苗 | 疫苗病毒在连续的细胞系或组织中培养,后对病毒进行纯化、浓缩和灭活 | 能广泛的表达病毒抗原,同时也保留了表位构象的抗原 | P3实验室,安全性要求高 | 稳定且安全;在不破坏抗原性的情况下消除传染性;生产程序较为完善且相对简单 | 不能有效活化宿主免疫系统;使用佐剂可能导致不必要的炎症反应;需要处理大量传染性病毒 | 几乎不会出现安全问题 | 较弱,需反复接种疫苗 |
| 减毒活疫苗 | 删除病毒的某些元件或通过密码子优化来减弱毒性,但保持了抗原性 | 在宿主细胞中有限程度地复制,失去致病的能力 | P3实验室,安全性要求极高 | 诱导B细胞和T细胞的强烈反应;不加佐剂且单次给药的情况下诱导长期的保护性免疫 | 存在由于毒力恢复导致的安全问题;需低温储运 | 存在由于基因逆转导致突变的风险,可能出现毒力恢复的安全问题 | 强,一次接种 |
| 病毒载体疫苗 | 利用另一种非复制型病毒将新型冠状病毒基因以DNA的形式传递到人类细胞中 | 建立在复制缺陷型病毒主链或减毒的具有复制能力的病毒主链上 | P2实验室,普通生化实验室 | 不需要处理传染性病毒;刺激机体产生体液和细胞免疫;长期表达 | 生产成本高;载体可能在免疫功能低下的宿主中引起疾病;病媒免疫可能对疫苗有效性产生负面影响 | 可能在免疫功能低下的宿主中引起疾病 | 较弱,与载体预存免疫有关 |
| 类病毒颗粒疫苗 | 病毒单一或多个结构蛋白自行装配而成的高度结构化的蛋白颗粒,在形态结构上与天然的病毒颗粒相似 | 具有很强的免疫原性和生物学活性,但缺乏核酸,没有增值能力 | P2实验室,普通生化实验室 | 以密集、重复的方式呈现抗原,使B细胞受体交联;刺激产生保护性中和抗体;不会诱发感染,较安全 | 存在宿主细胞衍生颗粒的风险;需要佐剂来增强免疫效果 | 安全性较高 | 弱,但大于重组蛋白疫苗,反复接种疫苗 |
| DNA疫苗 | 将编码抗原的重组真核表达载体直接注射到体内,使外源基因在活体内表达,产生的抗原激活机体的免疫系统 | 是含有病毒抗原DNA的基因工程质粒,具有减毒疫苗的优点,但逆转的风险较小 | 普通生化实验室 | 不需要处理传染性病毒;易于扩大规模,生产成本低,具有快速生产的能力;诱导B和T细胞反应;保质期长;与RNA疫苗相比,热稳定高;没有感染的危险 | 免疫诱导较弱;存在与受体染色体DNA整合导致插入突变的风险;需要特殊的传递装置来达到良好的免疫原性 | 安全性较低,易与受体染色体DNA整合导致插入突变 | 弱于mRNA疫苗,需反复接种疫苗 |
| mRNA疫苗 | 将mRNA递送宿主细胞后表达抗原的疫苗,细胞使用mRNA作为模板,利用宿主细胞翻译机制产生抗原,引起B细胞和T细胞免疫反应 | 可以有效地在体内传递到宿主细胞的细胞质中进行蛋白质翻译和翻译后修饰 | 普通生化实验室 | 不需要处理传染性病毒;具有免疫原性,直接注入胞浆可增强抗原表达;不太可能引起过敏等不良反应;不与基因组相互作用;具有快速生产的能力 | 只编码一些片段而不是整个病毒限制其免疫原性;缺乏与体内RNA受体的相互作用,可能削弱免疫刺激;必须保持低温;在体内给药和吸收疫苗具有挑战性 | 安全性高,不会感染或者整合进基因组,不会带来感染或突变 | 弱,需反复接种疫苗 |
| 重组蛋白疫苗 | 使用新型冠状病毒蛋白或者蛋白片段激发免疫应答的疫苗,其以合成肽或重组蛋白为基础 | 含有完整的新型冠状病毒蛋白蛋白或其部分蛋白,以诱导中和抗体 | 普通生化实验室 | 生产速度快;产品成分明确;安全且有效 | 激发T细胞应答能力较弱;需要佐剂;若非在哺乳动物细胞中产生,S蛋白可能存在不正确的异构 | 安全性良好 | 弱,需反复接种疫苗 |
生产病毒灭活疫苗需要具备大量培养病毒的平台。由于病毒不能在宿主细胞外复制,疫苗病毒需要在连续的细胞系或组织中培养,对病毒进行纯化和浓缩,再进行灭活,用于疫苗生产的通常是Vero细胞[13]。
在2019-nCoV方面,截至2020年12月16日,已有19种灭活疫苗处于不同的临床试验阶段。其中BBIBP-CorV、CoronaVac、WIBP疫苗和Covaxin已进入Ⅲ期临床实验(https://vac-lshtm.shinyapps.io/ncov_vaccine_landscape)。进展最快的2019-nCoV灭活疫苗是由中国国药集团(Sinopharm)与武汉生物制品研究所有限责任公司研发的,已于6月23日获得阿联酋卫生部批准的2019-nCoV灭活疫苗临床试验(Ⅲ期)批件,是全球首个获批国际临床(Ⅲ期)的2019-nCoV灭活疫苗[14]。9月14日,阿联酋授予武汉生物制品研究所的2019-nCoV灭活疫苗以"紧急使用授权",用于医护人员。该疫苗接种后安全性良好,免疫程序两针接种后,疫苗组接种者均产生高滴度抗体,中和抗体阳转率为99.52%,疫苗对COVID-19的保护效力为79.34%。
除此之外,据报道,我国已于2020年7月紧急批准了科兴生物(Sinovac biotech)研发的CoronaVac灭活病毒疫苗的有限途径使用授权。浙江省嘉兴市政府更是于2020年10月宣布正在向高风险工作人员提供CoronaVac疫苗,包括医务人员、港口检查员和公共服务人员。经过土耳其冠状病毒科学咨询委员会得出的结论,CoronaVac疫苗的有效率为91.25%。而CoronaVac疫苗在印尼和巴西Ⅲ期临床数据显示其对COVID-19的保护率为65.3%和50.38%,数据的不同可能是由不同统计学方法导致的结果差异。
灭活疫苗通常不能像减毒(即经过改性或弱化的病毒,不会引起疾病)病毒疫苗一样有效地活化宿主的免疫系统,可能需要加强剂量或借助佐剂释放激活免疫系统的信号才能实现和维持保护能力,且因使用了氢氧化铝等佐剂,这类疫苗不适用于呼吸道接种,只能诱导低水平的CD8+T细胞活化,而且可能引起不必要的炎症反应。
尽管生产安全有效的病毒灭活疫苗面临挑战,但其具有较为稳定、在不破坏抗原性的情况下消除传染性以及生产程序较为完善且相对简单等优点。
减毒活疫苗是指病原体经过甲醛处理后,A亚单位(毒性亚单位)的结构改变,毒性减弱,但B亚单位(结合亚单位)的活性保持不变,即保持了抗原性的一类疫苗。2019-nCoV的弱毒株可以通过删除病毒的某些元件或者通过密码子优化来获得。现有的2019-nCoV减毒活疫苗都是通过密码子去优化产生的[15,16,17]。
印度Indian Immunologicals Ltd公司和格里菲斯大学、土耳其Acibadem MehmetAliAydinlar大学和Meissa疫苗公司开发的疫苗都处于临床前阶段。Codagenix公司开发的COVI-VAC正在英国进入Ⅰ期临床试验(NCT04619628)。
减毒活疫苗能够诱导B细胞和T细胞的强烈反应,能在不加佐剂且单次给药的情况下诱导长期的保护性免疫。尽管基于减毒活冠状病毒的候选疫苗能引发高效的免疫应答和保护,但由于存在基因突变的风险,可能发生在免疫力低下人群中引起疾病等与毒力恢复相关的生物安全问题,由此可见,其安全测试需要广泛进行。另外减毒活疫苗还存在需要低温储存与运输等难题。
病毒载体疫苗是利用另一种非复制型病毒将2019-nCoV基因以DNA的形式传递至人类细胞中,在此过程中会产生病毒蛋白诱导保护性免疫反应。其具有不需要处理传染性病毒,能够刺激机体产生体液和细胞免疫并长期表达的优点。
迄今为止,腺病毒(Ad)、改良的安卡拉牛痘(MVA)、减毒副流感病毒(BHPIV3)和狂犬病毒(RV)已被用作疫苗载体[18,19,20,21,22]。现在大多数2019-nCoV疫苗采用腺病毒载体Ad5或者MVA,表达2019-nCoV的S蛋白或者RBD结构域。
由于大多数人已经暴露在多种腺病毒之下,已预先具备了免疫力,能够削弱其作为载体进入宿主细胞的能力,这是使用人腺病毒载体疫苗所具备的潜在限制。其他的病毒载体疫苗还具有可能在免疫功能低下的宿主中引起疾病以及大量生产导致造价昂贵等问题。
由中国康希诺(CanSina)生物公司与军事医学科学院陈薇院士共同研发的腺病毒载体疫苗,是第一个公开发表临床试验研究结果的2019-nCoV疫苗,其结果显示,108位志愿者均出现显著的细胞免疫反应,中和抗体在接种后14 d显著增加,28 d达到峰值,特异性T细胞反应也在28 d达到峰值[23]。且其Ⅱ期临床试验研究结果显示,两个剂量组采用几何平均滴度(GMT)方法检测的中和抗体分别为19.5和18.3,并且诱导出T细胞免疫应答。初步证明该疫苗具有良好的安全性和耐受性,于6月25日被中国军方批准为"特殊需要药剂"。
俄罗斯Gamaleya研究所研发的GamCovid-Vac Lyo病毒载体疫苗是世界上第一个获得批准的2019-nCoV疫苗。该疫苗于2020年6月开始Ⅰ期临床试验,并于11月11日宣布,根据Ⅲ期临床试验结果,疫苗有效率达92%,保护率达91.4%。
美国强生公司的2019-nCoV 26型腺病毒载体疫苗Ad26.COV2-S于2020年2月11日首先获得4.56亿美元的资助,并分别于7月25日和9月23日,启动Ⅰ/Ⅱ期和Ⅲ期临床试验。
英国阿斯利康(AstraZeneca)公司和牛津大学研发的腺病毒载体疫苗AZD1222(之前称为ChAdOx1 nCoV-19),在2020年7月20日公布的Ⅰ/Ⅱ期临床试验结果中显示,所有受试者均产生中和抗体,能诱导出比mRNA疫苗更高的T细胞免疫且无严重不良事件(SAE)发生。8月18日,该疫苗注册Ⅲ期临床试验,分别在英国、巴西和南非进行Ⅱ/Ⅲ期临床试验(NCT04400838)和Ⅲ期临床试验。临床数据显示,该疫苗预防COVID-19的有效性约为70%。注射两次大剂量疫苗(间隔28 d)的人群中,疫苗的有效性约为62%;根据早期结果,在先注射半剂量后注射全剂量的患者中,疫苗的有效性为90%。然而,在临床试验中,服用半剂量药物是不合理的,一些科学家质疑这些早期结果是否具有代表性。尽管阿斯利康公司使用的腺病毒载体为非人类载体,在一定程度上避免了可能发生的载体中和抗体,但其动物实验结果不理想,可能需要添加增强剂。
VLPs是一种多蛋白结构,其模拟了原生病毒的组织和构象,但缺乏感染性遗传物质,因此不具有感染性。VLPs是开发安全有效的2019-nCoV疫苗的潜在候选疫苗,能够有效地激发适应性免疫应答。细菌、昆虫、酵母和哺乳动物细胞表达系统已广泛应用于VLPs的生产。
VLPs表面S蛋白的存在允许这些粒子像病毒一样与ACE2+细胞结合并进入细胞内部,VLPs表面以密集、重复的方式呈现抗原,可以直接与B细胞交联,激活B细胞。但遗憾的是,与亚单位疫苗一样,VLPs疫苗同样需要佐剂以及多次免疫来增强免疫效果。要生产高产量、稳定性和免疫原性良好的VLPs仍是一个巨大的挑战。
目前,已开发了16种VLPs疫苗,包括澳大利亚Spy生物技术和印度血清研究所赞助的I/II阶段(ACTRN12620000817943)的1种疫苗和加拿大Medicago公司赞助的II/III阶段(NCT04636697)尚未招募的1种疫苗。Medicago公司开发了一种基于植物的系统,利用烟草植物产生VLPs(https://www.medicago.com/en/pipeline/)[24]。基于2019-nCoV与HbsAg VLPs结合的RBD结构域,制备了RBD-HBsAg-VLPs-COVID疫苗。成年志愿者将接受2剂,间隔28 d(ACTRN12620000817943)。
DNA疫苗是基于能在细菌中大规模扩增并在真核细胞中表达的质粒,具有不需要处理传染性病毒、生产成本低、能同时诱导B细胞和T细胞反应、保质期长、热稳定性较RNA较高以及便于运输与储存等优点。但在安全性上,DNA疫苗易与受体染色体DNA整合导致插入突变,尽管其整合的风险低于随机基因突变的频率[25],但DNA疫苗与宿主染色体的重组及其在宿主体内去向问题仍亟待解决[26]。DNA疫苗往往表现出较低的免疫原性,仅局限于注射部位,需要特殊的传递装置来达到良好的免疫原性,比如电穿孔,或使用加压氦枪将质粒压入细胞内等[27]。
mRNA疫苗是将mRNA递送至宿主细胞后表达抗原的疫苗,细胞使用mRNA作为模板,利用宿主细胞翻译机制产生抗原,通过转化过程构建蛋白质,并引起B细胞和T细胞免疫反应。由于其高产量的体外转录反应,mRNA具有快速、廉价和可扩展的制造潜力,大大缩短了研发时间,可以快速响应流行病。与DNA疫苗相比,mRNA疫苗不与基因组相互作用,也不会整合到基因组,所以更具优越性[28]。而且mRNA疫苗还具有不需要处理传染性病毒、较少引起过敏等不良反应以及能快速生产等优势,成为近年来疫苗研究的热点。
由于mRNA在体内传递不稳定且效率低下,限制了该疫苗的应用。为了防止降解并促进其进入目标细胞,研究已广泛探索了mRNA疫苗的有效传递系统。mRNA疫苗的传递载体主要包括脂质体、非脂质体、病毒和纳米颗粒等,随着科技发展,新的传递方法不断产生,如脂质纳米颗粒(LNP)载体技术的广泛应用,使mRNA的给药途径问题得到了解决[29]。由于上述优点,mRNA疫苗正成为对抗冠状病毒感染的有力工具。
美国Moderna公司的mRNA-1273RNA疫苗,于2020年7月14日正式发表了Ⅰ期临床试验结果,所有受试者均出现高滴度的中和抗体,高剂量组(100 μg,Ⅲ期临床使用剂量)诱导产生的中和抗体是康复者血浆的4倍,约1000;同时诱导出T细胞免疫,以Th1免疫应答为主,无SAE发生,根据其Ⅲ期临床中期分析数据,其有效率为94.5%。
德国BioNTech公司、美国辉瑞(Pfizer)公司及中国复星医药(Fosun Pharma)集团合作共同开发mRNA疫苗BNT162b2。2020年7月27日启动Ⅱ/Ⅲ期临床试验,招募3万名受试者。9月12日,宣布临床试验扩大到4.3万名受试者。10月,获得对12岁以下儿童进行试验的许可,是美国的首次试验。根据其Ⅲ期临床中期分析数据,该疫苗预防COVID-19的保护率为95.0%。但该疫苗需要冷链运输,所以有一定的限制性。
重组蛋白疫苗是使用2019-nCoV蛋白或者蛋白片段激发免疫应答的疫苗,其以合成肽或重组蛋白为基础。2019-nCoV的重组蛋白疫苗多为重组表达的S蛋白,具有生产速度快、产品成分明确以及安全性好的优点。这些重组蛋白在不同的系统中产生,包括昆虫细胞(NCT04522089)、哺乳动物细胞(CHO细胞,NCT04466085)、酵母[30]或植物[24]。但重组蛋白疫苗也存在激发T细胞应答能力较弱且需要佐剂等问题。
蛋白质亚基疫苗目前大多数仍在临床前阶段,美国Novavax公司研发的蛋白疫苗NVX-CoV-2373(纳入"Warp Speed"计划)开始于2020年9月,率先在英国开展Ⅲ期临床试验,计划招募1.5万名受试者。11月底,美国启动受试者更多的Ⅲ期临床试验。参与者分别在第0天和第21天接受1次注射,结果显示该疫苗耐受良好,在所有治疗条件下均未报告不良事件[31]。
铝佐剂是得到许可疫苗中使用时间最长、最频繁的佐剂,是一种Th2型佐剂,能引起较强的体液免疫反应,包括产生中和抗体[32]。另一种广泛用于冠状病毒疫苗的佐剂是乳剂,常用的有弗氏佐剂和MF59。由于先天免疫系统主要通过模式识别受体(PRRs)识别病原体相关分子模式(PAMPS)。而toll样受体(TLR)是最具特异性的PRRs之一,广泛分布于抗原呈递细胞中,在触发先天免疫、启动适应性免疫应答等方面发挥重要作用。因此,一些TLR激动剂已被研究作为病毒特异性疫苗佐剂来诱导强而持续的免疫应答[33,34]。
以上佐剂有一定的优势但也存在一定的劣势,因此疫苗佐剂的应用需要深入了解佐剂对免疫应答的影响及其作用机制。除了考虑安全性外,佐剂的设计还必须注意选择性诱导和调节机体免疫应答类型的能力,以便有效地促进体液和细胞免疫以对抗冠状病毒感染。值得注意的是,现有的成熟佐剂可以与新的免疫刺激剂(如TLRs激动剂)联合使用,以提高免疫反应的广度和强度,这已成为探索有效佐剂系统的研究方向。
(1)2019-nCoV是一种全新的病毒,这种病毒刚刚在人类中出现,人们对其了解还不全面,其抗原特性、变异性及机体的免疫应答特征等,都还需要进一步的认识。
(2)对于疫苗能否对人群产生广泛的保护这一问题也还待考究。由于免疫衰老,老年人对疫苗接种的反应通常较差。有研究表明,对于老年人的流感疫苗需要特定配方,包括更多的抗原或佐剂。与年轻人相比,流感疫苗对老年人的保护似乎需要更高的中和效价。对于2019-nCoV来说,这个问题也是亟待解决的。
(3)需要关注疫苗免疫后的疾病增强现象,即病毒感染的抗体依赖性增强(ADE)。一些研究显示,在进行了SARS-CoV和MERS-CoV疫苗免疫后,动物再次暴露在活病毒下,可能加重疾病进程。虽然2019-nCoV疫苗接种后尚未发现ADE效应,但后期仍需进一步研究和密切关注。
(4)由于目前还没有已被批准的人类冠状病毒疫苗,同时研发过程中还使用了许多新型的技术(生产平台和载体等),因此需要进行彻底的安全测试。在将疫苗投入临床试验之前,需要完成两个重要步骤。首先,疫苗要在适当的动物模型中进行测试,验证其是否具有保护作用。然而,2019-nCoV感染的动物模型可能很难建立,病毒不在野生型小鼠中生长,只能在表达人ACE2的转基因动物中诱导轻度疾病。其次,需要对疫苗进行动物毒性测试,这种测试必须以符合药品非临床研究质量管理规范(GLP)的方式进行,通常需要3~6个月才能完成。
(5)供人类使用的疫苗必须在符合药品生产质量管理规范(GMP)的过程中生产,以确保疫苗的持续质量和安全。这需要专门的设施、训练有素的技术人员、适当的文件以及生产的原材料必须达到GMP标准。而对于许多处于临床前阶段的2019-nCoV疫苗来说,这些过程还不完善,必须从头开始建立标准。
(6)现在还不具备提供足够数量的符合GMP质量疫苗的生产能力。对于现有疫苗平台和基础设施,例如灭活或减毒活疫苗,可以相对容易实现。而对于其他类型的疫苗,如mRNA疫苗,符合GMP生产平台的建立是需要时间的。就流感疫苗来看,即使是欧美发达国家,大规模流行病对于疫苗的需求也远远超过目前生产能力。
COVID-19自暴发以来传播迅速,目前已蔓延到210多个国家和地区,对公共卫生造成了极大危害,并在世界范围内造成破坏性的社会和经济影响。因此,开发一种安全有效的疫苗是十分必要的。对于2019-nCoV疫苗的研发在各个方面面临的问题都是前所未有的,由于各种条件的限制,可用于人类的2019-nCoV疫苗很难满足现有需求,其安全性和有效性仍需进一步验证,如首次研发和应用的mRNA疫苗。此外,由于病毒不断进化和变异,给疫苗的研发带来更多、更大的挑战和考验。从研发的角度而言,或可考虑多靶点联合疫苗的可能,并在佐剂的研究上得到一定的突破,才能提高疫苗的有效性(即产生中和抗体的能力)并延长其半衰期。因此,2019-nCoV疫苗的研制仍需世界各国研究人员的不懈努力。此外,能够在短时间内开发、测试、生产和分发疫苗,还需要制药公司、政府、监管机构和WHO之间的紧密协调,才能更加迅速、科学、精准地应对突发的疫情。
所有作者均声明不存在利益冲突



























