
淋巴浆细胞淋巴瘤(LPL)是由小B淋巴细胞、浆细胞样淋巴细胞和浆细胞组成的肿瘤,可累及骨髓、淋巴结和脾脏等部位。骨髓穿刺活检多见,淋巴结为首次活检诊断极具挑战性。该文讨论肺癌术后多发淋巴结肿大病例,形态学上滤泡间区大量浆细胞及小淋巴细胞,免疫表型支持B细胞和浆细胞,分子检测B细胞克隆性重排和MYD88突变。LPL形态学及免疫表型与其他小B细胞淋巴瘤类似,给临床病理诊断带来困难,容易造成误诊或漏诊,需提高警惕。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
1.病史简介:患者男,60岁。2018年因肺癌复查发现颈部及腹腔淋巴结肿大,后来颈部肿大淋巴结自行消退。2019年血常规检查显示血红蛋白90 g/L,补铁治疗无明显改善;同时发现颈部淋巴结再次肿大,当地医院穿刺活检病理考虑为淋巴组织非典型增生。后来肿大淋巴结进行性增多,于2020年4月15日行颈部淋巴结活检。外周血IgM明显升高(46.4 g/L),蛋白电泳提示存在M蛋白。2020年6月PET/CT检查显示全身浅表及深部多发淋巴结肿大,以肝门区为著,最大约4.7 cm×4.4 cm,SUV最大值4.8;全身骨骼代谢弥漫性增高,SUV最大值2.8。患者自发病以来间断出现头痛及睡眠障碍。头颅CT检查未见明显肿物。无发热、盗汗及体重减轻,无丙型肝炎病史。
2.病理检查:(1)大体观察:淋巴结1枚,大小1.1 cm×0.9 cm×0.9 cm,切面淡褐色、实性、质软。(2)镜下观察:低倍镜下淋巴结固有结构部分破坏,被膜外脂肪组织内可见淋巴样细胞浸润(图1),小梁旁淋巴窦扩张,皮质区和髓质区可见散在分布的淋巴滤泡,滤泡间区轻度增宽(图2)。高倍镜下滤泡间区细胞成分多样,可见小淋巴细胞、浆细胞样淋巴细胞及浆细胞,部分区域浆细胞呈簇状聚集,散在含铁血黄素颗粒(图3),偶见Dutcher小体(图4);扩张的淋巴窦内聚集多量小淋巴细胞、浆细胞和组织细胞,偶见含铁血黄素颗粒。
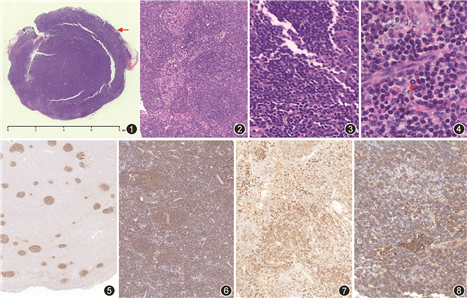

3.形态学讨论意见:综合大家讨论意见有如下考虑:(1)淋巴组织反应性增生(RH):扩张淋巴窦及散在分布的淋巴滤泡,滤泡间区以小淋巴细胞及浆细胞为主,不能除外RH。(2)滤泡性淋巴瘤(FL):病变区分布多个淡染的滤泡,部分区域滤泡密度偏高,套区不明显,首先要考虑FL。(3)套细胞淋巴瘤(MCL):本例为老年男性,为MCL的高发人群,病变呈结节状生长,以小淋巴样细胞为主;需要考虑MCL的可能性。(4)淋巴结边缘区B细胞淋巴瘤(NMZL):NMZL可以出现滤泡样的生长模式,细胞成分多样,包括小淋巴细胞、中心样细胞、单核样B细胞、浆细胞样淋巴细胞及浆细胞,形态学与本例相似。(5)小B细胞淋巴瘤/慢性淋巴细胞白血病(CLL/SLL):淋巴结外脂肪组织内小淋巴样细胞浸润,这种生长模式类似于CLL/SLL累及淋巴结。(6)淋巴浆细胞淋巴瘤(LPL):患者临床全身多发淋巴结肿大及贫血,伴外周血IgM升高,并有M蛋白,淋巴结滤泡间区多量淋巴细胞及浆细胞浸润,需要考虑LPL的可能性。
4.免疫组织化学结果:CD21和CD23染色可见均匀分布的滤泡树突细胞(FDC)网(图5)。CD20(图6)、PAX5和CD79α显示大部分细胞阳性,滤泡间区散在CD3和CD5阳性细胞;Ki-67染色显示生发中心阳性比例>40%,而滤泡间区约10%。以上免疫组织化学染色结果提示为B细胞病变,滤泡内还是滤泡间区的病变尚需要进一步分析。CD10、bcl-6和LMO-2染色显示明显减少的生发中心细胞,提示生发中心萎缩甚至消失,但这些细胞并不表达bcl-2,以上免疫表型可以除外生发中心细胞来源的肿瘤,如FL、弥漫性大B细胞淋巴瘤(DLBCL)和Burkitt淋巴瘤等。滤泡间区较多细胞CD38(图7)、CD138和MUM1阳性,提示存在多量浆细胞或伴有浆细胞分化的淋巴细胞,这些细胞同时表达IgM(图8)、不表达IgD、LEF-1、cyclin D1、SOX11和广谱细胞角蛋白(CKpan)。
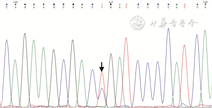
5. 分子生物学检测:淋巴结活检标本行EB病毒编码的小RNA(EBER)原位杂交检测,未见到EB病毒感染细胞。利用BIOMED-2检测方法对B细胞免疫球蛋白基因克隆性分析,显示FR1-JH、FR2-JH、FR3-JH、Vk-Jk和Vk-Kde呈克隆性重排。采用ABI3500 DX基因分析仪行MYD88(L265P)基因突变分析,可见核苷酸序列突变(图9)。

6. 最终病理诊断:(颈部)淋巴结非霍奇金LPL。
7. 补充活检:患者行髂后骨髓穿刺活检,形态学提示骨髓增生极度活跃,非小梁旁间质内淋巴细胞增多,肥大细胞易见,散在含铁血黄素沉积;浆细胞灶性分布。骨髓网状纤维染色提示为2级。免疫组织化学显示CD20阳性、CD138部分阳性、κ阳性/λ阴性,不除外LPL累及。骨髓行MYD88(L265P)基因突变分析,可见核苷酸序列突变。
8. 随访:患者明确诊断后于2020年6月4日开始行万珂+地塞米松(VD)方案化疗3个疗程,一般情况尚可,血常规提示红细胞、白细胞及血小板均减低。目前患者准备接受第4次化疗。
9. 讨论:本例为老年患者,既往肺癌伴淋巴结肿大多年,近2年出现贫血症状,临床提示血清IgM升高伴M蛋白,多次颈部淋巴结穿刺活检,未明确诊断,后行颈部淋巴结切除活检,显示淋巴结滤泡明显萎缩,病变主要位于滤泡间区及淋巴结外脂肪组织,以小淋巴细胞、浆细胞及浆样细胞为主,散在扩张淋巴窦及含铁血黄素颗粒,偶见Russel小体和Dutcher小体,结合病史及形态学改变,可初步考虑为伴有浆细胞分化的病变,是否为肿瘤性改变需借助免疫组织化学及分子生物学检测结果。结合本例CD20阳性细胞,B细胞克隆性检测提示单克隆,支持B细胞淋巴瘤;伴有浆细胞分化的B细胞淋巴瘤种类多样,如:浆细胞肿瘤(PCN)、NMZL、LPL和FL伴有浆细胞分化等,因此,结合临床免疫球蛋白检测结果及必要的分子生物学检测对本例病变的诊断非常重要。本例淋巴结和骨髓活检行MYD88(L265P)基因突变分析均可见核苷酸序列突变,因此,最终诊断为LPL。
2017年WHO造血与淋巴组织肿瘤分类中定义LPL是一种由小B淋巴细胞、浆细胞样淋巴细胞和浆细胞组成的肿瘤,通常累及骨髓,也可累及淋巴结和脾脏,同时不符合其他伴有浆细胞分化的小B淋巴细胞肿瘤的诊断标准[1]。LPL几乎总是伴有骨髓浸润,表现为弥漫性、间质性、小梁旁等[2],罕见窦内侵犯,这点不同于边缘区B细胞淋巴瘤[3]。累及淋巴结时常保存淋巴结原有结构,缺乏边缘区生长模式,淋巴窦扩张,出现Dutcher小体、肥大细胞增多和含铁血黄素沉积有助于诊断[4]。LPL表达大部分B细胞免疫标志物,单一性免疫球蛋白轻链和IgM等,不同程度表达浆细胞标志物,但缺乏特异性免疫表型,仅凭组织形态学及免疫表型很难明确诊断。近年来研究发现,大约90%的LPL存在MYD88(L265P)体细胞染色体3p22.2上的单个核苷酸改变以辅助LPL的诊断[5]。MYD88(L265P)突变是指髓系分化因子88基因(MYD88)中的单一核苷酸发生替换,导致第265位亮氨酸转变为脯氨酸(L265P)[6]。然而,MYD88 (L265P)并非LPL特有的遗传学改变,其他B细胞淋巴瘤中也可出现,如30%生发中心外起源的DLBCL[7]、少量CLL/SLL[8]和黏膜相关淋巴组织边缘区B细胞淋巴瘤[7, 8];NMZL和浆细胞肿瘤几乎不伴有MYD88(L265P)突变[9, 10]。
本例诊断难点是淋巴结LPL与其他非霍奇金淋巴瘤(NHL)的鉴别诊断,尤其是NMZL。形态学上,异质性的肿瘤细胞、突出的单核细胞分化、明显的反应性滤泡增生、边缘区生长模式以及破坏的FDC网结构等特征支持NMZL的诊断;而LPL中的肿瘤细胞成分比较单一,通常累及淋巴结的髓质或滤泡间区,伴有明显浆细胞分化、开放的淋巴窦,IgM蛋白升高[11],常合并MYD88突变;此外,LPL是系统性疾病,常伴有骨髓受累、贫血以及神经系统症状的表现,本例患者的临床表现、组织学特征、免疫表型及分子生物学结果均支持LPL的诊断。有些CLL病例,可能会出现CD5弱表达或阴性,甚至伴有少见的MYD88突变[12]。鉴别这类罕见病例具有挑战性,然而,形态学上存在假增殖中心有助于CLL的诊断。此外,CLL表达特异性的标志物LEF1,而不表达于LPL。
本文讨论了肺癌术后多发淋巴结肿大的LPL病例,淋巴结为首次活检诊断LPL极具挑战性,在工作中记住以下几点就可能避免漏诊和误诊:(1)淋巴结内窦扩张,淋巴滤泡萎缩,滤泡间区内大量浆细胞及小淋巴细胞聚集时,一定要关注患者临床信息。(2)临床表现为不明原因的免疫球蛋白升高、M蛋白血症和/或血常规异常时,应该想到LPL的可能,同时关注骨髓病理。(3)诊断困难时,可检测MYD88 (L265P)突变来明确LPL的诊断。
所有作者均声明不存在利益冲突



























