
输注红细胞是纠正贫血的重要治疗手段,绝大部分早产儿住院期间需输注1次甚至多次红细胞。红细胞输注益处与风险并存,临床医师把握好输血时机和指征非常重要。目前全球对于新生儿红细胞的输注指征尚未达成共识,考虑到红细胞输注对早产儿近、远期预后的影响,目前迫切需要规范输血行为,避免不合理用血。本文对早产儿输注红细胞的相关研究进展进行综述,为新生儿科临床医师优化早产儿输血策略提供参考。

输注红细胞(red blood cell transfusion,RBCT)是治疗早产儿贫血最常见的措施。研究报道近90%的极低出生体重儿(very low birth weight infant,VLBWI)和60%的极早产儿住院期间至少接受过1次RBCT治疗[1]。目前,新生儿RBCT指征在全球尚未达成共识,国内大多数新生儿重症监护病房(neonatal intensive care unit,NICU)亦缺乏统一标准,现有RBCT指南多源自专家共识。RBCT对新生儿尤其是早产儿近远期预后的影响引起了越来越多的关注,其可能导致支气管肺发育不良(bronchopulmonary dysplasia,BPD)、坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、脑室内出血(intraventricular hemorrhage,IVH)和早产儿视网膜病(retinopathy of prematurity,ROP)等常见并发症并影响神经系统发育。多数专家认为应严格把握输血指征,谨慎决定是否进行RBCT。多项研究亦将重点转向限制性输血及自由性输血对新生儿常见疾病发病率及病死率的对比,但目前尚无定论。本文就近期早产儿RBCT的相关研究进行综述,以期帮助新生儿科临床医师优化输血策略。
生理性贫血是婴儿期的一种良性现象,是新生儿从宫内环境过渡到宫外环境后出现的血红蛋白(hemoglobin,Hb)水平暂时性下降。Hb最低值常出现在6~12周龄,多波动在95~110 g/L之间。早产儿贫血较足月新生儿发生更迅速,程度更重,主要原因为:(1)成人红细胞寿命在90~120 d,新生儿红细胞寿命仅为成人的一半,甚至更短,早产儿出生时红细胞储存更少;(2)早产儿骨髓红细胞增生能力弱,未成熟的肝肾化学感受器对组织缺氧相对不敏感,血浆促红细胞生成素(erythropoietin,EPO)水平低,且胃肠道发育不成熟影响造血所需营养素的吸收及利用,导致红细胞生成减少[2];(3)早产儿住院期间并发症多,常导致消耗性贫血,且早产儿住院期间常需多次取血进行血液学检测。美国2019年的一项回顾性研究表明VLBWI生后前2周累计实验室采血量约48 ml/kg,达总血容量的1/3甚至以上,胎龄和出生体重越小,采血量越大[3]。实验室采血是早产儿发生贫血的重要医源性因素。
约32%的VLBWI入院时即存在贫血,贫血使早产儿动脉导管未闭及IVH等的发病率及病死率增高[4]。一项前瞻性多中心观察队列研究发现严重贫血(Hb<80 g/L)使VLBWI的NEC发生率增加约5.99倍[5]。早期贫血是早产儿严重IVH的独立危险因素,长期贫血还影响大脑氧供,增加早产儿神经发育不良结局风险[6, 7]。因此预防和治疗贫血是必要的,而迄今为止,RBCT是早产儿最常见的纠正贫血的方法,但同时也是一把双刃剑。
1.早产儿RBCT的益处:早产儿贫血时进行RBCT的目的通常是提高机体的携氧能力和血容量,维持心肺循环稳定,支持生长发育。我国的一项前瞻性队列研究发现,贫血早产儿RBCT后的心率、呼吸频率异常及呼吸暂停发作次数减少,其中21%的早产儿RBCT后下调了呼吸支持参数[8]。Kasat等[9]的研究发现RBCT后患儿心动过速症状得到较明显的改善。多项研究发现RBCT后近红外光谱法(near-infrared spectroscopy,NIRS)测得早产儿大脑、肾脏、肠道和肌肉等区域组织氧饱和度升高,表明RBCT可以提高早产儿携氧能力,从而改善贫血引起的组织缺氧,并可能减少神经发育不良的发生[10, 11]。
但也有研究认为RBCT与心率变化、呼吸暂停发生频率、呼吸支持模式、体重变化无显著相关性[12]。纽约的一项前瞻性随机对照试验(randomized controlled trial,RCT)发现,早产儿RBCT与输注白蛋白在降低呼吸暂停发作频次方面有相似作用[13]。而RBCT前后呼吸、心率的改变是因为携氧能力的上升还是血容量的增加,亦或有其他机制尚不明确,还需更多研究来阐明。
2.早产儿RBCT的风险:除输血一般风险如血液传播感染性疾病、过敏反应、铁超载和循环超负荷外,近年RBCT对早产儿常见并发症如ROP、BPD、NEC及IVH发生发展的影响引起了越来越多学者的关注。美国亚特兰大市的一项回顾性多中心观察队列研究纳入了598例VLBWI,发现在调整基线疾病及严重程度等因素后,RBCT量每增加20 ml,VLBWI的BPD发生率增加1.05倍[14]。美国一项纳入了1 635例早产儿(胎龄≤32周或体重≤1 500 g)的单中心回顾性研究发现,生后10 d内进行RBCT使早产儿严重ROP(≥3级)发生风险增加3.8倍[15]。可能机制是RBCT后铁超载诱导自由基氧化损伤,且输注的成人血红蛋白迅速增加视网膜及肺部氧气供应,加重了ROP及BPD的发展[15, 16]。NEC和IVH在早产儿中多发,具有高致残率和高致死率。RBCT后内脏血容量急速增加及RBCT后2~4 h的白细胞介素1β、白细胞介素8、肿瘤坏死因子等炎性因子显著增加,可能导致肠道缺血-再灌注损伤及大脑生发基质机械性和氧化应激损伤,增加早产儿NEC及IVH发生率[17, 18]。Christensen等[19]的一项对VLBWI进行的为期9年的回顾性研究发现,生后1周内RBCT组患儿较早期无RBCT组患儿IVH发生率高25%。多项队列研究及荟萃分析的结论显示严重贫血增加NEC发生风险,但RBCT不是NEC的独立危险因素[9,20, 21]。Dekom等[6]的研究表明生后1周内贫血[红细胞压积(hematocrit,HCT)< 45%]使IVH发生率增加2倍。
目前关于RBCT影响ROP、BPD、NEC及IVH等的研究多为观察性研究,存在贫血程度、高度异质性的输血阈值等混杂因素,仍需要进行大规模的前瞻性RCT,以明确RBCT在早产儿常见并发症发生发展中所起的作用。
在NICU中,除了某些特定疾病,如急性失血性休克有相对明确的输血标准外,早产儿贫血还没有统一的输血规范指南。目前通常由医生根据患儿病情及其所在医疗机构的输血指南决定是否进行RBCT,因此,在NICU中使用的RBCT准则多是主观和广义的。美国犹他州使用同一输血策略的4个NICU的输血率波动于4.6~21.7/1 000住院日之间[22]。而早产儿生理及病理情况复杂,难以确立统一的RBCT指征。
1.RBCT相关临床指征:现有RBCT指南多基于临床专家意见,普遍建议综合考虑早产儿临床表现和辅助检查及其具体生理需求决定是否进行RBCT。RBCT的临床指征主要包括贫血引起的循环灌注不足症状,如面色苍白、心动过速、心动过缓、气促、呼吸暂停、呼吸支持参数上调、少动、喂养不耐受及体重增长不良等[23, 24]。2019年一项对澳大利亚及新西兰252名临床医生的调查显示,医生主要根据患儿临床症状(98%)做出RBCT决策,常见症状有呼吸支持及氧气需求增加(89%)、呼吸暂停及心动过缓(75%)、体重增长缓慢(41%)[25]。但这些症状均高度非特异,很多早产儿并发症如新生儿败血症、新生儿呼吸窘迫综合征、慢性肺部疾病等亦可引起类似表现,因此难以分辨引起这些症状的真实原因,同时有观察性研究报告RBCT前后并没有客观且确切的短期临床改善[12]。
2.RBCT相关辅助检查:在实验室检查方面, 90%以上的临床医生通过Hb和HCT决定是否行RBCT [25]。早产儿Hb及HCT的正常参考范围较宽,所以RBCT的阈值及输血后需达到的Hb值难以标准化。全球RBCT指南虽不尽相同,但均将Hb、HCT与早产儿胎龄、日龄、呼吸支持模式相结合[26, 27, 28, 29]。各国RBCT阈值见表1。
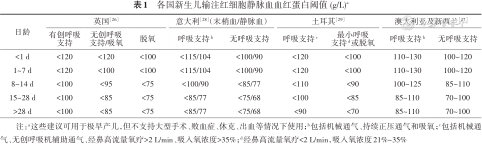
各国新生儿输注红细胞静脉血血红蛋白阈值 (g/L)a
各国新生儿输注红细胞静脉血血红蛋白阈值 (g/L)a
| 日龄 | 英国[26] | 意大利[28](末梢血/静脉血) | 土耳其[29] | 澳大利亚及新西兰[27] | |||||
|---|---|---|---|---|---|---|---|---|---|
| 有创呼吸支持 | 无创呼吸支持/吸氧 | 脱氧 | 呼吸支持b | 无呼吸支持 | 呼吸支持c | 最小呼吸 支持d或脱氧 | 呼吸支持b | 无呼吸支持 | |
| <1 d | <120 | <120 | <100 | <115/104 | <100/90 | <120 | <100 | 110~130 | 100~120 |
| 1~7 d | <120 | <100 | <100 | <115/104 | <100/90 | <120 | <100 | 110~130 | 100~120 |
| 8~14 d | <100 | <95 | <75 | <100/90 | <85/77 | <110 | <90 | 100~125 | 85~110 |
| 15~28 d | <100 | <85 | <75 | <85/77 | <75/68 | <100 | <85 | 85~110 | 70~100 |
| >28 d | <100 | <85 | <75 | <85/77 | <75/68 | <90 | <70 | 85~110 | 70~100 |
注:a这些建议可用于极早产儿,但不支持大型手术、败血症、休克、出血等情况下使用;b包括机械通气、持续正压通气和吸氧;c包括机械通气、无创呼吸机辅助通气、经鼻高流量氧疗>2 L/min、吸入氧浓度>35%;d经鼻高流量氧疗<2 L/min,吸入氧浓度21%~35%
血乳酸水平可反应缺氧情况,亦可作为RBCT临床指标。研究表明RBCT后血乳酸水平显著降低,且毛细血管乳酸水平基本与动脉血乳酸水平相当,毛细血管检测乳酸用血量少,故可作为机体灌注指标指导输血,但乳酸易受外周循环条件及机体清除率等多种因素影响,存在一定波动性[30]。研究表明早产儿Hb水平与脑局部氧饱和度成正相关,RBCT后脑局部氧饱和度显著增加[31, 32]。研究发现RBCT后脑、肾等组织的氧供增加了10%~18%,提示局部组织氧合增加[33]。NIRS无创、便利,目前缺乏局部脏器氧饱和度的统一基线值,但NIRS有望发展为RBCT前后疗效评价的无创监测手段。
3.限制性及自由性RBCT:早产儿应用RBCT并非没有风险,RBCT是危重儿童死亡的独立危险因素[34],现今的输血标准普遍由自由性输血(literal blood transfusion guideline,LTG)转为限制性输血(restrictive blood transfusion guideline,RTG)。对于LTG及RTG仍存在较多争议,美国和荷兰的回顾性研究及加拿大的一项RCT均发现RTG降低了早产儿RBCT带来的抗体暴露及输血风险,且未增加早产儿死亡率、出血风险、常见疾病短期发病率及认知发育障碍风险[35, 36, 37]。但Boedy等[38]的一项RCT发现,RTG组虽减少了输血次数,但抗体暴露减少并无统计学意义,且RTG组更可能发生IVH、脑室病变及频繁呼吸暂停。迄今为止对于LTG及RTG的大部分研究集中于短期结局,对神经发育的影响尚不明确,且关于LTG及RTG的具体阈值仍存在争议。
4.红细胞输注量及储存时间:在纠正新生儿贫血时的RBCT通常为小剂量输注(5~20 ml/kg),中位量是15 ml/kg,一般4 h内输注完毕[26, 27, 28, 29]。输注量过大可能增加循环超负荷风险,输血量和输血相关的呼吸功能障碍发生率存在剂量-反应关系[39]。但亦有研究认为输注较大剂量红细胞会提高输血后Hb水平,延长输血间隔时间,减少抗体暴露,且对呼吸无明显影响[29,40]。关于新生儿RBCT最佳剂量的证据非常有限,尤其是涉及长期神经发育结局时。
血库常优先为新生儿提供更新鲜的红细胞,但输注标准储存时间内的红细胞是否增加新生儿感染及高钾血症等发生率及死亡率尚无证据,所以目前多数指南建议新生儿输注保质许可期限内的红细胞,没必要必须选择储存期<10 d的新鲜红细胞[41, 42]。建议使用小份多包包装,在规定时间内多次输注可减少抗体暴露及血液制品浪费[29,43]。然而Kalhan等[44]提出输注储存时间过长的红细胞(尤其是超过20 d)会使新生儿体内非转铁蛋白结合铁增加,在动物模型中非转铁蛋白结合铁可促炎性细胞因子反应,增加大肠埃希菌等革兰阴性菌的增殖。因此还需更多的研究来指导红细胞储存的管理。
减少输血风险最好的方法就是减少输血需求。当前减少早产儿输血需求的方法有延迟脐带结扎、减少采血、使用EPO等。其中延迟脐带结扎(≥30 s)是最经济方便的方法,可增加早产儿出生后早期的红细胞储备,使早产儿生后第1周HCT增加2.7%,输血需求减少10% [45]。瑞典的一项随访研究表明,延迟钳夹脐带使新生儿生后第1年铁蛋白水平升高并可改善神经发育预后[46]。减少早产儿医源性失血量是最重要且最有效的方法,包括使用胎盘或脐带血送检入院检查、使用床旁分析仪器监测血气和生化、优化采血项目及频率、使用最小体积的新生儿采血管、发展如NIRS等无创监测手段等方法。EPO的使用剂量及时间尚未明确,临床证据有限,且可能增加ROP发生风险,暂不建议早期给予EPO[47]。
RBCT是治疗早产儿严重贫血的唯一方法,所有新生儿救治中心应均衡输血的利弊,严格遵守现有输血指南,谨慎输血。目前还需更多的前瞻性研究及针对特定新生儿亚群的大型研究来明确适当的RBCT指征。降低早产儿RBCT风险最经济有效的方法是降低输血需求,应着力于进一步减少医源性失血,发展无创性监测手段,实施延迟脐带结扎,及时识别及治疗早产儿相关并发症。
所有作者均声明不存在利益冲突



























