
2019冠状病毒病(COVID-19;我国通称新型冠状病毒肺炎,简称新冠肺炎)大流行是全球瞩目的公共卫生问题。中华医学会呼吸病学分会和中国医师协会呼吸医师分会组织多学科专家总结了COVID-19病原学、流行病学、病理变化、发病机制、临床特点、诊断、治疗、康复、防控等方面的关键问题,制订了《中国成人2019冠状病毒病的诊治与防控指南》。本指南的制订遵循《世界卫生组织指南制订手册》及中华医学会《制订/修订<临床诊疗指南>的基本方法及程序》,旨在进一步规范我国成人COVID-19患者的诊治与疫情防控。

目次
第一部分:方法学(陈耀龙)
一、指南制订发起机构
二、指南工作组
三、利益冲突声明与管理
四、指南使用者与目标人群
五、指南范围与优先临床问题的确定
六、证据的检索与评价
七、指南要点与推荐意见的形成
八、指南的撰写、外审与批准
九、指南的发布、传播与更新
第二部分:新型冠状病毒(胡犇、谭文杰、石正丽)
一、病毒特征
二、病毒的进化与突变
三、SARS-CoV-2与SARS-CoV、MERS-CoV的区别
第三部分:流行病学
一、传染源(冯录召、杨维中)
(一)COVID-19患者
(二)无症状感染者
(三)受感染的动物
二、传播途径(冯录召、杨维中)
(一)呼吸道飞沫传播
(二)接触传播
(三)气溶胶传播
(四)传播重点环节与场所
(五)其他可能的传播途径
三、易感人群与重症高危人群(程真顺、陈荣昌)
四、再感染、复查核酸阳性(冯录召、杨维中、陈荣昌)
五、疾病负担(冯录召、杨维中)
(一)健康负担
(二)经济负担
第四部分:病理变化(平轶芳、卞修武)
一、COVID-19呼吸系统病理变化
二、COVID-19免疫器官病理变化
(一)脾脏病理变化
(二)淋巴结病理变化
(三)骨髓病理变化
三、COVID-19其他脏器病理变化
(一)心血管系统病理变化
(二)消化系统病理变化
(三)泌尿生殖系统病理变化
(四)中枢神经系统病理变化
(五)其他
第五部分:发病机制(曹彬、吴玉章)
一、SARS-CoV-2感染的细胞与器官
二、免疫系统的保护作用
三、病理损伤机制
第六部分:临床特点
一、临床表现(张静、瞿介明)
二、实验室检查(张静、瞿介明)
三、并发症(张静、程真顺、瞿介明)
四、影像学表现(张静、瞿介明)
五、长期预后(曹彬)
第七部分:诊断
一、诊断标准与鉴别诊断(赵建平)
(一)诊断标准与临床分型
(二)鉴别诊断
二、病原学诊断(任丽丽、王健伟)
三、影像学诊断(张静、瞿介明)
第八部分:治疗
一、一般治疗(周敏)
二、抗病毒治疗
(一)瑞德西韦(曹彬、王辰)
(二)洛匹那韦/利托那韦(曹彬、王辰)
(三)羟氯喹(瞿介明)
(四)氯喹(江山平、李时悦)
三、中和抗体与血浆治疗
(一)单克隆中和抗体(严景华、高福)
(二)恢复期血浆(刘忠)
四、免疫调节治疗
(一)糖皮质激素(徐金富、宋元林)
(二)静脉注射人免疫球蛋白(张伟)
(三)托珠单抗(熊维宁、宋元林)
(四)Janus激酶抑制剂(周敏)
(五)干扰素(卢洪洲)
(六)重组人粒细胞集落刺激因子(程璘令、李时悦)
五、氧疗和呼吸支持治疗
(一)氧疗(梁宗安)
(二)经鼻高流量湿化氧疗(梁宗安)
(三)无创通气(梁宗安)
(四)有创通气(彭志勇)
(五)ECMO(詹庆元)
六、抗凝治疗(翟振国)
七、抗细菌与抗真菌治疗(徐金富)
第九部分:康复干预(谢欲晓、赵红梅)
一、康复的介入时机
二、早期活动
三、胸部物理治疗技术
四、居家康复训练
第十部分:疫情防控
一、社会防控(冯录召、杨维中)
(一)非药物干预措施
(二)社会防控建议
二、社区防控(张灿有、吴浩)
三、医院防控(路简羽、李六亿)
(一)管理组织
(二)工作人员培训
(三)COVID-19预防与控制措施
四、疫苗接种(宋全伟、王华庆)
(一)COVID-19疫苗技术路线特性及研发进展
(二)COVID-19疫苗接种免疫策略
第十一部分:未来研究重点(曹彬)
一、SARS-CoV-2的病毒特征
二、发病机制
三、流行病学
四、临床表现
五、诊断与治疗
六、康复
七、疫苗
八、社会防控
参考文献
附录:英文缩略词表
2019冠状病毒病(COVID-19;我国通称新型冠状病毒肺炎,简称新冠肺炎)大流行是全球瞩目的公共卫生问题。尽管我国已初步控制住了COVID-19疫情,但是由于目前全球疫情加速蔓延,境外输入、冷链传播、病毒株变异等因素导致本地传播的风险增大,我国可能在未来一段时间内仍处于疫情散发状态,并且局部地区可能出现聚集性病例。目前COVID-19临床诊疗已积累了大量证据,我国亟需一部符合国情的循证诊治与防控指南。为此,中华医学会呼吸病学分会(Chinese Thoracic Society,CTS)与中国医师协会呼吸医师分会(Chinese Association of Chest Physicians,CACP)组织多学科专家制订了本指南,旨在进一步规范我国成人COVID-19患者的诊治与疫情防控。
本指南的制订遵循世界卫生组织(World Health Organization,WHO)2014年发布的《世界卫生组织指南制订手册》[1]及2016年中华医学会发布的《制订/修订<临床诊疗指南>的基本方法及程序》[2],并依据国际实践指南报告标准(Reporting Items for Practice Guidelines in Healthcare,RIGHT)[3]和指南研究与评价(Appraisal of Guidelines for Research and Evaluation Ⅱ,AGREE Ⅱ)工具撰写全文[4]。本指南已在国际实践指南注册平台(International Practice Guideline Registry Platform)上注册(注册号IPGRP-2020CN187)。
该指南由CTS与CACP发起,兰州大学健康数据科学研究院指南与标准研究中心、中华医学会杂志社指南与标准研究中心、WHO指南实施与知识转化合作中心、兰州大学GRADE中心、Cochrane兰州大学中心提供方法学支持。
本指南制订工作组由指南专家组、指南方法学组、指南协调组、指南外审组构成。
指南专家组:由呼吸与危重症医学、感染病学、重症医学、病毒学、免疫学、病理学、流行病学、输血医学、预防医学、康复医学等多学科专家构成,主要职责为:(1)确定指南范围及优先的临床问题;(2)各专家对各自负责的章节进行文献检索和证据评价,初拟要点和推荐意见,撰写章节初稿;(3)根据指南方法学组和指南协调组的反馈对初拟要点、推荐意见和章节初稿进行修改;(4)通过Delphi法对要点和推荐意见达成共识;(5)审定指南全文初稿和终稿。
指南方法学组:由指南方法学家和循证医学专家构成。主要职责为:(1)协助确定指南范围及优先的临床问题;(2)确定适用于本指南的证据评价和推荐意见形成的方案;(3)总结目前COVID-19指南的推荐意见,供专家组参考;(4)对专家组进行方法学培训,明确指南证据检索与评价方法以及撰写规范;(5)与指南协调组合作审核初拟要点、推荐意见和章节初稿;(6)提供必要的其他方法学支持。
指南协调组:主要职责为:(1)协助确定指南范围及优先的临床问题;(2)撰写指南计划书;(3)收集利益冲突声明;(4)制订指南工作计划、推动指南工作计划的执行;(5)协助专家组进行文献检索和初稿撰写;(6)和指南方法学组合作审核初拟要点、推荐意见和章节初稿;(7)进行整个指南制订过程的质量控制。
指南外审组:指南外审组由不参与指南制订的相关学科专家构成。指南初稿形成后,指南外审组阅读并反馈意见。
本指南工作组成员均填写利益声明表,声明近3年相关的经济利益冲突与学术利益冲突。收集汇总后的利益声明表经指南方法学组讨论判定,若专家组成员声明的利益关系对指南的内容构成利益冲突,则根据利益冲突的程度限制核心工作的参与或排除在本次指南的制订过程之外。
本指南供呼吸与危重症医学科、感染科、重症医学科、急诊科、药剂科、影像科等参与COVID-19诊疗管理的临床学科专业人员,以及病毒学、免疫学、流行病学、预防医学等其他COVID-19疫情防控相关专业人员使用。指南推荐意见的目标人群是成人COVID-19患者。
指南范围由CTS和CACP相关专家起草,在第一次全体专家讨论会中确定了本指南范围。指南的编写采取每个章节指定相应专家负责的方式。每一章节对应的临床问题由负责专家提出,并由指南方法学组和指南协调组整合、审核、提出修改建议,最后由指南专家组确定。此次指南对两类临床问题(背景问题和前景问题)进行回答。
指南方法学组在指南工作启动会后对各专家团队进行方法学培训,严格地进行文献检索策略的制定、文献筛选与评价。本指南采用“COVID-19、2019-nCoV、Coronavirus Disease 2019、新型冠状病毒、新冠肺炎”等检索词系统检索Medline、Cochrane Library、WHO COVID-19数据库(https://search.bvsalud.org/global-literature- on-novel- coronavirus-2019-ncov/)、Epistemonikos COVID-19 数据库(https://iloveevidence.com/)、中华医学会杂志社新型冠状病毒肺炎科研成果学术交流平台(http://medjournals.cn/2019NCP/index.do)、中国生物医学文献服务系统、万方知识数据服务平台和中国知网数据库,纳入COVID-19相关的系统评价、随机对照试验(randomized controlled trial,RCT)和观察性研究等。运用系统评价偏倚风险评价工具(a measurement tool to assess systematic reviews,AMSTAR)量表对纳入的系统评价、荟萃分析和网状荟萃分析进行偏倚风险评价。使用Cochrane偏倚风险评价工具(risk of bias,ROB);针对RCT诊断准确性研究的质量评价工具(quality assessment of diagnostic accuracy studies,QUADAS-2;针对诊断准确性试验研究)等对相应类型的原始研究进行方法学质量评价。各专家团队在证据检索、评价等过程中如果遇到疑问,方法学组和协调组成员将进行协商解决并进行质量控制。
本指南基于背景问题和前景问题两种方式撰写。背景问题采用要点总结的形式撰写。前景问题按照推荐意见、推荐意见说明、证据总结(推荐依据)的形式进行撰写,并采用2009版牛津大学循证医学中心的证据分级和推荐强度标准(表1)对推荐意见的证据水平和推荐强度进行分级(OCEBM Levels of Evidence Working Group;https://www.cebm.ox.ac.uk/resources/levels-of-evidence/oxford-centre-for-evidence-based-medicine-levels-of-evidence-march-2009)。综合考虑我国患者的偏好与价值观、干预措施的成本和利弊等因素后,专家组形成初拟的要点和推荐意见。方法学组和协调组对初拟的要点和推荐意见进行评估,给出反馈意见,经过两轮的反馈修改后,指南专家组成员通过Delphi的方法对所有要点和推荐意见进行共识,确定最终的要点和推荐意见。

2009版牛津大学循证医学中心的证据分级与推荐强度标准
2009版牛津大学循证医学中心的证据分级与推荐强度标准
| 推荐强度 | 证据级别 | 治疗或危害 |
|---|---|---|
| A | 1a | 同质随机对照试验的系统评价 |
| 1b | 单个随机对照试验(可信区间窄) | |
| 1c | “全或无”的病例系列研究 | |
| B | 2a | 同质队列研究的系统评价 |
| 2b | 单个队列研究(包括低质量随机对照试验,如随访率<80%) | |
| 2c | 结果研究或生态学研究 | |
| 3a | 同质病例-对照研究的系统评价 | |
| 3b | 单个病例-对照研究 | |
| C | 4 | 病例系列研究(包括低质量队列或病例-对照研究) |
| D | 5 | 基于经验未经严格论证的专家意见或评论或基础实验 |
注:对于因以下任一原因导致无法得出确定性的结论的证据,使用者可以在证据级别后加上“-”,这类证据不具有确定性,只能获得D级推荐:(1)单个结果具有较宽的可信区间;(2)一个存在很大异质性的系统评价;原表见https://www.cebm.ox.ac.uk/resources/levels-of-evidence/oxford-centre-for-evidence-based-medicine-levels-of-evidence-march-2009
各部分初稿确定后,指南协调组整合指南初稿。经指南专家组审议通过后的指南初稿提交指南外审组进行审阅。基于指南外审组的反馈意见,章节负责专家和指南协调组对初稿进行修改,最后由指南专家组讨论批准指南的发布。
指南发布后将同时结合线上和线下的学术会议形式在全国范围内进行广泛传播,从而更好地促进指南的使用。指南发布后协调组会定期进行文献检索和评估,如果出现了可能改变要点或推荐意见的证据,将会启动相关章节的更新。
(陈耀龙)
1.新型冠状病毒(SARS-CoV-2)属于β冠状病毒属的严重急性呼吸综合征相关冠状病毒(SARSr-CoV)。
2.SARS-CoV-2基因组大小约为30 kb,具有典型的冠状病毒基因组结构。
3.SARS-CoV-2病毒颗粒呈球形,直径为60~140 nm,呈现典型的冠状病毒形态特征。可使用Vero E6等细胞进行分离培养。
4.血管紧张素转化酶2(ACE2)是SARS-CoV-2的受体。
5.SARS-CoV-2对高温、紫外线和多种消毒剂敏感。
新型冠状病毒是COVID-19的病原体,国际病毒分类委员会将其命名为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)。SARS-CoV-2是目前已知的第七种人类冠状病毒,属于β冠状病毒属的严重急性呼吸综合征相关冠状病毒(severe acute respiratory syndrome-related coronavirus,SARSr-CoV)[5]。
SARS-CoV-2基因组为单股正链RNA,大小约为30 kb,具有和其他β冠状病毒类似的基因组结构,包括6个主要的开放阅读框(open reading frame,ORF)。从基因组5′端到3′端依次为编码复制相关非结构蛋白的ORF1a/1b,以及分别编码刺突蛋白(S蛋白)、囊膜蛋白(E蛋白)、膜蛋白(M蛋白)和核衣壳蛋白(N蛋白)的4个结构蛋白基因。S基因下游还分布有ORF3、ORF6、ORF7a/7b、ORF8等多个编码辅助蛋白的附属基因[6, 7]。
SARS-CoV-2具有和其他冠状病毒类似的形态特征。病毒颗粒主要为球形,直径约为60~140 nm,有囊膜。囊膜表面分布有长约9~12 nm的刺状突起,为病毒的S蛋白,呈放射状排列。在电子显微镜下观察,病毒粒子外观形似日冕[8]。体外分离培养SARS-CoV-2时,在接种96 h后可在人呼吸道上皮细胞中观察到细胞病变,接种非洲绿猴肾细胞(Vero E6)和人肝癌细胞(Huh-7)等细胞3~6 d后出现典型的细胞病变[8, 9]。
SARS-CoV-2的受体为血管紧张素转化酶2(angiotensin converting enzyme 2,ACE2)[9]。病毒的S蛋白与ACE2结合,启动病毒入侵。除人ACE2受体外,SARS-CoV-2还可与猴、犬、猫、兔、穿山甲等多种哺乳动物的ACE2受体结合,表明其可能具有广泛的宿主范围[10]。此外,跨膜丝氨酸蛋白酶2(transmembrane serine protease 2,TMPRSS2)等宿主细胞蛋白酶能够协同SARS-CoV-2入侵细胞[11, 12]。
室温条件下,气溶胶中的SARS-CoV-2可在16 h内维持感染性[13]。SARS-CoV-2在不同物体表面的稳定性不同,在塑料、不锈钢等材料表面可存活3 d,在硬纸板、布料等材料表面的存活时间在1 d以内[13, 14]。SARS-CoV-2对高温和紫外线敏感。0.7~1.6 W/m2的中波紫外线照射可快速灭活病毒[15],56 ℃作用30 min能使病毒失活[13]。SARS-CoV-2在低温环境中(如冷链食品包装表面)可长时间存活[16]。冠状病毒普遍对化学消毒剂敏感。75%乙醇、0.5%过氧化氢溶液、次氯酸钠等含氯消毒剂均可有效灭活病毒[17]。
1.蝙蝠冠状病毒RaTG13是已知与SARS-CoV-2进化关系最近的病毒,但目前SARS-CoV-2从动物跨种传播到人群的直接源头仍然未知。
2.估测SARS-CoV-2进化速率约为每个位点8×10-4个替换/年。
3.SARS-CoV-2已经出现多种变异,其中S蛋白D614G突变毒株已在SARS-CoV-2的全球流行中占据主导地位。该突变可导致病毒感染力增强,但对疫苗功效造成影响的可能性低。
与SARS-CoV-2同处于β冠状病毒属、Sarbecovirus亚属同一进化分支的还包括在蝙蝠、穿山甲等野生动物中发现的冠状病毒,表明SARS-CoV-2可能来自野生动物[9,18, 19, 20, 21, 22]。已知和SARS-CoV-2最为相似的冠状病毒是在云南的中菊头蝠中发现的冠状病毒RaTG13,全长基因组序列相似度达到96.2%[9]。我国广西、广东两地海关截获的走私穿山甲中也发现了类似SARS-CoV-2的冠状病毒,其中广东截获的穿山甲中分离到的冠状病毒S蛋白受体结合区(receptor-binding domain,RBD)与SARS-CoV-2高度相似[21, 22]。尽管RaTG13是目前发现的与SARS-CoV-2亲缘关系最近的病毒,但它们之间还存在至少20年的进化距离,尚未在蝙蝠、穿山甲等动物中发现SARS-CoV-2的直接祖先[23]。SARS-CoV-2从动物跨种传播到人群的直接源头仍然未知。
截至2020年12月7日,国家生物信息中心2019新型冠状病毒信息库在对全球公布的229 812条SARS-CoV-2全基因组序列变异分析中,共鉴定出22 252个单核苷酸多态性(single nucleotide polymorphism,SNP)变异[24]。全球流感数据共享倡议组织(Global Initiative on Sharing All Influenza Data,GISAID)数据库按照SARS-CoV-2的代表性突变位点将SARS-CoV-2划分为多个主要的亚型,包括:L型(以武汉分离株为代表)、S型(标志性突变为C8782T,T28144C)、V型(标志性突变为G11083T,G26144T)、G型(标志性突变为C241T,C3037T,A23403G)等。估算测得SARS-CoV-2在人群中的突变速率约为8×10-4/位点/年,流感病毒突变速率约是其2~6倍[25, 26]。由于SARS-CoV-2进化速率相对较低,且具备高效的人际传播能力,说明其在大规模暴发时可能已经是一种适应人群的病毒[26, 27]。
S蛋白的D614G突变是SARS-CoV-2的一个典型突变。相比武汉分离株,一些毒株在基因组23403核苷酸位点上发生了非同义突变,导致S蛋白的614氨基酸位点由天冬氨酸(D)变更为甘氨酸(G)。目前这一突变毒株已成为全球SARS-CoV-2流行的主要形式,表明其可能具有适应性优势[28, 29]。相比D614毒株,G614毒株的感染性和病毒粒子稳定性更强,但没有证据表明该突变和疾病严重程度有关,且该突变对疫苗功效造成影响的可能性不大[28, 29, 30]。
另一个发生在S蛋白的典型突变为N501Y突变株。该突变株最早于2020年9月20日在英国出现,随后在南非等国家相继被报道。该突变株属于B.1.1.7分支,除N501Y之外,该分支还包含S蛋白的69~70 del、P681H等其他多个突变。S蛋白的501位点是与受体ACE2直接相互作用的关键位点之一。目前尚未有正式发表的研究数据证实该突变株是否在人群中具有更高的传播性以及是否与疾病的严重程度相关。
在人类这一新宿主中,为适应体内环境,病毒会加快变异和进化,今后可能会出现更多变异,变异后的病毒可能在感染性、潜伏期、传播性、致病性、体内存留时间、抗原性等多方面发生变化。因此,专业性的监测、判断和干预非常重要。
重点:
1.SARS-CoV-2与SARS-CoV、MERS-CoV的基因组相似度分别为79%和50%。
2.SARS-CoV-2的中间宿主未明确,SARS-CoV和MERS-CoV的中间宿主分别是果子狸和单峰骆驼。
3.SARS-CoV-2与SARS-CoV的受体都是ACE2,但SARS-CoV-2 S蛋白的ACE2亲和力高于SARS-CoV。MERS-CoV的受体则是DPP4。
4.SARS-CoV-2的传播能力高于SARS-CoV,远高于MERS-CoV。
5.SARS-CoV-2感染的病死率低于SARS-CoV(9.6%)和MERS-CoV(34%)。
除COVID-19之外,21世纪还出现过两种由冠状病毒引起的新发传染病。分别是2002—2003年在我国暴发的严重急性呼吸综合征(severe acute respiratory syndrome,SARS)和2012年出现在中东并在该地区多次暴发的中东呼吸综合征(Middle East respiratory syndrome,MERS),造成这两类疾病的病原分别是SARS冠状病毒(SARS-CoV)和MERS冠状病毒(MERS-CoV)。SARS-CoV-2、SARS-CoV和MERS-CoV是已知的三种高致病性冠状病毒。
SARS-CoV是人类冠状病毒中与SARS-CoV-2亲缘关系最近的一种,和SARS-CoV-2同属Sarbecovirus亚属,两者全长基因组序列相似度为79%。MERS-CoV与SARS-CoV-2的亲缘关系稍远,为Merbecovirus亚属成员,与SARS-CoV-2全长基因组序列相似度仅为50%[31]。蝙蝠可能是这三种冠状病毒的最初源头。目前已证实蝙蝠是SARS-CoV的自然宿主,果子狸是其中间宿主,而MERS-CoV的中间宿主是单峰骆驼[32, 33, 34]。SARS-CoV-2的动物溯源尚未清晰,中间宿主尚未确定。
SARS-CoV-2和SARS-CoV的受体同为ACE2。然而,SARS-CoV-2 S蛋白的RBD和SARS-CoV差异较大,在与ACE2结合的5个关键氨基酸位点上,SARS-CoV-2和SARS-CoV均不相同。这些差异使得SARS-CoV-2与ACE2受体结合的亲和力要高于SARS-CoV[35, 36]。MERS-CoV则通过结合二肽基肽酶4(dipeptidyl peptidase 4,DPP4)受体入侵细胞,与SARS-CoV-2完全不同[37]。
SARS-CoV-2的传播能力在三种高致病性冠状病毒中最强。估测得到SARS-CoV-2基本再生数(basic reproduction number,R0)在1.8~3.6之间。SARS-CoV的R0为2.0~3.0,略低于SARS-CoV-2[38]。和SARS-CoV和SARS-CoV-2相比,MERS-CoV传播能力较弱,R0低于1[39]。
SARS-CoV-2、SARS-CoV、MERS-CoV引起的疾病普遍表现为发热、咳嗽、乏力、呼吸困难、咽痛等,重症患者可进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[40]。从目前统计数据来看SARS-CoV-2感染的病死率<3%,其病死率低于SARS-CoV(9.6%)和MERS-CoV(超过30%)[41]。
(胡犇、谭文杰、石正丽)
COVID-19患者和无症状感染者是主要传染源。SARS-CoV-2感染的动物也可能为传染源。
COVID-19患者发病前(潜伏期)、发病期间和症状消失后(恢复期)均可能具有传染性。受体内病毒繁殖时间、病毒排出方式与数量等因素影响,COVID-19患者在不同临床进程中的传染性强弱有所差异[42]。
COVID-19病例常见潜伏期为1~14 d[43, 44, 45, 46, 47, 48],平均潜伏期约为5 d[43, 44, 45, 46, 47, 48]。同时也存在暴露后24 d出现症状的个案病例[45]。COVID-19病例可在症状出现前24~48 h排出病毒[43, 44, 45,49],成为潜在的传染源。
COVID-19患者在症状期传染性最强。COVID-19患者上呼吸道标本病毒载量在临床症状初期较高,1周之内达到峰值,随后1~3周缓慢下降[44,50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63]。下呼吸道样本中的病毒载量通常在发病后2周内达到高峰,且病毒载量高于上呼吸道样本[50,58,61,64, 65, 66]。粪便样本中病毒载量通常在发病后2~3周达到顶峰[53,64, 65,67, 68, 69, 70, 71, 72]。COVID-19患者病毒排出时间为8~37 d,平均为20 d[73]。
恢复期患者可能也是传染源。恢复期是指从COVID-19患者临床症状及体征基本消失,至恢复到疾病前状态的时期,此阶段SARS-CoV-2尚未被完全清除[42],鼻咽拭子和大便中可能检测到病毒的存在[74, 75]。
1.SARS-CoV-2主要传播途径是经呼吸道飞沫传播和接触传播。
2.在相对封闭的环境中长时间暴露,存在经气溶胶传播的可能性。
3.接触病毒污染的物品可造成感染,应关注冷链物品、普通货物等接触传播的风险。
呼吸道飞沫传播是指含有大量病原体的飞沫在呼气、咳嗽、打喷嚏时经口鼻排入环境所引起的传播,范围多在1 m之内,含有病毒的飞沫可以被易感者吸入而致病[89, 90, 91, 92, 93, 94]。
接触传播可分为直接接触传播和间接接触传播。SARS-CoV-2在环境中具有高度的传染性和稳定性[95]。目前的调查研究表明,在感染者的粪便、尿液中存在SARS-CoV-2,提示与COVID-19患者接触的家庭成员、医护人员等可能通过直接接触传播途径获得感染[96]。另外,有研究显示,眼结膜、眼角膜都存在ACE2受体,可能成为间接接触传播的潜在途径[97]。
冷链物品可携带SARS-CoV-2造成远距离传播,给接触者(工作人员和消费者)带来较大的感染风险。继北京市新发地之后,我国多地陆续报道从冷冻食品的外包装或相关冷链物品表面的样本中检测出SARS-CoV-2核酸、甚至活病毒,此前已有研究证实病毒可在冷链物品中存活较长时间,提示冷链物品可能成为新的传播途径[56,101, 102, 103]。
COVID-19聚集性疫情多发生于人群密集、相对封闭的重点场所,如医疗机构、社会福利机构、工厂、军队、监狱、学校、娱乐场所等。这些场所的人员间物理距离更短,身体接触更加紧密,相对封闭,加之一些社会、经济因素,使得他们更容易暴露和感染SARS-CoV-2[104]。
消化道存在ACE2受体、患者粪便可检测到SARS-CoV-2是经消化道传播的理论基础,但目前学界对SARS-CoV-2是否可经消化道传播还存在一定争议,有待进一步研究[96,105, 106]。母乳中可检测到SARS-CoV-2核酸,也有新生儿出生后鼻咽分泌物检测出SARS-CoV-2核酸的个案,但是SARS-CoV-2是否可以通过母婴垂直传播存在争议需要更多证据[107, 108, 109, 110, 111]。有研究从血清样本检测到低水平SARS-CoV-2核酸阳性,但其传染性尚未明确[112]。有小样本研究从部分COVID-19患者的精液中检测到SARS-CoV-2核酸阳性,但暂时没有从阴道分泌物中检测到病毒的研究证据,SARS-CoV-2是否可以通过性传播需要进一步研究明确[113, 114, 115]。
(冯录召、杨维中)
重点:
1.所有年龄段的人群对SARS-CoV-2均易感。
2.患者和无症状感染者的密切接触者均有较高的风险感染SARS-CoV-2。
3.老年人、男性、妊娠期女性、吸烟者、肥胖者、患基础疾病者为重症高危人群。
全球人群均缺乏对SARS-CoV-2的免疫力,所有年龄段的人群均易感[116]。患者和无症状感染者的密切接触者有较高风险感染SARS-CoV-2;医疗、社会和教育等领域的工作者均有SARS-CoV-2暴露风险,其中医疗工作者的风险最高[117]。
COVID-19患者的病死率与年龄相关,高龄患者的病死率更高[118, 119, 120, 121, 122]。患基础疾病的人群发生重症COVID-19的风险及病死率更高,常见基础病包括:高血压、糖尿病(或入院高血糖水平)、哮喘、慢性阻塞性肺疾病、间质性肺病、心力衰竭、冠状动脉疾病、心肌病、肺动脉高压、慢性肝病、慢性肾病、恶性肿瘤、免疫缺陷等[73,122, 123, 124, 125]。男性、妊娠期女性、吸烟者和肥胖人群也有更高的重症和死亡风险[126, 127, 128, 129, 130, 131, 132, 133]。服用肾素-血管紧张素系统抑制剂并不会显著改变罹患COVID-19的风险、病情严重程度和病死率[134]。应在病情发展过程中持续监测实验室参数[135]。白细胞计数升高、淋巴细胞计数降低、中性粒细胞-淋巴细胞比值(neutrophil- to-lymphocyte ratio,NLR)升高、部分炎症标记物升高[如白细胞介素(IL)-6、C-反应蛋白(CRP)、铁蛋白]、D-二聚体水平升高与重症COVID-19相关[135, 136, 137, 138, 139, 140, 141, 142]。此外,急性肾损伤(AKI)、凝血功能障碍和血栓栓塞的患者不良预后的风险更高[73,124,143]。重症COVID-19患者常见的凝血功能障碍表现包括D-二聚体水平升高,血小板计数降低,凝血酶原时间(prothrombin time,PT)延长,纤维蛋白原、凝血因子Ⅷ和血管性血友病因子水平升高[144, 145, 146, 147, 148]。
(程真顺、陈荣昌)
重点:
1.COVID-19患者康复后可能再感染。
2.复查核酸阳性与样本采集和处理、病毒载量、检测试剂的敏感度和特异度等因素有关,复查核酸阳性者具有传染性的证据不足。
COVID-19患者康复后可能再次感染SARS-CoV-2,中国香港、美国、荷兰、比利时、厄瓜多尔等多地均报告了再感染病例[149, 150, 151, 152, 153]。再感染患者的病情严重程度不一致,可能为无症状感染,也可能出现更严重的临床表现[149, 150, 151,154, 155]。
复查核酸阳性指COVID-19患者达到连续两次呼吸道标本核酸检测阴性(采样时间至少间隔24 h)的出院标准后[156],非再感染情况下核酸检测再次呈阳性。复查核酸阳性可能与样本采集和处理、病毒载量、检测试剂的敏感度和特异度等因素有关。复查核酸阳性现象在全球多地均有报道,比例从2.4%~69.2%不等,多数发生于出院后1~38 d,一般不超过90 d[157, 158, 159, 160, 161]。复查核酸阳性者具有传染性的证据不足[162]。
(冯录召、杨维中、陈荣昌)
1.COVID-19已在全球造成了大量发病和死亡。
2.COVID-19占用医疗资源较多,直接或间接经济影响巨大。
人群对SARS-CoV-2普遍易感。截至2020年12月29日,全球已有超过8 015万例COVID-19确诊病例,及超过172万死亡病例[163]。然而约40%~45%的SARS-CoV-2感染者可能不会出现临床症状[76]。据估计,2020年1月27日至9月30日,美国大约每8例SARS-CoV-2感染者中仅有1例被官方报告[164],提示实际感染者的人数可能远多于报告病例数。
一项研究利用公开的多种来源数据,包括被动监测报告和主动筛查的COVID-19的发病、死亡例数等,系统校正了实验室检测方法的敏感度、前瞻性社区筛查及就医行为后,定量测量出2019年12月至2020年3月间,武汉市COVID-19的发病率为796/10万(95%CI:703/10万~977/10万),就诊率为489/10万(95%CI:472/10万~509/10万),住院率为370/10万(95%CI:358/10万~384/10万),死亡率为36.2/10万(95%CI:35.0/10万~37.3/10万),其住院率超过2009年甲型H1N1流感的3.1倍,是季节性流感的1.8~2.6倍[165]。
早期研究显示,COVID-19患者中81%为轻型或普通型,14%为重型,5%为危重型[122];冰岛2020年3—4月份的数据显示,67%的SARS- CoV-2感染者在整个病程症状较轻[166]。疫情初期武汉COVID-19患者住院率约为370/10万,26%~32%的住院患者需要入住重症监护病房(intensive care unit,ICU)[122];而4月底之前美国加州与华盛顿州COVID-19住院患者中男性ICU住院率为48.5%,女性为32.0%[167]。一项关于全球COVID-19患者的系统评价显示,在入住ICU的患者中,67.7%需要有创机械通气,65.9%需要血管加压药物,16.9%需要肾脏替代治疗,6.4%需要体外膜式氧合(extracorporeal membrane oxygenation,ECMO)[168]。
各国COVID-19患者的病死率(case-fatality rate,CFR)介于0.05%~6.10%之间[122,169, 170],住院患者的CFR介于1.4%~18.9%之间[171],感染死亡比(infection fatality rate,IFR)在0.09%~1.60%之间[172, 173]。各国病死率与医疗资源承载情况和老龄化程度有关。COVID-19所致超额死亡率在男性中略高于女性,60岁以下人群显著低于60岁以上老年人[174]。
1.大体检查见,双肺不同程度的实变,可见充血、色暗红,重量增加。
2.光镜观察见,肺组织病变主要包括弥漫性肺泡损伤、肺泡渗出性炎、间质炎和肉质变及纤维化,可见肺内微血栓形成、灶性出血。
3.电镜观察见,肺泡上皮细胞和肺泡壁毛细血管内皮细胞损伤,气管、支气管黏膜上皮和肺泡Ⅱ型上皮细胞胞质内可见冠状病毒样颗粒。
4.支气管上皮、肺泡上皮细胞和肺泡腔巨噬细胞免疫组化染色可检测到SARS-CoV-2 S蛋白和N蛋白。肺组织标本PCR可检测到SARS-CoV-2核酸。
COVID-19病理变化具有多系统、多器官、多种组织受损的特点,肺脏最显著[177]。大体检查可见,双肺不同程度的实变,可见充血、色暗红,重量增加[178]。各肺叶病变程度有差异,部分病例可见片状出血或出血性梗死。可见胸膜粘连和胸腔积液[179]。
光镜观察见,肺脏不同区域病变复杂多样;同一区域病变新旧交错。多样性的肺组织病变主要包括弥漫性肺泡损伤、肺泡渗出性炎、间质炎、肉质变和纤维化,可见灶性和片状出血[177]。肺泡结构不同程度的破坏,Ⅰ型和Ⅱ型肺泡上皮细胞坏死、脱落;同时可见Ⅱ型肺泡上皮细胞增生,胞体立方状或低柱状、核大,部分细胞脱落于肺泡腔,可见多核细胞[180, 181, 182]。偶见增生的Ⅱ型肺泡上皮内可见红染圆形或卵圆形的病毒包涵体[179]。肺泡腔内见浆液和纤维蛋白性渗出物及透明膜形成,部分肺泡腔内见大量单核和巨噬细胞,少量淋巴细胞和中性粒细胞,偶见嗜酸性粒细胞;淋巴细胞多为CD4+ T细胞,可见少量CD8+ T细胞和CD20+ B细胞[183]。肺泡隔毛细血管扩张、充血,可见单核和淋巴细胞等炎细胞浸润,易见微血管内透明血栓[183, 184, 185]。肺脏内较大血管亦可见到血栓,以混合血栓为主,有的病例可出现肺动脉血栓栓塞。肺泡隔血管形态异常,血管扭曲,可见血管生成现象[178, 179, 180, 181, 182, 183, 184, 185, 186]。肺组织出血可呈肺泡腔漏出性出血、间质灶性出血或大片肺组织出血,部分病例可出现肺出血性梗死。少数肺泡过度充气、肺泡隔断裂,或气肿囊腔(大泡)形成。病程较长的病例,可见肺泡腔渗出物机化(肉质变)和肺间质纤维化,甚至出现整个肺段、肺叶广泛纤维化。纤维化肺组织内可见残留肺泡上皮细胞。有慢性支气管炎和支气管扩张症的病例,支气管上皮增生显著,支气管腔内见坏死脱落的上皮细胞和渗出的炎细胞以及黏液。上述病变中,弥漫性肺泡上皮损伤、炎性渗出物、间质炎和微血栓形成可引起气体交换功能障碍;气道黏膜上皮增生与脱落、黏液分泌增加与炎性渗出物阻塞导致通气受阻(主要是小气道)。这些改变是呼吸功能衰竭的重要病理基础[177, 179, 183]。
部分病例有慢性支气管炎、支气管扩张、肺间质纤维化、肺动脉硬化等基础病变。支气管黏膜充血、炎细胞浸润,黏液腺增生,管腔内有较多分泌物和渗出物。支气管和细支气管黏膜上皮显著增生,可呈乳头状;鳞状上皮化生易见,甚至在肺泡管亦可见柱状上皮增生和鳞状上皮化生现象。少数管腔内见炎性坏死物和黏液,并可见黏液栓[178, 179]。
电镜观察发现,Ⅱ型肺泡上皮细胞核大、胞质丰富,线粒体肿胀;有较多的板层体、粗面内质网、滑面内质网和高尔基氏器[178, 183]。肺泡壁毛细血管内皮细胞破裂,管腔内可见纤维素形成的血栓[178]。气管、支气管黏膜上皮和肺泡Ⅱ型上皮细胞胞质内可见冠状病毒样颗粒(直径60~140 nm),常成簇聚集在双层膜包绕的结构内。结合免疫电镜,可分辨出病毒N蛋白呈高密度小颗粒;有时可见病毒“花冠”[187]。支气管上皮、肺泡上皮细胞及肺泡腔巨噬细胞免疫组化染色可检测到SARS-CoV-2 S蛋白和N蛋白。肺组织标本聚合酶链式反应(polymerase chain reaction,PCR)可检测到SARS-CoV-2 核酸[183]。
1.脾脏体积缩小,包膜皱缩,切面见淤血、出血。白髓区萎缩,淋巴细胞数量减少;红髓区巨噬细胞可增生,偶见吞噬红细胞和(或)淋巴细胞现象。
2.淋巴结生发中心不明显,边缘窦内巨噬细胞聚集。
3.骨髓三系细胞数量减少,部分病例显增生像。
大体检查见,脾脏体积不同程度缩小,重量减轻,脾表面包膜皱缩。切面暗褐色、质地中等,部分病例淤血明显。部分患者脾脏可见局灶梗死[179, 183, 188]。
光镜观察见,脾脏白髓区萎缩,淋巴滤泡减少或缺如,淋巴细胞总数减少,细胞变性、坏死或凋亡;动脉周围淋巴鞘变小、结构紊乱。红髓区淤血、出血,脾脏巨噬细胞可增生,可见吞噬红细胞和(或)淋巴细胞现象以及含铁血黄素沉积。脾窦纤维组织增生。脾脏血管内可见混合血栓或透明血栓。部分病例表现为急性脾炎,可见较多中性粒细胞浸润;易见大小不一的贫血性梗死灶。免疫组化检测显示,T细胞明显减少,CD4+和CD8+ T细胞稀少。
1.全身多部位多器官见血管炎,可见血管内混合血栓形成、血栓栓塞及相应器官组织梗死。少数病例心肌组织PCR检测可呈SARS-CoV-2核酸阳性。
2.食管、胃和肠黏膜见炎性反应,黏膜上皮细胞可见变性、坏死、脱落;肝脏可见肝细胞变性、灶性坏死,部分病例见广泛的小叶中心性肝坏死。
3.肾脏主要表现为肾小球充血、微血栓形成,可见纤维素样坏死和炎细胞浸润及球囊腔渗出物;肾小管上皮变性,可见坏死、脱落及管型形成;间质血管充血。可见肾脏基础病病变,包括动脉硬化、肾小球硬化、间质纤维化和慢性炎等。睾丸生精细胞数目不同程度地减少,Sertoli细胞和Leydig细胞变性。
血管病变是COVID-19的突出特点之一。全身主要脏器可见血管内皮细胞脱落、内膜或全层炎症;浸润的炎细胞以淋巴细胞和单核细胞为主[178]。可见血管内混合血栓形成、血栓栓塞及相应部位的梗死。微血管可见透明血栓形成。部分脏器内可见局灶出血[186]。
心脏病理改变多表现为非特异性改变,主要表现为心肌细胞变性、灶性坏死,间质轻度充血、水肿,少量淋巴细胞、单核细胞和中性粒细胞浸润[178, 189, 191, 192, 193]。电镜下见部分心肌纤维肿胀、溶解[183]。此外可见与基础疾病相关的心脏改变,包括冠状动脉及其分支粥样硬化、心肌肥大和陈旧性心肌梗死及纤维化。
少数病例心脏组织PCR检测可呈SARS-CoV-2核酸阳性。
食管、胃和肠黏膜见炎性反应,黏膜上皮细胞可见变性、坏死、脱落[194, 195, 196]。黏膜下血管充血、水肿,不同程度的炎性细胞浸润,炎细胞以单核细胞和淋巴细胞为主。部分区域胃、肠黏膜出血。
大体检查见,肝脏体积增大,包膜紧张,颜色暗红。光镜观察见,肝脏可见肝细胞变性、灶性坏死,部分病例见广泛的小叶中心性肝坏死[189, 192, 197]。部分肝细胞可见胆色素沉积,小胆管内可见胆栓。肝血窦充血,可见Kupffer细胞增生。汇管区见淋巴细胞和单核细胞为主的炎细胞浸润。胆囊高度充盈,黏膜上皮脱落,显示慢性炎[177]。
胰腺外分泌部腺上皮细胞未见明显异常,少数胰岛细胞变性[177, 183]。
少数病例唾液腺、胃肠、肝脏和胆囊组织可检测到SARS-CoV-2核酸[177]。
大体检查见,肾脏增大或缩小,硬度不一。肾皮质可变薄。镜下检查见,肾小球充血、微血栓形成,可见纤维素样坏死和炎细胞浸润及球囊腔渗出物;肾小管上皮变性,可见坏死、脱落及管型形成;间质血管充血。可见肾脏基础病病变,包括动脉硬化、肾小球硬化(弥漫性或者节段性硬化)、新月体形成,间质见纤维化和慢性炎等[179, 198, 199, 200, 201, 202]。
SARS-CoV-2感染的主要靶细胞是呼吸道杯状细胞、纤毛上皮细胞、Ⅱ型肺泡上皮细胞、肠上皮细胞、血管内皮细胞和嗅觉神经元。此外病毒也有可能感染肾小管上皮细胞、足细胞、单核巨噬细胞和树突状细胞等。
SARS-CoV-2感染同时表达ACE2和TMPRSS2的细胞。主要的靶细胞有呼吸道杯状细胞、纤毛上皮细胞、Ⅱ型肺泡上皮细胞、肠上皮细胞、血管内皮细胞和嗅觉神经元,而肾小管上皮细胞、足细胞、单核巨噬细胞和树突状细胞也可能被病毒感染[212, 213, 214, 215]。尚无直接证据表明病毒可感染T细胞、B细胞或NK细胞。作为致细胞病变病毒,SARS-CoV-2直接引起感染细胞坏死、凋亡或其他形式的破坏及死亡[216]。
SARS-CoV-2感染的主要靶器官是上下呼吸道、肺、肠道、血管系统和肾脏。病毒也有可能感染二级淋巴器官如脾脏和淋巴结[217, 218]。
1.T细胞免疫应答发挥关键保护作用。病毒特异的细胞毒性T细胞(CTL)可提供免疫保护。
2.中和抗体发挥重要保护作用。血清中IgM最早出现而后逐渐消失,IgG随后出现但较长时间维持高水平。
3.部分健康者及COVID-19患者体内有针对其他冠状病毒的交叉反应性中和抗体和T细胞。
4.早期Ⅰ型干扰素(IFN-Ⅰ)发挥病毒控制作用,而延迟型IFN-Ⅰ可能诱导免疫损伤。
免疫应答对机体的保护作用主要由细胞毒性T细胞(cytotoxic T lymphocyte,CTL)、中和抗体及Ⅰ型干扰素(type Ⅰ interferon,IFN-Ⅰ)组成。
T细胞免疫应答发挥关键保护作用。CD3+ Granzyme B+perforin+CTL在感染症状出现的第2天检出,约1~2周达到峰值,并维持3个月以上(图1)[219]。重症患者有更强的CTL应答[220, 221]、更高比例的CD45RA-CCR7-效应记忆T细胞(effector memory T cells,Tem)和Th2细胞[222]。多数康复者有记忆性T细胞,可提供免疫保护[223]。
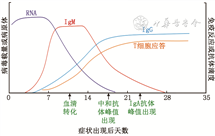

患者血液中有CXCR5+ICOS+PD-1+滤泡辅助性T细胞(follicular helper T cells,Tfh),可辅助中和抗体产生及类别转换[224]。中和抗体可封闭病毒S蛋白与ACE2受体的结合而阻止SARS-CoV-2入侵,发挥重要保护作用[225]。抗体最早在症状出现的第2天检出,第25~30天到达峰值。IgM滴度随后逐渐下降,IgG滴度可维持高水平,持续超过6个月(图1)[226, 227]。疾病的严重程度不影响IgG滴度到达峰值时间,但轻症患者IgM滴度比重症患者提前约7 d到达峰值[226]。多数康复者依然有病毒特异性的中和抗体,可能有保护作用[228, 229]。
部分健康者及康复者体内可检测到针对其他冠状病毒(如SARS-CoV、HCoV-OC43、 HCoV-229E、HCoV-NL63及HCoV-HKU1)的交叉反应性中和抗体和T细胞[230, 231]。该交叉中和抗体可阻断SARS-CoV-2入侵细胞,可能有保护作用[230]。约20%人群有交叉反应记忆CD8+ T细胞[232],约40%~60%人群存在交叉反应记忆CD4+ T细胞[233, 234],这些T细胞是否有免疫保护作用尚不明确[235]。
SARS-CoV-2感染可刺激机体快速产生IFN-Ⅰ,其可促进干扰素激活相关基因(IFN-stimulated genes,ISG)表达而发挥抗病毒作用[236]。轻症患者IFN-Ⅰ水平早期升高后期下降,发挥重要的病毒控制作用。但重症患者IFN-Ⅰ分泌延迟并伴随ISG显著升高,可能导致免疫损伤[237],提示IFN-Ⅰ的临床治疗与给药的时间点密切相关。
重点:
1.部分COVID-19重症患者出现病毒性感染中毒症(viral sepsis)。
2.SARS-CoV-2感染可导致淋巴细胞减少甚至急性T细胞耗竭。
3.部分COVID-19患者出现过度炎症反应及血管病变。
除对靶细胞的直接致病作用之外,SARS-CoV-2感染也可诱发免疫损伤。COVID-19 重症患者出现急性T细胞耗竭[238]及淋巴细胞减少症[239],可能与胸腺细胞输出减少、脾脏萎缩及大量促炎因子诱发细胞凋亡有关[240, 241]。同时,重症患者Th17细胞和致病性CD8+ T细胞比例升高,可能加重免疫损伤[181,242]。此外,老年患者多为低亲和力的CTL应答,其抗病毒能力不足[235, 236, 237, 238, 239, 240, 241, 242, 243]。
部分COVID-19患者可发生病毒性感染中毒症(viral sepsis)[244]。此外,COVID-19重症患者血清和支气管肺泡灌洗液中多种炎症因子(IL-1β、IL-2、IL-6、TNF-α及VEGF等)较轻症患者及健康者显著升高[239,245, 246, 247, 248, 249, 250],可能加剧病理损伤并导致毛细血管渗漏综合症(capillary leak syndrome)[251],表现为毛细血管通透性增加、低血压、水肿和急性呼吸衰竭等。
SARS-CoV-2也可破坏肺毛细血管内皮细胞引起内皮细胞炎[186,252],包括血管通透性增加,大量的血浆成分、单核细胞和中性粒细胞汇入,出现肺水肿、透明膜形成或全身小血管内透明血栓形成[183];重症COVID-19患者血D-二聚体水平常明显升高[253]。部分重症患者可合并深静脉血栓及肺栓塞事件[196]。
(曹彬、吴玉章)
1.COVID-19患者常见的呼吸系统症状包括咳嗽、发热、气促、咽痛等。
2.COVID-19的肺外表现包括疲劳/乏力、肌痛、腹泻、恶心、呕吐等,部分患者以嗅觉或味觉功能障碍、鼻漏、结膜炎等为首发临床表现。
COVID-19患者临床首发症状主要以呼吸道和全身症状为主,最常见的首发症状为咳嗽(干咳,50%~82%)、发热(43%~99%)和疲劳/乏力(38%~70%),其他临床表现包括肌痛(15%~36%)、头痛(6.5%~34%)、气促(19%~31%)、咽痛(5%~20%)、腹泻(2%~19%)、恶心和呕吐(1%~12%)等,部分患者以嗅觉或味觉功能障碍(8.3%~39.2%)、鼻漏(4%~6%)、结膜炎(0.8%~4.3%)等为首发临床表现[45,254, 255, 256, 257]。部分患者在感染后无明显临床症状[76]。此外,有部分研究报道COVID-19患者可出现皮肤黏膜损害、脱发和谵妄等少见临床表现,其中谵妄更易出现在80岁以上的老年患者和有基础认知障碍的患者中[254,258, 259]。
(张静、瞿介明)
1.淋巴细胞计数减少是COVID-19患者常见的实验室检查表现。
2.COVID-19患者其他常见的实验室异常表现包括CRP、铁蛋白、血沉升高,凝血功能异常,转氨酶、乳酸脱氢酶、肌酶和肌红蛋白升高等。
在疾病的早期阶段,COVID-19患者常表现为外周血白细胞总数正常或减少,50%~83%的患者出现淋巴细胞计数减少,淋巴细胞数进行性减少与不良预后相关[45,239,241,260]。大多数患者表现为炎症指标如CRP(60.7%~86%)、铁蛋白(63%~80%)和红细胞沉降率(85%~93%)升高,21%~52%的患者存在IL-6水平升高[45,73,239,250,261, 262]。重症患者炎症因子水平(主要包括IL-1β、IL-2、IL-6、TNF-α、VEGF等)较轻症患者升高更显著[239,245, 246, 247, 248, 249, 250]。凝血功能障碍在COVID-19患者中较为常见,常表现为血小板减少(5%~36%)、D-二聚体水平升高(36%~46%)、PT延长等(5%~58%)[45,73,239,250,261,263]。其中血小板减少和D-二聚体升高与重症和不良预后相关[264]。部分患者也可出现转氨酶(1%~53%)、乳酸脱氢酶(39%~76%)、肌酶升高(13%~14%)[45,250,260, 261,265]。部分患者出现肌酐、尿素氮水平升高[45,260, 261,266, 267]。
(张静、瞿介明)
COVID-19患者的并发症主要包括ARDS、感染中毒症、AKI、急性心肌损伤、凝血功能异常等,甚至出现多器官功能衰竭。
ARDS常发生于3%~17%的COVID-19患者中,在需住院和入住ICU的COVID-19患者中,发生率上升至20%~42%和67%~85%[260, 261,268]。高龄是COVID-19患者出现ARDS的主要危险因素之一,其他危险因素还包括合并基础疾病、淋巴细胞计数降低、凝血功能障碍、铁蛋白升高等[260,269, 270, 271]。
COVID-19重症、危重症患者可出现感染中毒症(sepsis)表现,且大部分患者未明确合并细菌感染[244,272]。感染中毒症的出现可能进一步导致COVID-19患者多器官衰竭[254]。
AKI在COVID-19患者的发生率约为10.7%~21%,约3.1%~5.5%的患者需要肾脏替代治疗,重症患者中AKI的发生率更高,约为42.7%~63.3%[273, 274]。高龄、合并基础疾病(心血管疾病、高血压、糖尿病等)等因素是AKI的危险因素[273,275]。高钾血症和酸中毒是常见的电解质和酸碱平衡紊乱类型,可出现血尿和蛋白尿[276]。
合并高血压和冠心病的老年男性更可能出现心肌损伤[277]。据报道,约有20%~30%的住院COVID-19患者出现肌钙蛋白Ⅰ(Troponin Ⅰ,TnⅠ)水平超过参考值范围上限的99百分位,且出现的频率越高、升高的幅度越大,和疾病严重度更高、预后更差相关[278, 279]。7%~33%的危重症患者中表现有双侧心肌病[119,280]。有一项研究表明14%的危重症患者中出现了心脏骤停[281]。在年老和存在合并症的患者中,心律失常如房颤、心脏传导阻滞和室性心律失常、QTc间期延长(>500 ms)也较为常见[261,282]。
COVID-19患者常表现为高凝的状态,需警惕静脉血栓栓塞症(venous thromboembolism,VTE)的出现。一项纳入48项研究的荟萃分析发现,COVID-19患者中VTE的发生率为17.0%(95%CI:13.4%~20.9%),ICU患者的VTE发生率可达27.9%(95%CI:22.1%~34.1%)[283]。D-二聚体、纤维蛋白原等指标以及Wells评分、Padua评分、Caprini评分等工具对早期预测血栓事件可能有提示作用[283, 284, 285, 286, 287, 288]。
(张静、程真顺、瞿介明)
1.胸片在早期和轻症患者中可无异常,最常见表现为磨玻璃影和实变,极少数有自发性气胸。
2.胸部CT上常表现为磨玻璃影、血管束增粗、实变影、小叶间隔增厚/网格影、混合磨玻璃影等。
处于SARS-CoV-2感染早期阶段,或轻症的COVID-19患者的胸片可能无异常发现,20%~85%的COVID-19患者胸片始终无异常发现[73,289, 290]。在胸片异常的患者中,67.6%~81.1%的患者表现为双侧肺部累及[291],其中磨玻璃影是最常见的胸片异常发现(66.1%~100.0%),多分布在两侧外周(55.7%~90.0%),以下肺为主(22.1%~39.1%);随着病情的进展,胸片上实变影逐渐增多(30.0%~53.4%)[290,292, 293]。自发性气胸的发生率很低,约为0.56%~1%[250,294, 295]。
一项纳入28篇研究的荟萃分析提示,总体上约10.6%(95%CI:7.6%~13.7%)的COVID-19患者胸部CT无任何影像学异常[296]。CT异常表现以双肺(75.8%,95%CI:70.5%~81.1%)、外周(59.0%,95%CI:48.1%~70.0%)分布为主[296]。最常见的有磨玻璃影(81.0%,95%CI:76.6%~85.4%)、血管束增粗(72.9%,95%CI:64.4%~81.4%)、实变影(51.5%,95%CI:43.1%~59.9%)、小叶间隔增厚/网格影(49.6%,95%CI:39.3%~59.9%)、混合磨玻璃影(48.7%,95%CI:41.7%~55.7%)、条索影(40.7%,95%CI:28.1%~53.3%),其他的影像学表现还有支气管充气征(40.2%,95%CI:30.0%~50.4%)、铺路石样改变(34.9%,95%CI:23.4%~46.5%)、胸膜增厚(34.7%,95%CI:14.4%~55.0%)、支气管扩张(24.2%,95%CI:12.2%~36.1%)、支气管壁增厚(14.3%,95%CI:5.5%~23.2%),较少见的表现有胸腔积液(5.2%,95%CI:3.8%~6.7%)、淋巴结增大(5.1%,95%CI:3.2%~6.9%)、树芽征(4.1%,95%CI:1.5%~6.7%)、心包积液(1.6%,95%CI:0.1%~3.1%)、含气囊腔(0.7%,95%CI:0.1%~1.3%)[296]。另几项荟萃分析也得到了相似的结果[297, 298]。淋巴结增大、胸腔积液、支气管壁增粗等影像学表现在重症和危重症患者或进展期患者中出现的比例显著高于轻症或早期的患者[299, 300, 301, 302, 303]。
(张静、瞿介明)
1.部分COVID-19患者出院3~6个月仍有持续症状,其中疲劳/乏力最多见,一般不影响患者的日常活动。
2.COVID-19相比其他呼吸道感染性疾病出现焦虑、抑郁等精神健康问题的风险可能增加。
部分COVID-19患者出院3~6个月仍有持续症状,目前不同研究报道的症状谱和频率有较大差异,疲劳/乏力(28.3%~63.0%)是被报道最多的症状,其他症状包括脱发、睡眠障碍、胸痛、咳嗽、关节疼痛、呼吸困难等,随访期的症状可能和住院时的病情严重程度相关[304, 305, 306]。这些症状一般不影响患者的日常活动[306]。因为症状描述较为主观,不同研究报道的症状谱差异可能和研究者的研究方式、问卷设计、不同研究间患者的异质性、患者的回忆偏倚等因素相关。
肺损伤是COVID-19患者主要的器官损害,出院的COVID-19患者肺损伤逐渐好转,但部分患者在半年内可能仍遗留少量胸部影像学异常(常见磨玻璃影和不规则条索影)和肺弥散功能异常,这些异常一般不影响患者日常活动[306, 307, 308]。
由于COVID-19对健康的影响、广泛的社会影响以及污名化等问题,COVID-19患者可能更容易出现焦虑、抑郁等精神、心理问题[309]。一项纳入62 354例COVID-19患者的回顾性研究发现确诊COVID-19后的3个月内,相比对照组的流感、其他呼吸道感染等疾病患者,精神疾病诊断率增加约1倍[309]。5.8%的患者首次诊断精神疾病,4.7%的患者首次诊断焦虑障碍,2%的患者首次诊断情绪障碍[309]。在一项发病后6个月的随访研究中,有超过20%的患者报告有焦虑、抑郁等情况[306]。COVID-19患者出院后的精神健康情况不容忽视。
COVID-19长期预后研究有助于了解COVID-19生理、精神、社会方面的结局,并针对特定群体早期干预,提升患者的医疗照护水平和生活质量[310]。目前COVID-19患者的出院时间最长约为1年左右,需继续随访以明确COVID-19的远期预后。
(曹彬)
推荐使用2020年《新型冠状病毒肺炎诊疗方案(试行第八版)》的诊断标准和临床分型标准进行诊断和临床分型。
指南专家委员会推荐使用2020年《新型冠状病毒肺炎诊疗方案(试行第八版)》的诊断标准和临床分型标准[156]。《新型冠状病毒肺炎诊疗方案(试行第八版)》的诊断标准将诊断分为疑诊病例和确诊病例。疑诊通过流行病学史及临床表现综合分析;确诊通过病原学检测等证据明确。值得注意的是,诊疗方案历经八版,每次更新皆是基于对疾病认识的加深、临床实践的反馈和检测方法的创新和优化。其中,第五版诊疗方案在湖北地区出台了临床诊断标准,有助于疫情得到有力控制[311]。
1. COVID-19的临床表现并不特异,主要与其他呼吸道病毒感染,以及支原体肺炎、衣原体肺炎、细菌性肺炎等相鉴别。
2. COVID-19还需要与影像学及临床表现类似的非感染性疾病相鉴别。
COVID-19轻型病例可表现为低热、轻微乏力、嗅觉及味觉障碍等,无肺炎表现,需要与其他病毒引起的上呼吸道感染或其他引起流感样表现的病原体感染相鉴别[312]。
有肺部影像学表现的COVID-19主要与其他病毒性肺炎相鉴别:比如流感病毒、副流感病毒、腺病毒、呼吸道合胞病毒、鼻病毒、人偏肺病毒等引起的肺炎[313, 314];还应与支原体肺炎、衣原体肺炎、细菌性肺炎、肺真菌病、肺结核等相鉴别[313,315, 316]。流行病学史是重要的鉴别要点,采用快速抗原检测和多重PCR核酸检测等方法有助于常见呼吸道病原体的快速诊断。值得注意的是,SARS-CoV-2核酸检测阳性不能排除其他病原体的合并感染,反之亦然。
在一些免疫抑制状态的特殊人群,比如疑诊COVID-19的艾滋病患者中,临床医生需要进行更广泛的鉴别诊断,机会性感染(肺孢子菌肺炎等)、多重感染等应纳入考虑范围[317, 318]。此外,COVID-19还应与肺部影像学表现相仿的非感染性疾病相鉴别,如肺水肿、肺泡出血、机化性肺炎、嗜酸性粒细胞性肺炎等[316,319, 320]。
COVID-19患者的首发症状可以表现为肌肉疼痛、乏力,还可以出现关节痛、冻疮样皮疹等临床表现。有研究报道部分COVID-19患者可出现自身抗体阳性[145,321, 322]。因此,COVID-19需要与血管炎、皮肌炎、干燥综合征等自身免疫性疾病相鉴别[323]。
部分COVID-19患者可以出现不同程度的皮肤黏膜损害,且与疾病严重程度有关[45,259,324]。对于皮肤黏膜损害,需要与冻疮、系统性红斑狼疮、药物性皮疹、病毒性皮疹相鉴别。目前,尚未在COVID-19患者的尸检中报道特异性的皮肤病理表现。
COVID-19患者可以出现包括腹泻、腹痛、恶心呕吐、肝损伤等在内的消化系统表现[325]。有些患者的消化系统症状可先于呼吸系统症状出现,甚至仅表现为消化系统症状[326]。对于此类患者,流行病学史、既往的胃肠道疾病及肝脏疾病史、肝脏彩超等实验室检查有助于鉴别诊断。
(赵建平)
推荐意见
1.有急性呼吸道感染症状疑似SARS-CoV-2感染者,无呼吸道症状疑似SARS-CoV-2感染者,肺炎聚集性病例,SARS-CoV-2感染确诊病例密切接触者,其他需要排除SARS-CoV-2感染或鉴别诊断病例,推荐用核酸检测方法进行病原学诊断。(2a,B)
2.疑似早期病毒暴露的病例,在核酸检测不可及的情况下,推荐使用抗原检测方法进行病原学诊断。(2a,B)
3.不推荐使用抗体检测方法独立确诊或排除SARS-CoV-2感染。(4,C)
4.临床高度怀疑其为SARS-CoV-2感染,但核酸和抗原检测阴性者,推荐检测抗病毒特异性IgM,或使用急性期和恢复期双份血检测病毒特异性IgG抗体阳转和滴度增加情况以辅助诊断。(4,C)
推荐意见说明
1.核酸检测是首选的病原学诊断方法,病毒核酸检测阳性可确诊SARS-CoV-2感染。
2.检测病毒核酸和抗原首选的样本是呼吸道样本。症状出现7 d内、无症状或轻症病例,可采集上呼吸道样本进行核酸检测;急性重症和危重症呼吸道感染者,可采集痰液或气管抽吸液等下呼吸道样本进行核酸检测。
3.在核酸检测不可及的情况下,疑似SARS-CoV-2感染病例,在症状出现或疑似病毒暴露早期可使用抗原检测进行病原学诊断;检测到病毒特异性IgM抗体阳性,或者检测到急性期和恢复期双份血中IgG抗体效价呈四倍增高可辅助诊断SARS-CoV-2感染。
4.核酸检测主要采用实时逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)方法,检测结果会受到病程、样本采集、样本前处理、检测过程、病毒突变等多种因素的影响。为提高检测阳性率,必须规范采集标本。可采集呼吸道不同部位样本,或间隔1 d以上多次采集样本提高检出率。样本采集后尽快送检。阴性结果不能完全排除病毒感染,需要排除可能产生假阴性的因素。
5.检测IgM抗体有助于判断是否为病毒暴露急性期,但因人体内存在类风湿因子、嗜异性抗体、补体、溶菌酶等可能与检测体系产生非特异性反应,或者溶血、细菌污染、存储不当等可导致假阳性结果。需结合流行病学史、疫苗接种史、临床表现和影像学检查等综合评判。
6. IgG抗体及其效价的检测需要使用急性期和恢复期双份血清或血浆。
推荐依据
SARS-CoV-2感染的病原学诊断包括检测病毒(病毒核酸或抗原),检测人体对病毒感染后的免疫反应(抗体或其他生物标志物)。检测到病毒核酸、病毒抗原是确定病毒感染最有力的证据。用RT-PCR方法检测病毒核酸为常用方法。一项纳入51项研究的荟萃分析显示,RT-PCR检测SARS-CoV-2的敏感度为89.1%(95%CI:84.0%~92.7%),特异度为98.9%(95%CI:98.0%~99.4%)[327]。抗原检测平均敏感度为56.2%(95%CI:29.5%~79.8%),特异度为99.5%(95%CI:98.1%~99.9%)[328]。抗体检测的敏感度为78%(95%CI:70%~85%),特异度为97%(95%CI:93%~99%);IgG抗体检测的敏感度为76%(95%CI:65%~86%),特异度为98%(95%CI:96%~99%);IgM抗体检测的敏感度为69%(95%CI:59%~78%),特异度为95%(95%CI:91%~98%)[329]。抗体检测的敏感度受时间影响较大,发病7 d内为25%~36%、8~14 d为62%~80%、14 d以上为85%~93%[329]。根据上述核酸、抗原和抗体检测方法敏感度和特异度差异,核酸检测仍为SARS-CoV-2感染早期快速筛检的首选方法。
疾病的不同时期,病毒核酸阳性检出率在不同类型的呼吸道样本中存在差异。与上呼吸道标本相比,下呼吸道标本(如支气管肺泡灌洗液和气管内抽吸物)中SARS-CoV-2的检出率和病毒载量更高[330]。在症状出现后第0~7天,鼻咽拭子、口咽拭子和痰液的阳性检出率分别为80%(95%CI:66%~91%)、75%(95%CI:60%~88%)和98%(95%CI:89%~100%);在8~14 d之间,鼻咽拭子、口咽拭子和痰液的阳性检出率分别为59%(95%CI:53%~64%)、35%(95%CI:27%~43%)和69%(95%CI:57%~80%);14 d后,鼻咽拭子、口咽拭子和痰液的阳性检出率分别为36%(95%CI:18%~57%)、12%(95%CI:2%~25%)和46%(95%CI:23%~70%)[331]。上呼吸道样本中,鼻咽拭子中病毒核酸阳性检出率高于口咽拭子[62,330, 331]。因此,感染早期、无症状或轻症病例,采集上呼吸道样本时首选鼻咽拭子。病程后期、呼吸道感染重症和危重症病例,上呼吸道样本检测阴性但临床上高度疑似SARS-CoV-2感染,推荐采集痰液和气管抽吸液等下呼吸道样本进行核酸检测[330,332]。从症状出现后的第2周起,如果上呼吸道和下呼吸道样本检测呈阴性,但临床仍疑似有SARS-CoV-2感染,可考虑增加粪便或肛拭子等肠道样本的核酸检测[330,333, 334]。
核酸检测结果判读应综合考虑样本采集时间、样本类型、检测细节、临床表征和流行病学特征。阴性检测结果不能完全排除SARS-CoV-2感染,需排除可能产生假阴性的因素。样本采集时间过早或过晚、呼吸道样本采集部位不同会导致结果的差异,甚至出现假阴性结果[50,62]。因此,单次单个呼吸道样本检测阴性,但临床疑似有病毒感染时,建议采集呼吸道不同部位样本混合检测,或增加检测频次,或使用两种不同厂家的核酸检测试剂盒进行复核检测[331,335]。需注意由于痰和粪便中存在抑制PCR的成分,不建议将这两种样本与上呼吸道样本进行混合检测[336]。重复检测一般在首次检测后24~48 h进行,如果患者有下呼吸道感染的症状/体征,应考虑用下呼吸道标本进行重复检测。对疑似感染SARS-CoV-2病例的呼吸道样本,建议同时进行其他常见呼吸道病原体的筛查,以降低因其他病原感染致病但未给予治疗而导致重症的风险。目前有报道SARS-CoV-2和其他病原体共同感染的情况,因此另一种病原体的核酸检测阳性不能排除SARS-CoV-2的感染,检出SARS-CoV-2核酸也不能排除合并其他病原体的共感染[337, 338]。
利用深度测序技术(包括二代测序与三代测序等)分析SARS-CoV-2感染病例样本可获得更多的病毒基因序列,有助于明确病毒的突变特征,发现新的突变株[28,339]。但因其成本高,技术复杂,需要生物信息分析技术的支持,不作为早期快速筛选SARS-CoV-2感染的常规方法。
疑似早期病毒暴露的病例,在核酸检测不可及的情况下,可使用抗原检测进行病原学诊断。与核酸扩增检测方法相比,检测的目标没有扩增,这使得抗原检测方法不如核酸检测方法敏感。但是在无法进行核酸检测或无法及时获得核酸检测结果时,抗原检测可以提供快速、廉价和早期发现SARS-CoV-2感染的可能性。
对于临床疑似SARS-CoV-2感染者,如果病毒特异性核酸和抗原检测阴性,推荐进行抗体检测。SARS-CoV-2感染人体后,首先出现IgM,随后出现IgG[340]。SARS-CoV-2特异性IgM检出中位时间是症状出现后5 d,IgG检出中位时间是症状出现后14 d[341]。IgG是存在于血清中的一种更稳定、更持久的抗体。与N蛋白相比,表面抗原(S蛋白)具有更强的免疫原性,能够诱导中和抗体的产生[342]。IgG和中和抗体可以持续至少6个月,但其抗体水平在感染后2~3个月开始下降[343]。检测IgM抗体有助于判断是否为病毒暴露急性期。在症状出现5 d后使用血清学方法检测IgM抗体联合核酸检测,可将早期诊断率从约50%提高到90%以上[341]。IgG抗体检测需要使用急性期和恢复期双份血。第一份血清应尽早釆集(最好在发病后7 d内),第二份血清应在发病后第2~4周釆集,用于评估血清抗体滴度的动态变化,有助于回溯性确定该个体是否曾被SARS-CoV-2感染。检测急性期和恢复期血样本,需要在同一天完成,最佳操作是在同批次试验中完成分析,有助于准确判定结果。SARS-CoV-2特异性IgG抗体由阴性转为阳性,或恢复期IgG抗体滴度较急性期呈4倍及以上升高可确诊SARS-CoV-2感染。用于检测SARS-CoV-2抗体的抗原成分可能与其他病原体抗体发生交叉反应,人体内存在类风湿因子、嗜异性抗体、补体、溶菌酶等可能与检测体系产生非特异性反应,溶血、细菌污染、存储不当等可导致假阳性结果。因此,抗体阳性检出结果需结合流行病学史、疫苗接种史、临床表现和影像学检查等综合判断[340,344]。病毒中和抗体是功能性抗体,是评估人体抗病毒能力的重要参考指标。已有使用假病毒进行中和抗体分析的试剂盒,有基于阻断S蛋白的RBD和ACE2之间的相互作用的中和抗体检测试剂盒上市,可用于辅助分析血清中和抗体水平。基于活病毒微量中和试验和空斑减少试验是分析中和抗体的经典病毒学方法,但该类方法对工作人员技能要求较高,需使用活病毒在生物安全Ⅲ级实验室进行操作,耗时较长,不适于进行常规大规模血SARS-CoV-2中和抗体分析。
(任丽丽、王健伟)
推荐意见
不推荐胸部CT和胸部X线作为确诊依据。(1a,A)
推荐意见说明
胸部CT和胸部X线对于COVID-19患者的诊断特异度低,不能作为COVID-19的确诊依据,可以用于辅助诊断和鉴别诊断。
推荐依据
一项纳入6 218例COVID-19患者的荟萃分析提示,以核酸检测结果为参考标准,胸部CT的敏感度和特异度分别为94%(95%CI:91%~96%)和37%(95%CI:26%~50%)[345]。在敏感性分析中,以重复RT-PCR为参考标准的胸部CT的综合敏感度为95%(95%CI:88%~96%),特异度为35%(95%CI:23%~48%)。发病率波动于1.0%~22.9%之间时,CT的阳性预测值波动于1.5%~30.7%,阴性预测值波动于95.4%~99.8%。一项纳入535例COVID-19患者的诊断准确性研究提示,胸部X线检查的敏感度和特异度分别为89.0%(95%CI:85.5%~91.8%)和60.6%(95%CI:51.6%~69.2%),阳性预测值为87.9%(95%CI:84.4%~90.9%),阴性预测值为63.1%(95%CI:53.9%~71.7%)[346]。
(张静、瞿介明)
1对疑似或确诊病例进行隔离。
2.给予合理的营养及对症支持治疗;合理氧疗。
3.对确诊患者进行疾病严重程度评估和病情监测。
4.注重COVID-19住院和重症患者的并发症预防。
5.建议中西医结合治疗。
建议对所有疑似病例立即进行单人、单间隔离。对确诊病例转运到当地定点医院集中隔离和治疗[156]。建议根据病情给予患者对症支持治疗,保证充分热量,维持水、电解质、酸碱平衡等内环境稳定;监测患者血常规、CRP、降钙素原、器官功能、凝血功能、动脉血气和胸部影像,根据患者氧合情况给予合理的氧疗措施,关注病情变化[156,347]。对于重型和危重型病例,需要密切监测患者是否出现病情恶化的迹象,并采用支持性干预措施[156,347]。此外,积极防治并发症,治疗基础疾病,预防继发感染,及时进行器官功能支持[156,347]。
中西医结合治疗是我国疫情防控的重要经验。COVID-19属于中医“疫”病,可以根据患者病情、体质,结合当地的气候特点等,在中医医师的指导下进行辨证施治,使用中成药、汤剂及其他中医治疗,具体治疗方案可参考《新型冠状病毒肺炎诊疗方案(试行第八版)》[156]。
(周敏)
推荐意见
不推荐瑞德西韦常规用于成人COVID-19患者的治疗,只有在临床试验条件下可考虑使用。(1a,A)
推荐意见说明
荟萃分析证据提示瑞德西韦在降低COVID-19患者病死率、机械通气风险等方面无显著临床获益。需要进一步研究明确瑞德西韦的临床疗效,最佳获益人群和使用时机。
推荐依据
瑞德西韦是一种腺苷类似物的静脉注射核苷酸前体药物,与病毒RNA依赖的RNA聚合酶结合,通过中止病毒RNA转录来抑制病毒复制。体外和体内研究均证实瑞德西韦具有抗SARS-CoV-2的活性[348, 349]。
第一项瑞德西韦治疗COVID-19的RCT结果提示,瑞德西韦未能缩短临床改善时间,降低病死率和加速病毒清除[350]。此外,还有一项开放标签RCT提示瑞德西韦5 d疗法和10 d疗法对于重症、不需要机械通气的COVID-19患者疗效差异无统计学意义[351]。美国国立卫生研究院发起的瑞德西韦治疗住院COVID-19患者的临床试验(ACTT-1)结果提示,相比安慰剂组,瑞德西韦组COVID-19患者中位临床改善时间缩短5 d(RR=1.29,95%CI:1.12~1.49),14 d病死率下降(HR=0.55,95% CI:0.36~0.83),28 d病死率无显著变化(HR=0.73,95% CI:0.52~1.03)[352]。后续发表的WHO的SOLIDARITY试验结果发现瑞德西韦在降低病死率、机械通气风险和缩短住院时长方面无显著获益[353]。一项网状荟萃分析发现,与标准治疗组相比,瑞德西韦在病死率(OR=0.90,95%CI:0.70~1.12)、机械通气风险(OR=0.68,95%CI:0.41~1.00)、机械通气时间(均数差-1.28 d,95%CI:-4.06~1.47 d)等结局无明显临床获益。基于以上证据,临床试验外不推荐使用瑞德西韦用于治疗COVID-19[354]。
(曹彬、王辰)
推荐意见
不推荐洛匹那韦/利托那韦常规用于成人住院COVID-19患者的治疗。(1a,A)
推荐意见说明
1.目前证据提示洛匹那韦/利托那韦治疗在成人住院COVID-19患者病死率、机械通气风险、临床恢复时间、住院时长等结局无显著临床获益。
2.洛匹那韦/利托那韦可能导致恶心、呕吐等消化道症状,肝损伤、QTc间期延长等不良反应。此外,洛匹那韦/利托那韦和其他药物可能有复杂的药物相互作用关系。
推荐依据
洛匹那韦是一种蛋白酶抑制剂,利托那韦能够通过抑制细胞色素P450系同工酶CYP3A4延长洛匹那韦的血浆半衰期[355]。洛匹那韦/利托那韦常规用于HIV感染的治疗,并在体外和动物实验中有抗SARS-CoV和MERS-CoV的活性[356],因此在COVID-19疫情早期即被作为候选治疗药物之一。
共计约8 000例患者参与的4项RCT评估了洛匹那韦/利托那韦对比标准治疗对住院COVID-19患者的有效性和安全性[353,357, 358, 359]。这四项研究纳入的患者涵盖轻症到重症,样本量最大的是英国RECOVERY研究和WHO的SOLIDARITY研究,分别纳入了5 040例患者和2 791例患者。一项共纳入十余种药物的43个RCT的网状荟萃分析提示,洛匹那韦/利托那韦治疗COVID-19患者与标准治疗相比在病死率(OR=0.90,95%CI:0.73~1.09)、机械通气风险(OR=1.10,95%CI:0.70~1.63)、临床恢复时间(均数差-1 d,95%CI:-4.1~3.2 d)、住院时长(均数差-0.4 d,95%CI:-1.7~0.6 d)等结局无显著临床获益,亚组分析未发现年龄和疾病严重程度对结局产生影响[354]。目前洛匹那韦/利托那韦与标准治疗对比的4项RCT研究均纳入的是住院患者,尚无门诊患者早期应用该药物的临床研究发表。LOTUS-China研究、RECOVERY研究的亚组分析提示,更早应用洛匹那韦/利托那韦可能有更多临床获益,但差异没有统计学意义。安全性方面,基于RCT的荟萃分析提示洛匹那韦/利托那韦可能增加恶心/呕吐、腹泻等消化道症状的发生率[360]。此外,洛匹那韦/利托那韦还可能有肝损伤、QTc间期延长、PR间期延长等不良反应[355,361, 362]。由于洛匹那韦/利托那韦对细胞色素P450系同工酶CYP3A4有抑制作用,可能导致它与CYP3A4代谢的药物出现药物相互作用,提升其他药物的浓度,增加不良反应的发生率[363]。基于以上证据,指南专家组不推荐成人住院COVID-19患者常规使用洛匹那韦/利托那韦治疗。
(曹彬、王辰)
推荐意见
不推荐羟氯喹或羟氯喹联合阿奇霉素常规用于成人COVID-19患者的治疗。(1a,A)
推荐意见说明
1.目前证据提示羟氯喹治疗在COVID-19患者病死率、机械通气风险、7 d病毒清除比例、病毒清除时间、临床恢复时间、住院时长等结局无显著临床获益,且可能增加不良事件。
2.目前证据提示羟氯喹联合治疗在COVID-19患者病死率、机械通气风险、住院时长等结局无显著临床获益,且可能增加不良事件。
推荐依据
羟氯喹是一种抗疟疾药物和抗炎症药物,已在疟疾、自身免疫病等疾病有多年的临床应用[355]。羟氯喹对SARS-CoV、SARS-CoV-2存在有效的体外实验数据,在COVID-19疫情早期即被认为是候选治疗药物之一,也是目前RCT最多的药物之一[354, 355]。
一项共纳入十余种药物的43个RCT的动态网状荟萃分析提示,羟氯喹治疗COVID-19患者与标准治疗相比在病死率(OR=1.10,95%CI:0.90~1.35)、机械通气风险(OR=1.20,95%CI:0.83~1.81)、7 d病毒清除比例(OR=1.08,95%CI:0.25~4.78)、病毒清除时间(均数差-0.7 d,95%CI:-4.3~4.8 d)、临床恢复时间(均数差-2.0 d,95%CI:-4.0~0.1 d)、住院时长(均数差0.1 d,95%CI:-1.9~2.0 d)等结局无显著临床获益,亚组分析未发现年龄和疾病严重程度对结局产生影响[354]。羟氯喹联合阿奇霉素治疗COVID-19患者与标准治疗相比在病死率(OR=0.60,95%CI:0.18~1.64)、机械通气风险(OR=1.61,95%CI:0.70~3.80)、住院时长(均数差0.6 d,95%CI:-1.2~2.4 d)等结局无显著临床获益[354]。安全性方面,羟氯喹治疗COVID-19与标准治疗相比可能增加不良事件的发生率(RR=1.83,95%CI:1.12~2.97)、不增加严重不良事件的发生率(RR=1.19,95%CI:0.75~1.87)[364]。羟氯喹联合阿奇霉素治疗COVID-19与标准治疗相比可能增加不良事件的发生率(RR=1.42,95%CI:1.08~1.87)、不增加严重不良事件的发生率(RR=1.06,95%CI:0.22~5.17)[365]。基于目前的有效性和安全性证据,指南专家组不推荐COVID-19患者常规使用羟氯喹或羟氯喹联合阿奇霉素治疗。
(瞿介明)
推荐意见
不推荐氯喹常规用于成人COVID-19患者的治疗,只有在临床试验条件下可考虑使用。(2b,B)
推荐意见说明
目前针对氯喹的研究证据较少,仅有少部分观察性或历史对照研究提示氯喹可能获益,但缺乏大规模的RCT证据,尚需临床试验证实其有效性和安全性。
推荐依据
氯喹是一种4-氨基喹啉药物。除了抗疟疾作用,氯喹还因其免疫调节活性被应用于自身免疫性疾病的治疗。体外实验表明,氯喹能够通过提高内吞体pH值、抑制SARS-CoV-2与宿主细胞膜融合,减少宿主细胞表面ACE2受体的末端糖基化、干扰病毒与受体结合,从而发挥阻断病毒入侵的作用[366, 367]。
一项纳入22例COVID-19患者的小样本单中心RCT中,10例患者随机分配至氯喹组(每次500 mg,每日2次,10 d),12例患者分配至洛匹那韦/利托那韦组(每次400/100 mg,每日2次,10 d)[368]。与洛匹那韦/利托那韦组相比,氯喹组在第7天、第10天和第14天SARS-CoV-2转阴率差异无统计学意义。安全性方面,观察到9人次与氯喹相关的不良反应,未观察到与干预相关的严重不良事件。
一项纳入48例COVID-19患者的开放标签RCT中,18例患者接受氯喹治疗(首日1 000 mg,次日起500 mg/d,疗程共10 d),18例接受羟氯喹治疗(200 mg/次,每日2次,10 d),12例接受对症治疗作为对照组[369]。氯喹组中位临床恢复时间为5.50(IQR:3.25,7.50)d,对照组为7.50(IQR:5.00,16.25)d,两组差异有统计学意义(P=0.019)。氯喹组中位病毒转阴时间为2.5(IQR:2.0,3.8)d,对照组为7.0(IQR:3.0,10.0)d,两组差异有统计学意义(P=0.006)。安全性方面,氯喹组(44.44%)不良事件发生率高于对照组(16.67%)。
一项随机双盲对照研究比较了高剂量氯喹(每次600 mg,每日2次,10 d)和低剂量氯喹(每次450 mg,首日2次,次日起每日1次,5 d)治疗住院COVID-19患者的临床疗效[370]。在纳入81例受试者后,由于总体病死率达27.2%,且高剂量组第13天病死率高于低剂量组(39%比15%,P=0.03),该临床研究终止。主要不良事件中QTc间期延长更易发生在高剂量组(18.9%比11.1%)。
一项历史性对照的队列研究纳入了233例接受磷酸氯喹治疗的COVID-19患者和182例同期采取其他治疗措施的患者[371]。氯喹组197例(84.5%)完成治疗并纳入最终分析,对照组176例(96.7%)纳入最终分析。两组患者均以普通型为主(氯喹组为93.4%,非氯喹组为89.2%)。在病毒核酸转阴时间方面,氯喹组中位核酸转阴时间显著短于对照组(绝对差值-6.0 d,95%CI:-6.0~-4.0 d)。此外,氯喹组发热时间明显短于对照组(几何均数比0.6,95%CI:0.5~0.8),但两组在住院时间方面差异无统计学意义(19.0比20.0 d;P=0.25)。安全性方面,氯喹组53例(26.9%)患者和对照组57例(32.4%)患者报告不良事件,两组相似。
目前氯喹的有效性数据均来自于小样本量的临床试验或历史对照研究,证据质量较低。此外,部分研究显示出氯喹存在可能的安全性顾虑。氯喹治疗COVID-19患者的有效性和安全性尚待进一步临床研究证实,指南专家组不推荐临床试验外使用氯喹治疗COVID-19患者。
(江山平、李时悦)
推荐意见
不推荐单克隆中和抗体常规用于成人COVID-19患者的治疗,只有在临床试验条件下可考虑使用。(1b,A)
推荐意见说明
1.仅有2项正在进行的Ⅱ/Ⅰ~Ⅲ期试验中期分析结果提示单克隆中和抗体较安慰剂组可加快轻症患者的病毒清除,但其在住院患者中的Ⅱ期临床试验未提示明显获益。
2.中和抗体临床试验证据尚无大样本Ⅲ期临床试验数据充分验证,仍需要进一步研究。
推荐依据
SARS-CoV-2依靠表面S蛋白的RBD与人细胞表面ACE2蛋白结合,进而入侵宿主细胞[372]。SARS-CoV-2单克隆中和抗体可阻断其RBD与人ACE2结合,阻止病毒感染宿主细胞[225]。
两项RCT分别研究了一种单克隆中和抗体(LY-CoV555)在门诊和住院患者中的有效性和安全性[373, 374]。纳入452例门诊患者的Ⅱ期RCT中期分析结果提示,使用单次2 800 mg抗体治疗的第11天,患者病毒载量降低幅度与安慰剂组差异有统计学意义,差值为-0.53(95%CI:-0.98~-0.08);700 mg剂量组和7 000 mg剂量治疗后第11天病毒载量降幅与安慰剂组相比差异无统计学意义[373]。在治疗后第29天,抗体治疗组患者住院比例为1.6%(5/309),安慰剂组为6.3%(9/143);事后分析提示,在65岁以上、BMI 35 kg/m2以上患者中,抗体治疗组住院比例为4%(4/95),安慰剂组为15%(7/48)[373]。从第2天到第11天,抗体治疗组患者症状改善更快[373]。安全性方面,抗体治疗组总不良事件发生率为22.3%(69/309),与安慰剂组的24.5%(35/143)相似;抗体治疗组未发现严重不良事件,安慰剂组有0.7%(1/143)发生严重不良事件[373]。纳入314例住院患者的Ⅱ期RCT中期分析结果提示,LY-CoV555组较安慰剂组在第5天病情严重程度(以7等级量表衡量)方面无显著临床获益(OR=0.85,95%CI:0.56~1.29)[374]。此外,LY-CoV555组在临床恢复比例(OR=1.06,95%CI:0.77~1.47)和出院比例(OR=0.97,95%CI:0.78~1.20)方面也没有显著临床获益。上述证据提示,对于门诊患者单克隆中和抗体LY-CoV555早期使用可能降低患者病毒载量,也可能减少轻症患者的住院率和加快症状恢复。对于住院患者,单克隆中和抗体LY-CoV555尚未表现出临床获益,但是目前的研究仅为小样本RCT的中期分析,LY-CoV555对COVID-19患者的有效性和安全性尚待大规模RCT证实。
鸡尾酒形式中和抗体(REGN-COV2)纳入275例门诊患者的Ⅰ~Ⅲ期RCT中期分析结果提示,在基线SARS-CoV-2抗体阴性人群和总人群中观察到了降低第7天病毒载量的临床获益[375]。在自身SARS-CoV-2抗体阴性患者中,抗体治疗组患者的医疗咨询比例为6.3%(5/80),安慰剂组为15.2%(5/33),未观察到显著临床获益(差值-9%,95%CI:-29%~11%)。安全性方面,抗体治疗组2级或以上不良反应发生率1.1%(2/176),与安慰剂组2.2%(2/93)相当[375]。目前证据提示单克隆抗体(REGN-COV2)可能在降低门诊患者病毒载量方面有潜在临床获益,但是在其他重要临床结局未表现出临床获益。REGN-COV2对COVID-19患者的有效性和安全性尚待大规模RCT证实。
基于以上单克隆中和抗体的Ⅱ/Ⅰ~Ⅲ试验仅为中期分析而非确证性的结果以及在不同人群中的差异,指南专家组认为尚需要进一步的研究证据确定单克隆中和抗体的有效性和安全性,不推荐临床试验外COVID-19患者使用单克隆中和抗体治疗。
(严景华、高福)
推荐意见
不推荐恢复期血浆常规用于成人COVID-19患者的治疗,只有在临床试验条件下可考虑使用。(1a,A)
推荐意见说明
1.目前高质量的临床研究数量有限,恢复期血浆的质控标准不一,尚不能对恢复期血浆的疗效得出可靠结论,尚无充足证据表明COVID-19患者常规使用恢复期血浆治疗有临床获益。
2.早期使用高抗体效价恢复期血浆可能有临床获益,尚待大规模RCT研究证实。
推荐依据
恢复期血浆是指感染者在恢复期捐献的血浆,其中可能含有高效价的中和抗体。这种抗体可帮助其他患者清除病原体。血浆本身不能直接改善临床症状,需要和其他治疗手段联合使用。
WHO的动态网状荟萃分析项目纳入了8项RCT(共1 348例患者)[376]。荟萃分析的结果提示使用恢复期血浆不能改善COVID-19患者的14~28 d病死率(RR=0.86,95%CI:0.63~1.18),但证据质量较低。安全性方面,恢复期血浆与标准治疗相比不增加不良事件(RR=1.07,95%CI:0.90~1.27)和严重不良事件(RR=1.26,95%CI:0.83~1.92)的发生率。纳入10 406例住院COVID-19患者的RECOVERY研究恢复期血浆臂的初步观察结果提示恢复期血浆治疗不能降低28 d病死率(18%比18%,RR=1.04,95%CI:0.95~1.14)[377]。这些RCT在患者入选标准及恢复期血浆质控方面并不统一,部分受试患者的抗体滴度较高[378, 379, 380],削弱了恢复期血浆治疗的合理性;同时有些恢复期血浆的抗体滴度不高[379],可能导致治疗效果不显著;部分研究没有报告恢复期血浆的滴度。另外,入组患者的疾病严重程度不尽相同,以住院患者和重症患者为主。
一项纳入3 082例接受恢复期血浆治疗患者的回顾性研究分析了恢复期血浆IgG抗体效价和死亡风险的关系[381]。这项研究发现,对于输注恢复期血浆前未接受机械通气的患者,相比于接受低IgG效价恢复期血浆治疗,接受高IgG效价恢复期血浆治疗与30 d病死率降低相关(RR=0.66,95%CI:0.48~0.91);对于输注恢复期血浆前接受机械通气的患者,接受高IgG效价恢复期血浆治疗与30 d病死率无关联(RR=1.02,95%CI:0.78~1.32)。此外,COVID-19诊断3 d内接受恢复期血浆治疗的患者30 d病死率(22.2%,95%CI:19.9%~24.8%)低于诊断4 d后接受恢复期血浆治疗的患者(29.5%,95%CI:27.6%~31.6%)。这项研究的局限性包括回顾性的研究设计、无未接受恢复期血浆治疗的患者作为对照组等。此外,为了减少输注血浆剂量可能带来的偏倚和输注1个以上单位(可能来自不同供体的)恢复期血浆时分类抗体滴度的不确定性,这项研究仅纳入了接受1个单位恢复期血浆治疗的患者,尚不清楚接受多个单位恢复期血浆治疗的临床获益[381]。一项观察性研究提示入院3 d内接受高抗体效价恢复期血浆治疗的患者28 d病死率可能降低[382]。一项纳入103例重症和危重症COVID-19患者的RCT提示恢复期血浆治疗对加快病毒转阴有潜在效果[383]。此外,一项纳入160例发病3 d以内老年患者的RCT提示恢复期血浆可能降低重症率(RR=0.52,95%CI:0.29~0.94)[384]。这项研究因当地疫情控制而提前结束,把握度不足。这些研究提示,早期使用高效价恢复期血浆可能有临床获益,但尚需样本量足够的RCT研究验证这一假设。
如进行恢复期血浆治疗或相关临床试验,可考虑选择RBD抗体效价高的恢复期血浆。在抗RBD抗体水平较低的患者中使用恢复期血浆可能获益更大。治疗剂量一般为200~400 ml,根据患者体重、病毒载量、心肺功能以及恢复期血浆中RBD抗体效价等因素选择合适的血浆及输注剂量。
为降低输血相关肺损伤的发生风险,宜选择HLA、HNA抗体检测为阴性的血浆,如不具备检测条件应尽量避免使用有输血史或免疫史的供者捐献的血浆。患者有血浆蛋白过敏史、IgA缺乏及血液高凝状态不适合采用恢复期血浆治疗。
总的来说,供者筛选、血浆质控和患者指征是恢复期血浆使用的关键三要素,严格控制指征、早期使用可能获得比较好的治疗效果。基于目前证据,指南专家组认为恢复期血浆治疗COVID-19的有效性和安全性尚待进一步临床试验证实,不推荐在临床试验之外使用恢复期血浆治疗COVID-19患者。
(刘忠)
推荐意见
1.对无需氧疗的成人COVID-19患者,不推荐使用糖皮质激素治疗。(1b,A)
2.对需要氧疗或机械通气的成人COVID-19患者,推荐使用糖皮质激素治疗。(1a,A)
推荐意见说明
1.参考给药方案:地塞米松6 mg静脉注射或口服,每日一次,7~10 d或直到出院;或等效剂量的其他种类糖皮质激素(参考剂量换算公式:0.75 mg地塞米松=4 mg甲泼尼龙=5 mg泼尼松=20 mg氢化可的松);推荐意见中氧疗和呼吸支持治疗的使用指征详见“五、氧疗和呼吸支持治疗”章。
2.因其他疾病正在接受吸入或全身糖皮质激素治疗(如因慢性阻塞性肺病、哮喘或其他慢性自体免疫疾病患者接受吸入/全身用糖皮质激素治疗)的无需氧疗的COVID-19患者,一般不应中断吸入/全身用糖皮质激素疗程;如果需要调整糖皮质激素用药,需仔细权衡利弊,与相关专科讨论调整方案。
3.全身用糖皮质激素导致的免疫抑制可能引起或加重继发感染,在潜在免疫功能低下患者使用糖皮质激素时应谨慎。对合并严重细菌或真菌感染、控制不佳的糖尿病、难以纠正的低钾血症的COVID-19患者使用糖皮质激素前应仔细权衡利弊。
推荐依据
糖皮质激素是一种广谱的抗炎药物,能够从诸多方面调节机体免疫功能,对固有免疫和适应性免疫有较强抑制作用,可抑制肺炎相关的细胞因子的释放并诱导淋巴细胞的凋亡,因此可能降低COVID-19患者的系统性炎症反应水平[385]。
基于11项糖皮质激素对比标准治疗/安慰剂RCT(n=7 947)的网状荟萃分析研究显示:与标准治疗/安慰剂相比,全身用糖皮质激素的使用可降低COVID-19患者的死亡风险(OR=0.85,95%CI:0.70~1.01),机械通气风险(OR=0.72,95%CI:0.50~1.01)、ICU停留天数(均数差-3.83 d,95%CI:-5.88~-1.78 d)[354]。这些研究中,最大规模的RECOVERY试验纳入了6 425例住院(重症和非重症)的患者,评估了口服或静脉注射地塞米松6 mg每日一次长达10 d的效果(2 104例患者接受地塞米松治疗,4 321例患者接受常规治疗)[386]。其他较小规模试验中有8个仅纳入了重症或危重症患者[387, 388, 389, 390, 391, 392],糖皮质激素的种类包括地塞米松、甲泼尼龙、氢化可的松或泼尼松;除2项小规模研究采用甲泼尼龙≥250 mg/d,共3 d的冲击剂量外[390,393],其他8项研究初始剂量分别为地塞米松20 mg/d[391, 392],氢化可的松200 mg/d[389,391]或50 mg每6小时一次[387],甲泼尼龙40 mg每12小时1次[388,391]或0.5 mg/kg每12小时一次[394]。有4项研究采取了逐渐减量的方案[388, 389,391, 392],总疗程5~28 d。全身糖皮质激素治疗对接受不同氧疗/呼吸支持治疗患者预后的影响主要来自RECOVERY研究[386]。RECOVERY研究提示,在入组时接受机械通气患者(n=3 883,RR=0.64;95%CI:0.51~0.81)和单纯氧疗患者(n=1 007,RR=0.82;95%CI:0.72~0.94)中,全身用糖皮质激素有可能降低28 d内死亡风险。但在无需氧疗的非重症COVID-19患者全身用糖皮质激素有可能增加28 d内死亡风险(n=1 535,RR=1.19;95%CI:0.91~1.55)[386]。另一项纳入7项RCT的荟萃分析(n=1 703)提示全身糖皮质激素治疗可降低危重症COVID-19患者的28 d全因死亡风险(OR=0.66,95%CI:0.53~0.82)[391]。
安全性方面,间接证据提示糖皮质激素治疗可能与高血糖(非COVID-19相关的ARDS:RR=1.12,95%CI:1.01~1.24;社区获得性肺炎:RR=1.62,95%CI:1.02~2.67;感染中毒症:RR=1.16,95%CI:1.08~1.24)和高钠血症(感染中毒症:RR=1.64,95%CI:1.32~2.03)相关,与其他不良事件发生率无明显相关[395, 396]。儿童、妊娠妇女及免疫抑制患者全身用糖皮质激素疗效的证据有限。
糖皮质激素有较高的临床可及性,基于目前证据,指南专家组推荐需要氧疗或机械通气的COVID-19患者使用糖皮质激素治疗。剂量方面,根据目前证据、参考WHO COVID-19糖皮质激素指南并结合我国实际,指南专家组推荐地塞米松6 mg静脉注射或口服,每日一次,7~10 d或直到出院;或等效剂量的其他种类糖皮质激素(参考剂量换算公式:0.75 mg地塞米松=4 mg甲泼尼龙=5 mg泼尼松=20 mg氢化可的松)[397]。使用糖皮质激素时需要注意监测患者血糖、血钾、血钠等,并需要注意免疫抑制、继发感染的风险。对于免疫功能低下、合并严重细菌或真菌感染、控制不佳的糖尿病、难以纠正的低钾血症的COVID‐19患者使用糖皮质激素前应仔细权衡利弊。全身用糖皮质激素对无需氧疗的COVID-19患者的临床疗效尚无高质量循证依据。全身用糖皮质激素的最佳用药时机、用药疗程,长期获益和长期安全性尚待进一步研究。此外,需要进一步研究明确抗病毒药物联合糖皮质激素治疗的临床获益和用药时机。
(徐金富、宋元林)
推荐意见
不推荐静脉注射人免疫球蛋白(IVIG)常规用于成人COVID-19患者的治疗,只有在临床试验条件下可考虑使用。(1a,A)
推荐意见说明
目前证据未发现重症COVID-19患者中使用IVIG降低28 d病死率或机械通气比例。
推荐依据
静脉注射人免疫球蛋白(intravenous immunoglobulin,IVIG)是从健康献血者中分离和浓缩得到的血液制品,以IgG为主要成分,具有抗体活性,并且具有潜在的抗炎和免疫调节活性。
有3项小规模RCT(分别纳入84、33和59例患者)研究IVIG在COVID-19患者中的治疗效果,剂量为0.4~0.5 mg·kg-1·d-1或20 g/d×3 d。其中一项RCT共纳入84例重症患者,干预组52例,对照组32例,背景治疗方案包括洛匹那韦/利托那韦、羟氯喹[398]。结果提示两组在病死率(46.1%比43.8%,P=0.8)和机械通气比例(40.3%比21.3%,P=0.39)方面差异无统计学意义。在一项纳入33例重症COVID-19患者的RCT中[399],IVIG组患者(同时接受甲泼尼龙40 mg/d静脉输液)与标准治疗组患者相比,病死率(1/16比3/17)、机械通气比例(12.5%比41.2%,P=0.12)差异均无统计学意义。事后分析发现,用入组时肺泡动脉血氧分压差进行分层,当肺泡动脉血氧分压差>200 mmHg(1 mmHg=0.133 kPa)时,与标准治疗组相比,IVIG组需要机械通气的比例较低(2/14比7/12,P=0.038),住院时间(中位数)较短(11比19 d,P=0.01),ICU住院时间(中位数)较短(2.5比12.5 d,P=0.006),第7天PaO2/FiO2的改善更大[M(P25,P75):+131(+35,+330)比44.5(-115,+157);P=0.01]。另一项RCT纳入59例对初始治疗无反应的重症COVID-19患者[400],发现IVIG组的住院病死率明显低于对照组(20.0%比48.3%,P=0.022),但该研究的偏倚风险较高。基于前两项小规模RCT(共118例患者),WHO的一项系统评价未发现重症COVID-19患者使用IVIG后28 d病死率改善(RR=0.98,95%CI:0.56~1.71)[401]。
一项系统评价对4项2020年早期涉及IVIG的回顾性研究进行了荟萃分析,发现使用IVIG与病死率降低无关[402] (OR=2.66,95%CI:0.72~9.89,P=0.14),但研究之间的异质性较大(I2=93.1%)。
基于目前证据,并考虑到经济因素,指南专家组不推荐COVID-19患者在临床试验外使用IVIG治疗。有的专家根据经验提出从COVID-19康复患者中收集血浆制成IVIG,可以增加中和病毒的机会,疗效更好。目前尚无相关文献报道,但这给治疗COVID-19提供了一个新的思路[403]。
(张伟)
推荐意见
对需要氧疗且病情进展或接受机械通气的成人COVID-19患者,在使用糖皮质激素治疗的基础上,权衡利弊后可考虑使用托珠单抗治疗。(1a-,D)
推荐意见说明
1.目前托珠单抗治疗COVID-19的RCT纳入的多为需要氧疗或机械通气的重症/危重症住院患者。纳入5项早期RCT的荟萃分析、REMAP-CAP研究和RECOVERY研究提示托珠单抗可能降低COVID-19患者的机械通气或有创机械通气风险。此外,纳入8项RCT的荟萃分析提示托珠单抗可能降低COVID-19患者的死亡风险。
2.基于RECOVERY研究和REMAP-CAP研究和目前已发表其他RCT的入组人群,更有可能获益的患者人群是:(1)需要氧疗或机械通气且有系统性炎症反应的患者;(2)入住ICU接受机械通气等器官功能支持24 h之内的患者。
RECOVERY研究中系统性炎症反应的标准为CRP≥75 mg/L。建议用药前检测患者的CRP水平(如果有条件可同时检测IL-6水平)以辅助判断患者体内炎症反应情况。
3.鉴于荟萃分析纳入的原始研究异质性,REMAP-CAP研究和RECOVERY研究的结果尚未经过同行评议,以及尚无评估所有重要临床结局的完整系统评价等原因,目前对于托珠单抗推荐强度较低,使用前需仔细权衡利弊。
4.RECOVERY研究、REMAP-CAP研究、EMPACTA研究均有超过80%的入组患者接受全身糖皮质激素治疗。
使用糖皮质激素的注意事项详见“(一)糖皮质激素”章。对于合并细菌、真菌、其他病毒感染,以及控制不佳的糖尿病等继发感染风险高的重症COVID-19患者需谨慎使用托珠单抗。用药时需监测肝功能及凝血功能等指标,密切监测不良事件。
5.推荐意见中各种氧疗和呼吸支持治疗的使用指征详见“五、氧疗和呼吸支持治疗”章。
6.基于托珠单抗的临床获益,沙利鲁单抗等其他IL-6R拮抗剂可能也有临床获益;但是,由于目前的RCT证据以托珠单抗为主,其他IL-6R拮抗剂的临床获益尚待进一步研究证实。
推荐依据
托珠单抗(Tocilizumab)为免疫抑制性的人源化单克隆抗体,可选择性和竞争性抑制IL-6R与IL-6相结合,从而阻断IL-6信号通路。该类药以往主要用于治疗类风湿关节炎等疾病[404, 405]。其副作用主要为头痛、高血压、肝功能异常、注射部位的反应、严重感染等[405, 406]。
目前托珠单抗治疗COVID-19的RCT纳入的多为需要氧疗或机械通气的重症/危重症住院患者。EMPACTA研究纳入了389例不吸氧时血氧饱和度(SpO2)<94%且未接受机械通气的成人住院COVID-19患者[407]。EMPACTA研究发现,与安慰剂组相比(两组的基础治疗均包括糖皮质激素和抗病毒药物等),接受托珠单抗治疗的患者发生复合结局(机械通气或死亡)的风险降低(HR=0.55,95%CI:0.33~0.97),但病死率无改善(加权率差2.0%,95%CI:-5.2%~7.8%)。在入组前7 d内或试验期间,托珠单抗组(80.3%)和对照组(87.5%)均有超过80%的患者接受糖皮质激素治疗。在安全性方面,托珠单抗组发生不良事件和严重不良事件的比例与对照组相近。一篇系统评价和荟萃分析纳入了5项RCT共包含1 325例重症COVID-19患者[408]。病死率方面,使用托珠单抗的患者与对照组相比差异无统计学意义(RR=1.09,95%CI:0.80~1.49)。其中4项RCT报告了机械通气风险,共纳入了771例重症COVID-19患者,结果提示接受托珠单抗治疗可能降低机械通气风险(RR=0.71,95%CI:0.52~0.96)。
2021年有三项托珠单抗治疗COVID-19的RCT于预印本平台或同行评议期刊发表。预印本形式公布结果的RECOVERY研究是一项针对住院COVID-19患者的多臂、开放标签RCT[409]。该研究采用了分阶段随机的方式,患者第一阶段随机接受标准治疗或其他试验药物治疗,入组21 d内且有疾病进展证据的患者接受第二阶段随机,随机接受标准治疗或托珠单抗治疗;疾病进展的主要表现为需要氧疗或机械通气且有炎症反应证据,具体标准为同时满足下列两个条件:(1)不吸氧时SpO2<92%或需要吸氧;(2)CRP≥75 mg/L。此外,已知托珠单抗过敏的患者、活动性结核患者、有临床证据表明合并细菌、真菌和其他病毒感染的患者不参加第二次随机。最终2 022例住院COVID-19患者随机接受托珠单抗治疗,2 094例患者随机接受标准治疗。RECOVERY研究发现托珠单抗组患者28 d病死率为29%,标准治疗组为33%(RR=0.86,95%CI:0.77~0.96),绝对差值为4%,并且这一获益在入组时接受普通氧疗、无创机械通气、有创机械通气的患者亚组中都有体现。在入组时尚未接受有创机械通气的患者中,相对于标准治疗组,托珠单抗将患者接受有创机械通气或死亡(复合结局)的风险从38%降低至33%(RR=0.85,95%CI:0.78~0.93);其中,有创机械通气风险从15%降低至12%(RR=0.81,95%CI:0.68~0.95),死亡风险从31%降低至27%(RR=0.88,95%CI:0.79~0.97)。此外,相对于标准治疗组,托珠单抗组28 d内出院的比例更高(RR=1.22,95%CI:1.12~1.34)。但是,对于随机时已经接受有创机械通气的患者,托珠单抗不改变患者的撤机成功率(RR=1.07,95%CI:0.80~1.43)。82%的入组患者接受了地塞米松等全身糖皮质激素治疗,亚组分析提示,未接受糖皮质激素治疗的亚组在病死率、28 d内出院、接受有创机械通气或死亡(复合结局)等方面无显著临床获益。因此,托珠单抗的临床获益可能是糖皮质激素临床获益基础上的额外获益。RECOVERY研究的安全性结局包括特定死因病死率和心律失常,两组无显著差异。RECOVERY研究中未报道继发感染发生的比例。
另一项以预印本形式公布结果的REMAP-CAP研究也是一项多臂RCT,纳入了803例入住ICU开始接受呼吸支持或者接受静脉血管活性药/强心药治疗24 h以内的重症COVID-19患者[410]。这项研究中,与标准治疗组(n=402)相比,托珠单抗组(n=353)和沙利鲁单抗(sarilumab)组(n=48)可能增加无器官功能支持天数,降低院内病死率,降低入组时未接受有创机械通气的患者接受有创机械通气或死亡(复合结局)的风险。REMAP-CAP研究中超过80%的入组患者接受了糖皮质激素治疗,亚组分析提示糖皮质激素和托珠单抗/沙利鲁单抗联合治疗可能优于单药治疗。另有1项纳入129例重症或危重症COVID-19患者的RCT中托珠单抗不改善15 d内发生复合结局(机械通气或死亡)的风险[411]。
此外,RECOVERY试验的预印本论著中对8项托珠单抗RCT的病死率结局进行了荟萃分析,结果提示托珠单抗降低病死率(RR=0.87,95%CI:0.79~0.96)[409]。由于荟萃分析纳入的RCT有一定异质性(如入组标准、标准治疗方案有一定差异),且采用的合并模型为倒方差法,可能会高估在病死率方面的获益。
对于需要氧疗或机械通气的患者,目前证据提示在接受了糖皮质激素治疗的基础上,托珠单抗在病死率、机械通气风险等方面有额外获益。在糖皮质激素治疗的基础上使用托珠单抗可能增加发生继发感染等不良事件的风险,因此使用前需仔细权衡利弊。建议用药前检测患者的CRP水平(如果有条件可同时检测IL-6水平)以辅助判断患者体内炎症反应情况。剂量方面,目前的RCT多采用8 mg/kg的给药方案,《新型冠状病毒肺炎诊疗方案(试行第八版)》推荐剂量为4~8 mg/kg,一般单次剂量不超过800 mg[156]。建议用药前咨询药师以个体化用药并密切监测不良反应。
(熊维宁、宋元林)
推荐意见
不推荐Janus激酶(JAK)抑制剂常规用于成人COVID-19患者的治疗,只有在临床试验条件下可考虑使用。(1b,A)
推荐意见说明
目前证据表明JAK抑制剂联合瑞德西韦治疗重症COVID-19,相比于单用瑞德西韦可能有临床获益,但尚缺乏大规模证据证明JAK抑制剂本身的有效性以及安全性。
推荐依据
Janus激酶(Janus kinase,JAK)是与受体相关的酪氨酸激酶家族,由JAK1、JAK2、JAK3和TYK2组成[412]。它们可以传递来自细胞外的多种促炎性细胞因子及干扰素信号,以激活信号转导和转录激活因子(STAT)。目前已上市三种JAK抑制剂:托法替尼可同时抑制JAK1、JAK2和JAK3;巴瑞替尼和鲁索替尼同时抑制JAK1和JAK2[413]。
一项在8个国家67个试验中心开展的随机双盲对照研究纳入1 033例COVID-19患者(515例患者接受巴瑞替尼联合瑞德西韦治疗,518例患者接受安慰剂联合瑞德西韦治疗)[414],巴瑞替尼+瑞德西韦治疗组在缩短康复时间(7比8 d,RR=1.16,95%CI:1.01~1.32,P=0.03)、改善临床状况(OR=1.3,95%CI:1.0~1.6)、改善28 d病死率(5.1%比7.8%,HR=0.65,95%CI:0.39~1.09) 方面优于单用瑞德西韦组。在安全性方面,巴瑞替尼和瑞德西韦联合治疗组较对照组更少发生严重不良事件(16.0%比21.0%,P=0.03) 和新发感染(5.9%比11.2%,P=0.003)[414]。
一项鲁索替尼治疗重症COVID-19有效性和安全性的小样本单盲RCT中[415],20例患者口服鲁索替尼5 mg/次(2次/d),联合标准治疗,21例接受安慰剂联合标准治疗。鲁索替尼组与对照组在临床改善时间(HR=1.669,95%CI:0.836~3.335)、28 d病死率(0比14.3%,P=0.232)和病毒清除时间(HR=0.782,95%CI:0.271~2.257)差异无统计学意义。在不良事件方面,鲁索替尼治疗组和对照组差异无统计学意义。在德国开展的一项小型回顾性单臂研究中,14例重症COVID-19患者接受了较短时间的鲁索替尼治疗(平均疗程9 d),所有患者均未观察到不安全性事件[416]。而另一篇病例报告报道两例COVID-19患者在接受鲁索替尼联合洛匹那韦/利托那韦治疗后出现了严重的不良反应(2例患者均出现皮肤过敏性紫癜,血细胞比容值逐渐降低,1例患者出现血小板减少症和深层组织感染),需要停药[417]。
针对托法替尼,目前尚无治疗COVID-19的公开临床数据。
综上所述,目前有一项高质量RCT表明巴瑞替尼联合瑞德西韦治疗重症COVID-19,比单用瑞德西韦有更多临床获益。鲁索替尼和托法替尼尚无充足临床证据表明治疗COVID-19有效。由于瑞德西韦本身尚未被推荐在临床试验外使用,因此本指南专家组亦不推荐临床试验外使用巴瑞替尼治疗重症COVID-19。目前有关JAK抑制剂治疗COVID-19的直接证据较少,需要充分的临床试验来进一步验证其疗效及安全性。
(周敏)
推荐意见
1.不推荐干扰素β皮下注射常规用于成人COVID-19患者的治疗。(1a,A)
2.不推荐其他干扰素疗法(干扰素β雾化吸入,干扰素α、干扰素κ等)常规用于成人COVID-19患者的治疗,只有在临床试验条件下可考虑使用。(1b,A)
推荐意见说明
1.已有的系统评价和大样本RCT未发现干扰素β皮下注射可降低COVID-19成人患者病死率。部分小样本量RCT发现干扰素可改善COVID-19患者的临床症状、降低重症风险、缩短病毒核酸转阴时间。
2.干扰素在COVID-19患者中未见严重不良反应,常见的不良反应为头痛、恶心、腹泻。
推荐依据
干扰素是具有抗病毒和免疫调节作用的细胞因子,体内外研究发现其对β冠状病毒引起的SARS和MERS有一定的抗病毒作用[418, 419, 420, 421]。
1.干扰素β:SARS-CoV-2在体外直接抑制干扰素β释放[422],且在重症COVID-19患者中其活性显著降低[423]。
(1)皮下注射:一项动态系统评价和网状荟萃分析提示,干扰素β未降低COVID-19患者的病死率(OR=1.02,95%CI:0.70~1.32)、机械通气风险(OR=0.87,95%CI:0.45~1.46)[354]。SOLIDARITY研究提示,干扰素β-1a组(n=2 063)在病死率(RR=1.16,95%CI:0.96~1.39)、住院天数、机械通气使用率等结局无临床获益。同时,通过对年龄、性别、糖尿病、肺部病变程度、入组时呼吸支持情况进行调整后,多因素Cox回归分析并未发现干扰素治疗组的病死率低于标准治疗组(RR=1.14,95%CI:0.96~1.35)[353]。
部分小样本干扰素联合用药的临床试验显示出了一些临床获益。一项开放标签纳入86例患者的小规模RCT发现,在非重症COVID-19患者中干扰素β-1b+洛匹那韦/利托那韦+利巴韦林组咽拭子转阴的中位时间明显短于洛匹那韦/利托那韦对照组(4.0比8.0 d,P=0.001),多因素分析表明干扰素是第7天咽拭子核酸转阴的独立影响因子(P<0.001)[424];干扰素组临床症状改善时间也短于对照组(NEWS2归零时间4.0比8.0 d,HR=3.9 d,95%CI:1.66~9.23;SOFA归零时间3.0比8.0 d,HR=1.89,95%CI:1.03~3.49)[424]。对于重症COVID-19,一项小规模(n=92)RCT发现干扰素β-1a联合羟氯喹+洛匹那韦/利托那韦或阿扎那韦/利托那韦治疗组(n=42)28 d全因死亡风险低于对照组(19.0%比43.6%,OR=2.95,95%CI:1.08~8.03)[425]。另一项小规模RCT(n=80)发现干扰素β-1b联合羟氯喹+洛匹那韦/利托那韦或阿扎那韦/利托那韦治疗组(n=37)临床改善时间短于对照组(9.0比11.0 d,HR=2.30,95%CI:1.33~3.39)、转入ICU率低于对照组(42.42%比66.66%,P=0.04)[426]。
(2)雾化吸入:一项针对干扰素β-1a雾化吸入的多中心、随机对照、双盲Ⅱ期临床试验发现干扰素β-1a雾化吸入组(n=50)在OSCI量表上改善的几率更大(OR=2.32,95%CI:1.07~5.04),重症风险也低于对照组(OR=0.21,95%CI:0.04~0.97)[427]。
2.干扰素α:干扰素α水平在COVID-19危重患者中低于非重症患者,且与干扰素刺激基因相关[423]。一项关于干扰素α-2b雾化(或联合阿比多尔)的回顾性队列研究中[428],治疗组(n=53)下呼吸道病毒清除平均时间为20.4 d,较对照组缩短7 d(P=0.002)。
3.干扰素κ联合三叶因子2:干扰素κ是一种相对温和的Ⅰ型干扰素,能有效抑制包膜病毒的复制。一项在非重症患者中进行的干扰素κ联合三叶因子2雾化吸入的RCT中,干扰素κ联合三叶因子2雾化组(n=40)病毒核酸转阴时间(3.80 d,95%CI:2.07~5.53 d)短于对照组(7.40 d,95%CI:4.57~10.23 d,P=0.031),同时CT病灶改善时间明显缩短(6.21比8.76 d,P=0.002 1)[429]。
4.干扰素γ:干扰素γ是由T淋巴细胞产生、具有抗病毒和免疫调节作用的Ⅱ型干扰素。Idelsis等[430]发现,试验组(n=33,干扰素γ联合干扰素α-2b皮下注射+洛匹那韦/氯喹口服)治疗4 d后病毒阴性率为78.6%,对照组(n=33,干扰素α-2b皮下注射+洛匹那韦/氯喹口服)则为40.6%(P=0.004)。治疗组和对照组核酸阴性的时间分别为3.0和5.0 d(HR=3.2,95%CI:1.529~6.948)。治疗组不良事件发生率为34.4%,对照组为28.5%,最常见的是头痛(17.4%)。
目前,除外系统评价和SOLIDARITY研究,其余研究样本量均较小,且均未对治疗剂量、疗程和治疗时机进一步分组比较或分层研究,后续仍有待大样本量、设计良好的高质量研究进一步对干扰素在COVID-19患者中的疗效进行评估。
(卢洪洲)
推荐意见
1.不推荐重组人粒细胞集落刺激因子(rhG-CSF)常规用于成人COVID-19患者的治疗,只有在临床试验条件下可考虑使用。(1b,A)
2.接受化疗且合并COVID-19的肿瘤患者在使用rhG-CSF之前,临床医生应仔细权衡利弊。(3b,B)
推荐意见说明
1.一项在无基础疾病和淋巴细胞明显降低(外周血淋巴细胞计数<400/μm3)的COVID-19患者中进行的RCT显示,rhG-CSF治疗未达到主要结局(缩短临床改善时间),在次要结局(危重症化比例和病死率)显示出了临床获益。由于目前研究样本量较小,且rhG-CSF组不良事件发生率显著升高,该药物的有效性和安全性尚待更大规模的临床试验证实。
2.对于中性粒细胞减少且合并COVID-19的肿瘤患者,rhG-CSF治疗与需要更高的氧供和死亡可能有一定的相关性,临床医生在使用rhG-CSF干预中性粒细胞减少时,应警惕其导致COVID-19病情加重的可能。
推荐依据
淋巴细胞减少是COVID-19患者的常见特征,其下降程度与疾病的持续时间、严重程度和病死率相关。重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhG-CSF)能刺激粒、单核巨噬细胞成熟和释放,增强中性粒细胞趋化和吞噬的功能,提升淋巴细胞的数量[431]。有报道提示:4例COVID-19患者在注射rhG-CSF后,随着临床症状的改善,其淋巴细胞总数、T淋巴细胞、CD4+ T细胞和CD4+/CD8+比值均有不同程度的回升[432]。一项在无基础疾病和淋巴细胞明显降低(外周血淋巴细胞计数<400/μm3)的COVID-19患者中进行的RCT提示,rhG-CSF不能缩短临床改善时间(HR=1.28,95%CI:0.95~1.71)[433]。在次要结局病死率(HR=0.19,95%CI:0.04~0.88)和危重症化比例(2%比15%,差值-13%,95%CI:-21.4%~-5.4%)方面rhG-CSF显示出了可能的临床获益[433]。但是,由于这项RCT没有达到主要结局(两组临床改善时间无差异),尽管次要结局的病死率有差异,但各组绝对死亡例数较低,且未进行盲法、样本量小、随访时间较短(21 d),次要结局的结果解释需要谨慎。安全性方面,尽管rhG-CSF组的患者发生严重不良事件的比例较低,但是总体不良事件的比例高于对照组(92.9%比46.1%)。考虑到这项药物成本较高,在没有更大规模的研究验证其有效性及安全性之前,指南专家组不推荐在临床试验之外使用rhG-CSF治疗COVID-19患者。
中性粒细胞减少在肿瘤患者中较常见。一项纳入304例确诊为COVID-19的肿瘤患者的观察性队列研究表明:中性粒细胞减少症不是患者在住院期间发生严重呼吸衰竭或死亡的独立影响因素(HR=0.71,95%CI:0.34~1.50),给予rhG-CSF与需要更高的氧供和死亡可能有一定的相关性(HR=2.97,95%CI:1.06~8.28)[434]。此外,一项病例系列研究报道了3例确诊COVID-19的肿瘤患者,给予rhG-CSF治疗,24 h后3例患者的NLR>3,72 h后3例患者的NLR均>5,并且均出现了呼吸功能下降[435]。综上所述,对于接受化疗且合并COVID-19的肿瘤患者,在使用rhG-CSF干预中性粒细胞减少之前,临床医生应当仔细权衡利弊,警惕其可能导致COVID-19病情加重[436, 437, 438]。
(程璘令、李时悦)
推荐意见
对于COVID-19患者,推荐当SpO2≤93%,进行氧疗;当SpO2<90%时,需要立即氧疗。(5,D)
推荐意见说明
1.COVID-19重型和危重型患者应接受氧疗。
2.对于需要氧疗的COVID-19患者,以5 L/min的流速开始氧气治疗以达到目标SpO2>93%;如果患者病情危重应使用储氧面罩(初始流量8~15 L/min)。如果无法达到SpO2≥90%,必须采用其他呼吸支持方式。
3.氧疗时考虑将SpO2维持在93%~96%。
推荐依据
目前关于COVID-19患者氧疗的随机或非随机对照研究较少。有关氧流量调节及氧疗目标值来源于现有临床规范[439]。
一项1 099例COVID-19患者的研究显示,41%的住院患者和70%的重症患者需要氧疗[45]。一项纳入140例住院COVID-19患者的回顾性队列研究提示,低氧血症是死亡的独立危险因素(HR=2.6,95%CI:1.24~5.43)[440]。一项含25个RCT的系统评价发现开放性氧疗(liberal oxygen therapy)可能与院内死亡的风险增加有关(RR=1.21,95%CI:1.03~1.43)[441]。为避免较高SpO2可能带来的死亡风险,结合资源因素,氧疗时考虑将SpO2维持在93%~96%。
(梁宗安)
推荐意见
对于COVID-19导致急性呼吸衰竭,若鼻导管吸氧或经面罩吸氧无法维持SpO2>93%,推荐使用经鼻高流量湿化氧疗(HFNC)。(2b,B)
推荐意见说明
1.当氧疗的氧流量>6 L/min或给氧浓度>40%,患者仍不能维持SpO2>93%时,使用HFNC,目标是维持SpO2>93%。
2.应对使用HFNC的患者进行密切监测,1~2 h后进行评估,若低氧血症无法纠正或出现Ⅱ型呼吸衰竭,应进行无创通气或有创通气。
3.进行气管插管操作时,HFNC可以作为预氧合的一个选择。在机械通气患者撤机后,可考虑使用HFNC进行过渡。
推荐依据
经鼻高流量湿化氧疗(high-flow nasal cannula oxygen therapy,HFNC)可提供较高且较稳定的浓度的氧气,能在口鼻腔形成3~5 cm H2O(1 cmH2O=0.098 kPa)呼气末正压,具有冲刷生理死腔并降低上气道阻力和呼吸功的作用;可提供经充分湿化温化的气体,能较好地维持黏液纤毛清除系统功能[442]。
一项379例COVID-19患者(146例患者使用HFNC)的回顾性研究发现,HFNC可以降低患者起病后28 d内插管率(56%比75%,P<0.001),但对28 d病死率(HR=0.69,95%CI:0.45~1.07)没有影响[443]。一项40例使用HFNC的COVID-19患者并发ARDS的回顾性研究发现,HFNC不会增加延迟插管导致的病死率[444]。而在HFNC失败的患者中,病死率高达65%[445]。一项272例COVID-19患者的多中心回顾性研究发现,ROX指数>3.0可预测HFNC的成功率,敏感度为85.3%[446]。一项58例COVID-19患者的RCT提示,与经面罩吸氧相比,使用HFNC进行预氧合,可显著改善插管过程中的最低氧饱和[94%(92.1%~95.8%)比91%(86.3%~93.0%),P=0.001]、降低插管所需时长[69(62.2~74.0)s比76(68.0~90.5)s,P=0.005],降低紧急通气风险(4%比27%;P=0.015)[447]。和经面罩吸氧相比,HFNC不增加气溶胶传播风险[448]。一项2 936例拔管后的机械通气患者的荟萃分析发现,HFNC在预防再插管方面优于普通氧疗,不劣于无创通气[449]。
(梁宗安)
推荐意见
PaO2/FiO2低于200 mmHg的COVID-19患者应给予无创通气。若短时间(1~2 h)治疗后病情无改善,应及时进行有创机械通气治疗。(2b,B)
推荐意见说明
1.理想状态下应在负压病房进行无创通气,若条件有限,应确保单间病房或者同一病房内只有确诊COVID-19患者。最优的呼吸机模式和参数尚无明确结论。在患者耐受的情况下可使用清醒俯卧位通气。
2.患者在开始使用无创通气后,应密切观察病情,1~2 h内连续监测生命体征,呼吸氧合等指标。疗效不佳者应及时气管插管、有创通气,避免延迟插管。
推荐依据
PaO2/FiO2低于200 mmHg应给予无创通气[450]。两项多中心回顾性观察队列研究提示,低氧性呼吸衰竭的COVID-19患者,在非ICU环境中使用无创机械通气是可行的,总体成功率>70%,但不能改善长期预后[451, 452]。一项含45篇COVID-19研究的系统评价提示,与不使用呼吸支持治疗相比,使用无创机械通气可能减少患者病死率[453]。一项含7篇COVID-19研究、1 899例患者的系统评价提示,俯卧位通气在非插管的COVID-19患者中使用普遍,易耐受(63.0%~83.9%),可改善氧合,提高血氧饱和度(P<0.001)和氧合指数(仰卧位:180.5 mmHg比俯卧位:285.5 mmHg,P<0.001),促进肺复张[454]。一项36例COVID-19患者的多中心观察性研究提示,在COVID-19危重患者中,无论使用HFNC还是无创通气作为一线治疗,总机械通气时长[M(P25,P75)为7.1(3.5~12.2)d比7.3(5.3~10.0)d]、插管率(17%比15%)、病死率(4%比8%)等方面差异均无统计学意义[455]。
有4个小样本研究提示,在需要无创通气的低氧性呼吸衰竭COVID-19患者中,使用俯卧位通气是安全且易耐受的,可以迅速有效地改善患者症状、氧合和影像学表现,在部分患者中能降低气管插管率。但这种改善的持续时间、每日清醒俯卧位通气的最佳时长及实施俯卧位对患者病死率的影响,还有待更大规模的研究进一步明确[456, 457, 458, 459]。
(梁宗安)
推荐意见
1.推荐呼吸功能急剧恶化、HFNC或无创通气治疗效果不佳、血流动力学不稳定或意识障碍的患者应及时接受气管插管及有创机械通气。(2b,B)
2.推荐气管插管由经过训练的有经验的团队执行,使用可视喉镜系统并采用有效的空气隔离措施降低医护人员感染风险。(2c,B)
3.对于短期内无法脱机的患者可考虑气管切开。(2c,B)
推荐意见说明
1.COVID-19患者实施HFNC或无创通气治疗时,出现以下几种情况应及时实施气管插管和有创机械通气:(1)呼吸窘迫加重或吸气努力过强,表现为低氧血症无法改善(SpO2≤93%),或呼吸过快(呼吸频率≥35次/min)、潮气量(Vt)过大(>9~10 ml/kg理想体重)或其他吸气努力过强的表现。(2)组织缺氧或乳酸进行性升高。(3)血流动力学不稳定或意识障碍。
2.COVID-19患者有创机械通气可根据ARDS的分型采取不同的策略。
3.中重度ARDS在机械通气的最初48 h可采取深镇静镇痛肌松的策略,但不常规对接受机械通气的COVID-19患者持续静脉输注神经肌肉阻滞剂。
4.俯卧位可用于中重度ARDS患者,每日俯卧位通气时间建议在12~16 h,使用时需注意预防压疮、管道阻塞脱落等相关并发症。
5.为了减少插管并发症,降低由于插管时间延长造成的气溶胶浓度升高以及对患者生命的威胁,应该由经过训练的团队来执行此操作;相较于直视喉镜,可视喉镜系统更有利于插管时会厌的暴露以及对插管人员的保护;有条件的情况下,建议使用正压头套或头套式正压呼吸器。
6.对已接受气管内插管行机械通气的患者,如果患者呼吸功能恢复缓慢,短时间(7~10 d)不能脱机拔管,可考虑行气管切开。
推荐依据
一部分COVID-19患者在首发症状5~10 d后会出现呼吸功能的急剧恶化,表现为呼吸窘迫和低氧血症,通常伴有呼吸频率>30次/min,SpO2低于93%,氧合指数<300 mmHg,对呼吸支持依赖程度较高,多数患者鼻导管或面罩吸氧难以改善,需要HFNC、无创通气[261]。在HFNC或无创通气支持下,呼吸窘迫仍然存在甚至恶化,则需尽快实施有创机械通气。目前尚无系统评价或大型RCT比较早期气管插管和延迟气管插管机械通气对患者病死率的影响,也没有专门针对COVID-19呼吸衰竭患者的插管指征和时机的选择。插管时机的选择大多取决于临床医生的经验和判断。一项包含了755例重症COVID-19患者的单中心回顾性研究表明,插管时间延迟伴随住院病死率的升高(HR=1.03,95%CI:1.01~1.05)[460],但同时另外两个样本量较小的研究得出了相反的结果[461, 462],认为COVID-19呼吸衰竭患者的插管时机同其他原因引起的呼吸衰竭相同,早期积极的有创机械通气并不能改善预后。
机械通气策略方面,目前没有专门针对COVID-19相关的ARDS机械通气策略的RCT。一些观察性的研究发现部分ARDS患者表现为肺顺应性正常,与传统的ARDS有所区别,因此Gattinoni等[463]提出根据患者肺顺应性的不同将COVID-19相关的ARDS分为两个亚型:L型和H型。L型以通气血流比例异常为主,肺顺应性较好或正常,对PEEP反应性差。机械通气策略以增加Vt量降低氧需求为主,可考虑使用较低的呼气末正压(PEEP)(<10 cmH2O)和普通Vt(7~9 ml/kg)。H型临床特点同典型的ARDS相似,以肺顺应性下降为主,通气策略同经典的ARDS通气策略:小Vt(4~6 ml/kg)以及较低的平台压(<30 cmH2O);高PEEP(PEEP>10 cmH2O),根据FiO2滴定PEEP维持SpO2>93%,以改善肺泡不张和减少吸气末肺泡过度扩张;肺复张可能有效,床旁超声可以用于评估患者肺的可复张性[464]。L型可能向H型转变,需要及时识别并转换通气策略。
俯卧位通气已被证实可以改善ARDS患者肺的不均一性,改善氧合,早期实行延长的俯卧位通气治疗可以明显改善中重度ARDS患者的28 d(16.0%比32.8%,HR=0.39,95%CI:0.25~0.63)及90 d(23.6%比41.0%,HR=0.44,95%CI:0.29~0.67)病死率[465]。接受HFNC联合俯卧位治疗的COVID-19患者能明显延迟气管插管的时间,但对28 d病死率没有影响[466]。一项小样本的单中心观察性研究发现,俯卧位可以改善合并ARDS的COVID-19患者的肺复张性(1/17比13/36,P=0.020)[467]。
一项针对包括COVID-19在内的传染性冠状病毒疾病的系统评价研究表明,SARS感染时医务工作者在执行诸如气管插管、胸外按压时被感染的风险明显增高[453]。一项针对COVID-19的研究发现直接接触经鼻导管吸氧患者的麻醉医生有11%被感染[468]。实施有创机械通气需进行气管内插管,气管插管是可能产生大量气溶胶的操作[469]。传统的直视喉镜系统在操作的时候,操作者离患者的嘴距离非常近,被感染的风险增高。可视喉镜具有增加操作者与患者嘴的距离和缩短插管时间的优点,可以用于COVID-19患者的紧急气管插管[470]。
对于接受气管内插管机械通气患者何时应该接受气管切开目前尚无定论,取决于许多因素。没有证据证实COVID-19患者行气管切开会增加医护人员感染风险。一项包含了50例患者的单中心回顾性研究表明,在做好正确的个人防护情况下,给COVID-19患者行气管切开没有造成医护人员感染[471]。结果还表明,早期的气管切开(<10 d)可能降低机械通气时间[(18±5.4)比(22.3±5.7)d])、增加成功脱机比例(HR=4.04,95%CI:0.93~17.54),缩短ICU留住时间,提高ICU床位使用率[471]。
(彭志勇)
推荐意见
对于传统标准呼吸支持疗效不佳的重症COVID-19患者,推荐在有经验、人员充足的中心开展ECMO治疗。(2b,B)
推荐意见说明
1.考虑到COVID-19的潜在可逆性,建议静脉-静脉体外膜式氧合(VV-ECMO)应用于经传统标准治疗手段(肺保护性通气Vt 6 ml/kg,平台压<30 cmH2O,PEEP≥10 cmH2O,并且联合肺复张、俯卧位、肌松剂等手段)无明显改善、排除禁忌证,且满足以下任一条件的COVID-19患者:(1)PaO2/FiO2<50 mmHg超过3 h;(2)PaO2/FiO2<80 mmHg超过6 h;(3)动脉血pH<7.25并伴有动脉血二氧化碳分压(PaCO2)>60 mmHg超过6 h,且呼吸频率>35次/min。当COVID-19患者存在心源性休克或者出现心脏骤停时,需要应用VA-ECMO。
2.ECMO支持治疗的禁忌证:严重脑功能障碍;有应用肝素的禁忌(如严重凝血功能障碍、近期颅内出血、对肝素过敏、肝素诱导的血小板减少症等); 高通气支持水平(气道平台压>30 cmH2O,FiO2>0.8)应用>7~10 d;血管病变限制通路的建立;高龄(>80岁);BMI>45 kg/m²。
3.ECMO是呼吸衰竭患者终末期的重要支持治疗手段,但由于风险高、并发症多且经济代价大,推荐由具有丰富ECMO经验与充足专业人员的医院进行操作。
推荐依据
目前尚无验证ECMO治疗COVID-19有效性的RCT,而纳入ARDS患者的2项RCT提示ECMO可明显改善重症患者的预后[472, 473],这对于ECMO应用于COVID-19重症患者提供了参考。其中,CESAR研究提示,与传统性治疗方式相比,ECMO显著降低ARDS患者6个月死亡或重度致残风险(RR=0.69,95%CI:0.05~0.97)[473]。EOLIA研究提示,相较于传统性治疗方式,ECMO治疗患者的60 d病死率虽无统计学意义上的显著性下降(46%比35%,RR=0.76,95%CI:0.55~1.04),但ECMO用于终末期呼吸衰竭患者的临床重要性仍然值得肯定[472]。
一项纳入59例COVID-19 ARDS患者的回顾性队列研究提示:与仅机械通气支持患者相比,机械通气联合ECMO可降低COVID-19 ARDS患者的病死率(63.2%比57.1%,P=0.78)[474]。2项无对照的观察性研究分别纳入1 035例(ELSO注册研究)[475]和83例[476]COVID-19成人患者,其结果显示ECMO支持患者90 d病死率分别为37.4%(95%CI:34.4%~40.4%)[475]和36%(95%CI:27%~48%)[476],提示ECMO治疗COVID-19与传统ARDS病死率接近。由于队列研究随访周期较短,尚无ECMO改善远期病死率的数据,有待进一步研究。在并发症方面,目前没有直接证据证明COVID-19 ECMO支持患者与传统ARDS ECMO支持患者的差异。在ELSO注册的描述性研究中,6%患者出现脑出血,0.7%出现脑梗死,5%出现溶血,28%出现机械性并发症(氧合器障碍、离心泵障碍、管路调整),这提示COVID-19患者与传统ARDS患者的ECMO相关并发症发病率相近[475]。
由于目前ECMO用于COVID-19患者的证据较少,所以参考ECMO在其他病毒(如甲型H1N1流感病毒、MERS-CoV)感染患者中的疗效具有重要借鉴意义。2011年,英国一项纳入1 756例H1N1患者的回顾性队列研究,分别使用3种配对方法比较了59、75、75对ECMO支持患者与非ECMO支持患者,结果显示ECMO支持患者的住院病死率显著低于非ECMO支持患者(23.7%比52.5%,RR=0.45,95%CI:0.26~0.79;24.0%比46.7%,RR=0.51,95%CI:0.31~0.81;24.0%比50.7%,RR=0.47,95%CI:0.31~0.72)[477]。2018年,沙特阿拉伯的一项回顾性队列研究纳入罹患MERS ARDS的17例ECMO支持患者和18例非ECMO支持患者,结果显示ECMO支持患者的住院病死率显著降低(65%比100%,P=0.02),在ICU第7天和第14天的氧合指数更好(124比63,P<0.05;237比85,P<0.05),在第1天和第14天使用去甲肾上腺素的比例更低(29%比80%,P<0.05;36%比93%,P<0.05)[478]。以上研究提供了流行性冠状病毒感染所致ARDS患者应用ECMO支持治疗的循证医学证据,提示ECMO支持治疗有可能为COVID-19患者带来获益。
(詹庆元)
推荐意见
1.对于合并内科疾病或外科情况的轻型和普通型COVID-19患者,根据Padua评分或Caprini评分评估为VTE高危或中高危者,若无抗凝禁忌,建议预防抗凝。(2a,B)
2.所有重型或危重型COVID-19患者,若抗凝无禁忌,均建议进行预防抗凝。(2a,B)
3.需ICU治疗的COVID-19患者,若出血风险低,建议考虑适当增加预防抗凝药物剂量。(2a,B)
推荐意见说明
1.隔离治疗是切断感染源的重要途经,隔离治疗使活动空间限制,活动减少,血栓形成风险升高,若合并内科或者外科疾病也可以增加血栓风险,若血栓风险评分提示高危或者中危患者,若无抗凝禁忌,建议预防抗凝。
2.研究表明重型或危重型COVID-19患者,VTE发生率明显高于其他疾病的重症患者,提示预防抗凝尤为重要,故若没有抗凝禁忌,均建议进行抗凝预防。在重型COVID-19的住院患者中,由于缺乏已知的与抗病毒药物的药物相互作用,推荐使用低分子肝素(low molecular weight heparin,LMWH)或普通肝素(unfractionated heparin,UFH)抗凝治疗。UFH需要医护人员频繁监测相关化验指标,并增加COVID-19暴露的风险,因此更推荐LMWH,但UFH在高出血风险患者,伴有肾功能衰竭的患者或需要进行有创操作的患者中是首选用药。由于重型COVID-19患者大概率会接受其他伴随治疗(如抗病毒治疗或其他研究治疗等),有可能影响口服抗凝药物代谢,增加患者的出血风险及药物不良反应的发生可能,故暂不推荐应用口服抗凝药物。目前尚无研究比较在重型COVID-19患者中应用不同抗凝药物的风险。
3.研究表明即使在常规抗凝治疗的基础上,重症COVID-19患者VTE发生率仍然很高,而增加抗凝预防剂量可以降低D-二聚体等指标,故需ICU治疗的COVID-19患者,若出血风险低,建议考虑适当增加预防抗凝药物剂量。
推荐依据
一项前瞻性COVID-19队列研究连续纳入749例COVID-19患者,收集患者基本信息、实验室检查、治疗、预后并随访28 d,其中78例(10%)患者死亡,186例(25%)患者使用抗凝治疗。多因素回归分析发现早期使用LMWH可能降低患者病死率[479]。一项纳入449例患者的回顾性研究中,94例使用LMWH患者病死率更低[480]。以上研究提示LMWH抗凝治疗可能降低COVID-19患者的病死率,故对于合并内科疾病或外科情况的轻型和普通型COVID-19患者,根据Padua评分或Caprini评分评估为VTE高危或中高危者,以及重型或危重型COVID-19患者,若抗凝无禁忌,建议进行预防抗凝。
一篇纳入12项研究的荟萃分析提示,对于ICU的COVID-19患者,即使在接受了抗凝治疗的情况下,VTE的发病率仍然高达31%。亚组分析发现只接受预防剂量抗凝治疗组VTE的患病率为38%(95%CI:10%~70%),而接受治疗剂量抗凝或者预防剂量抗凝治疗组VTE患病率为27%(95%CI:17%~40%)[481]。这项荟萃分析提示对于ICU的COVID-19患者个体化的抗凝治疗优于一般的预防性抗凝。据此,对需ICU治疗的COVID-19患者,若出血风险低,指南专家组建议考虑适当增加预防抗凝药物剂量。
(翟振国)
推荐意见
1.不推荐COVID-19成人患者常规抗细菌与抗真菌治疗。(4,C)
2.对于重型和危重型COVID-19成人患者,如果有合并呼吸道细菌感染的临床证据,可经验性使用抗细菌治疗;如有细菌感染的病原学证据,应进行目标治疗。(4,C)
3.推荐针对具有真菌感染高危因素的重型和危重型COVID-19患者,积极查找真菌感染证据,密切监测。(5,D)
推荐意见说明
1.目前研究显示COVID-19患者合并细菌感染的比例较低(3.5%~7%),尚无足够的证据支持经验性抗感染治疗的广泛应用。
2.对于重型和危重型COVID-19患者,如果有合并呼吸道细菌感染的临床证据,应当根据临床情况综合判断,合理使用抗菌药物。经验性抗感染治疗应基于患者的临床诊断、结合当地流行病学及细菌耐药情况。如果有下呼吸道标本病原学证据,应进行目标治疗,并根据患者病原学检测结果和临床疗效判定尽早降阶梯治疗。
3.大剂量应用糖皮质激素、长期住ICU、机械通气或免疫抑制等可能增加COVID-19患者继发真菌感染的风险,但目前暂无COVID-19经验性抗真菌治疗的循证医学证据。临床医生需警惕这类患者继发真菌感染的风险,密切监测并及时行病原学检测。
推荐依据
一篇纳入23项临床观察性研究共包含3 338例COVID-19患者的荟萃分析显示,COVID-19合并细菌感染的比例为3.5%(95%CI:0.4%~6.7%),COVID-19继发细菌感染的比例为14.3%(95%CI:9.6%~18.9%),细菌感染在重症患者多见(8.1%,95%CI:2.3%~13.8%),大多数COVID-19患者曾接受抗生素治疗(71.9%,95%CI:56.1%~87.7%),因此该系统性评价认为COVID-19合并细菌感染发生率较低,没有充足的证据支持经验性抗感染治疗的广泛应用[482]。而另一篇纳入30项研究共3 834例COVID-19患者的荟萃分析显示,7%(95%CI:3%~12%)的COVID-19住院患者合并细菌感染,ICU患者合并细菌感染比例更高(14%,95%CI:5%~26%)[483]。该系统评价也认为COVID-19合并或继发细菌感染发生率较低,不支持COVID-19患者常规应用抗菌药物治疗[483]。一篇囊括18项论文的综述显示,8%(62/806)的COVID-19患者被报道住院期间合并细菌或真菌感染,进一步分析显示,尽管缺乏细菌感染的证据,72%(1 450/2 010)患者仍使用了广谱抗生素[484]。一项来自上海公共卫生中心的数据显示,60岁以上COVID-19患者重型和危重型比例接近25%,其中约58%的患者住院期间使用了抗菌治疗[485]。西班牙一项纳入989例COVID-19患者的回顾性研究显示,社区获得性细菌感染并不常见(31/989,3.1%),主要由肺炎链球菌和金黄色葡萄球菌引起;医院获得性细菌感染发生在43例(4.7%)患者中,主要由铜绿假单胞菌和大肠杆菌引起[486]。英国一项纳入836例COVID-19患者的回顾性研究显示,27例(3.2%)患者在入院后5 d内被检出细菌分离株,而在整个住院期间,这一比例上升至51例(6.1%)[487]。综上,目前证据显示COVID-19患者合并或继发细菌感染比例较低,多见于重症患者,故暂不支持广泛的经验性使用抗生素治疗COVID-19。对于重型和危重型成人COVID-19患者,如果有合并呼吸道细菌感染的临床证据,可经验性使用抗细菌治疗。抗菌治疗应基于患者的临床诊断、结合当地流行病学及细菌耐药情况。如有细菌感染的病原学证据,应进行目标治疗。安全性方面,过度使用抗菌药物会增加院内感染以及耐药菌感染风险,也会增加重症/危重症患者早期淋巴细胞下降的风险[488]。对于经验性抗细菌治疗的药物选择、治疗时机、治疗疗程,目前尚无循证医学证据。未来需要更多前瞻性、高质量临床研究去评估和指导COVID-19患者的抗细菌治疗。
另外,大剂量应用糖皮质激素、长期入住ICU、机械通气或免疫抑制等可能增加COVID-19患者继发真菌感染的风险,但目前暂无COVID-19患者经验性抗真菌治疗的循证医学证据。临床医生需警惕这类患者继发真菌感染风险,密切监测并及时行病原学检测,根据患者症状、真菌学证据等临床信息合理应用抗真菌治疗[489]。
(徐金富)
推荐意见
1.重型和危重型COVID-19患者达到病情稳定状态后,推荐进行早期康复干预。(2b,B)
2.对于满足条件的普通型COVID-19患者,推荐进行呼吸康复干预。(5,D)
推荐意见说明
1.重型和危重型COVID-19患者只有在满足以下所有条件后,才能进行早期康复:(1)FiO2≤0.60;(2)SpO2≥90%;(3)呼吸频率≤40次/min;(4)PEEP≤10 cmH2O;(5)收缩压≥90 mmHg且≤180 mmHg;(6)平均动脉压≥65 mmHg且≤110 mmHg;(7)心率≥40 次/min且≤120次/min;(8)无新发的心律失常或心肌缺血;(9)无新发的不稳定的深静脉血栓形成和肺栓塞;(10)无可疑的主动脉缩窄;(11)无严重的肝肾疾病及新出现的或进行性加重的肝、肾功能损害;(12)体温≤38.5 ℃。
2.对于普通型COVID-19患者只有在满足以下所有条件后,才能进行早期康复:(1)心率≥40次/min且≤100次/min;(2)血压90/60 mmHg至140/90 mmHg之间;(3)SpO2≥95%;(4)不存在其他不适合运动的情况。
推荐依据
COVID-19是一种高度传染性的呼吸道疾病,可导致患者呼吸、身体和心理功能障碍[490]。针对不同严重程度和不同时期的COVID-19患者的康复,能帮助这些患者改善呼吸功能、生理和心理状态,以及提高患者的生活质量[490]。
一项纳入16例重型和危重型COVID-19患者住院期间早期康复的研究显示,通过早期康复干预,患者的呼吸困难程度、功能能力、生活质量与正常人的预计值接近,并且没有观察到任何不良安全事件[491]。一项纳入72例出院后老年COVID-19患者的RCT显示,与未进行呼吸康复的对照组相比,经过6周的康复后,FEV1(L)、FVC(L)、FEV1/FVC%、DLCO%、6 min步行试验、SF-36评分改善[492]。对COVID-19患者进行康复的目的是改善呼吸困难症状,缓解焦虑和抑郁,减少并发症,预防和改善功能障碍,减少残疾,最大限度地保护功能,提高生活质量[490]。然而,COVID-19患者的康复介入时机和安全性评估仍缺乏足够的证据。由于对COVID-19的认识不足,已发表的康复建议多以既往的文献为基础,同时考虑与COVID-19相关的一般性症状,如急性后ICU综合征引起的神经肌肉、心理、呼吸系统症状和引起的焦虑等。所有康复干预必须个体化,特别是对有合并症、高龄、肥胖和单器官或多器官并发症的患者,康复团队应该在介入原则的基础上,制定个性化的治疗方案[493]。同时,应对患者在整个呼吸康复过程中进行生命体征监测,以保证患者的安全[494]。
推荐意见
1.推荐在病情允许和保证安全的情况下鼓励患者早期活动(包括有氧、抗阻、呼吸肌训练)。(5,D)
2.推荐住院的COVID-19患者进行早期活动,直到可以安全出院。(5,D)
推荐意见说明
1.可采取形式多样的早期活动。活动内容应根据对患者的个人评估确定,可包括有氧运动、抗阻训练和呼吸肌训练。
2.对于轻型和普通型COVID-19患者,可推荐轻度到中等强度的有氧运动;频率:每日1次,饭后1 h左右开始;根据患者体能状况决定活动时间,可以采取连续或间歇的训练方式(当患者出现疲劳,呼吸困难或虚弱的迹象时),训练强度应该逐渐增加,必要时患者可以在助行器或拐杖支持下活动。抗阻训练推荐强度为:每周训练1~2次,共训练6~8次。每次训练1~4组,每组重复8~15次。每次间隔45 s,运动强度与运动自觉量表(rating of perceived exertion,RPE):4/10~6/10。呼吸肌抗阻训练强度为:每周训练5次,每次重复100次呼吸肌抗阻训练。若患者存在上呼吸道症状,抗阻训练推荐强度为:每周训练1次,共训练4~6次。每次训练1~2组,每组重复6~10次。每次间隔60 s,RPE:3/10。呼吸肌抗阻训练强度为:每周训练5次,每次重复75次呼吸肌抗阻训练。
3.目前,无明确证据表明有氧运动对重症COVID-19成人患者有效。可考虑针对重症COVID-19成人患者进行等长肌力训练,以及呼吸肌抗阻训练。呼吸肌抗阻训练推荐强度为:每周训练5次,每次重复50次呼吸肌抗阻训练。
4.康复训练可能会导致患者出现呼吸困难,这是患者在运动中容量需求增加的自然现象。针对呼吸功能不全的患者,在康复训练过程中应监测呼吸和循环系统参数(心率,血压,脉搏,SpO2),并在必要时对患者进行氧疗。
推荐依据
一项纳入了293例COVID-19患者的回顾性研究提示既往经常进行有氧运动的患者与对照组相比重症发生率较低[495]。一项RCT探讨了有氧运动对急性上呼吸道感染成人患者的影响,该研究纳入了36例急性上呼吸道感染成人患者,结果提示,与对照组相比,有氧运动可以提高机体免疫细胞的活性[496];另一项纳入了154例急性呼吸道感染成人患者的RCT显示,与对照组相比,有氧运动可以缩短症状持续时间、减轻症状的严重程度[497]。对处于疾病重症阶段的患者,有氧运动的影响是不明确的,未见相关文献报道[493]。因此,推荐轻型和普通型COVID-19成人患者进行有氧运动。此外,研究表明抗阻训练也能增强机体的免疫系统,训练强度是最为重要的影响因素[498],但目前尚无关于早期抗阻训练对COVID-19成人患者临床效果的直接证据[499]。
推荐意见
1.不推荐对COVID-19急性期患者常规使用胸部物理治疗技术。(5,D)
2.不推荐对颅内压增高的COVID-19患者使用胸部物理治疗技术。(5,D)
3.对于有渗出和轻度至中度气道痰液潴留的成人COVID-19患者,可以考虑使用胸部物理治疗。(5,D)
推荐意见说明
1.急性期不推荐使用的胸部物理治疗包括:缩唇呼吸,肺扩张技术,激励式肺量计训练,胸廓的手法治疗。
2.对有证据证明因气道痰液潴留引起明显症状的患者,可根据评估的结果选择下列胸部物理治疗手段:咳嗽训练,体位引流,振动拍击等手法技术,高频震荡,呼气正压治疗,徒手过度充气技术,呼吸训练,各种机械/人工辅助排痰技术,但以上技术都有可能产生气溶胶播散的风险。
推荐依据
胸部物理治疗是帮助患者进行气道分泌物清除的有效技术,也是早期呼吸康复干预措施中使用最频繁的技术之一。目前尚无针对胸部物理治疗对COVID-19干预效果的直接证据。一项纳入6项RCT包含434例肺炎患者的系统评价显示常规的胸部物理治疗和呼吸技巧训练不能提高肺炎治愈率和胸部影像学改善率,对病死率也没有影响[500]。因此,不推荐COVID-19成年患者急性期常规使用胸部物理治疗技术。
由于胸部物理治疗技术可能有助于患者恢复气道纤毛功能、改善肺容量和通气血流比、减少肺内分流和降低肺炎进展风险[501],且在囊性纤维化的治疗中,对增加黏液清除方面有明确的短期效果[502],因此,对于经过影像学等客观评估显示有因痰液潴留引起的明显症状的患者,根据临床实际,可以选择进行胸部物理治疗干预[503]。但该技术在治疗的过程中有造成气溶胶播散的风险[504],应该加强防护。此外,因为胸部物理治疗技术存在增加颅内压的风险[505],因此不推荐对已存在颅内压增高的COVID-19患者使用胸部物理治疗技术。
推荐意见
对于出院后仍存在一定程度功能障碍的COVID-19患者,可以考虑出院后进行居家康复训练。(5,D)
推荐意见说明
1.对于COVID-19出院后患者,应对其心肺功能及躯体功能进行针对性评估,如仍存在一定程度的功能障碍,应鼓励患者进行居家康复训练。
2.居家康复训练应在评估的基础上进行,训练方案应个体化设计,如有条件可进行远程康复指导。
3.进行居家康复训练的患者,应每2~4周进行一次随访,并根据随访结果调整居家康复训练方案,随访可采用门诊随访或远程随访的方式。
推荐证据
COVID-19患者在出院后可能会遗留不同程度的功能障碍,如疲劳、呼吸困难等,在重症患者中表现尤为明显[506, 507]。对于遗留功能障碍的出院患者,进行居家康复治疗对于促进功能障碍恢复及改善患者生活质量有重要意义[508]。一项针对老年COVID-19出院后患者的随机对照研究显示,6周的呼吸康复训练可以显著改善患者的呼吸功能、生活质量及焦虑情况[492]。且以往对于ICU后综合征及慢性呼吸系统疾病的研究已经证实居家康复治疗是安全有效的[509, 510, 511]。远程康复计划是居家康复训练的重要辅助手段[512, 513, 514],可提高患者的康复依从性,保障康复训练的质量。在传染性疾病大流行及医疗资源有限的背景下居家康复治疗及配套远程康复计划具有一定的优势,有条件的地区和医院可以考虑开展。
(谢欲晓、赵红梅)
社会防控措施主要指非药物干预措施。非药物干预措施主要包括:交通限制、增加社交距离、个人防护、环境卫生、社会动员、宣传教育等。实施综合性的非药物干预措施可以取得良好防控效果。综合考虑防控效果和经济、社会成本的前提下,可适时调整部分措施。
非药物干预措施(non-pharmaceutical intervention,NPI)是疫苗和抗SARS-CoV-2药物以外的其他公共卫生手段,以减缓或阻断传染病大流行的传播[515, 516]。NPI通常包括:个人防护措施(如手卫生、呼吸礼仪)、环境措施(如表面和物体清洁,以及其他环境措施)、增加社交距离(如病例隔离、停课/关闭学校、取消集会等)、交通限制(如边境筛查、旅行限制、区域内交通限制、区域间交通限制等)、公众宣传和健康教育等[517, 518, 519]。
综合性非药物干预措施,对于控制疫情蔓延具有良好效果[520, 521, 522]。降低传播的最有效策略是减少与感染者的接触,从而减少病毒传播、降低健康损害、缩短流行时间、降低疫情高峰期对医疗资源的需求、维持医疗服务运行。其中增加社交距离措施(如病例隔离和密切接触者追踪、停课/关闭学校、取消集会等)、交通限制(如边境筛查、旅行限制等)对社会秩序、经济发展会产生巨大影响,因此需要权衡措施实施的成本与其潜在影响。出行限制可推迟感染的发生,但由于各种原因接受度低[523, 524]。
综合COVID-19、流感及其他呼吸道传染病的社会防控经验,根据疾病流行严重程度和重点场景的防控要点,分别给出不同的非药物干预措施组合实施建议(表2)。
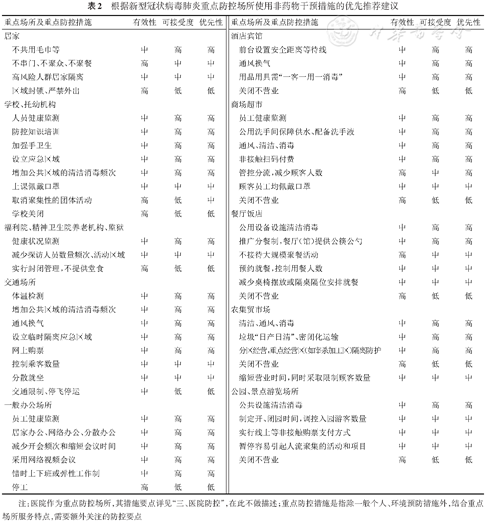
根据新型冠状病毒肺炎重点防控场所使用非药物干预措施的优先推荐建议
根据新型冠状病毒肺炎重点防控场所使用非药物干预措施的优先推荐建议
| 重点场所及重点防控措施 | 有效性 | 可接受度 | 优先性 | 重点场所及重点防控措施 | 有效性 | 可接受度 | 优先性 | |
| 居家 | 酒店宾馆 | |||||||
不共用毛巾等 | 中 | 高 | 高 | 前台设置安全距离等待线 | 中 | 高 | 高 | |
不串门、不聚众、不聚餐 | 高 | 中 | 中 | 通风换气 | 中 | 高 | 高 | |
高风险人群居家隔离 | 中 | 中 | 中 | 用品用具需“一客一用一消毒” | 中 | 高 | 高 | |
区域封锁、严禁外出 | 高 | 低 | 低 | 关闭不营业 | 高 | 低 | 低 | |
| 学校、托幼机构 | 商场超市 | |||||||
人员健康监测 | 中 | 高 | 高 | 员工健康监测 | 中 | 高 | 高 | |
防控知识培训 | 中 | 高 | 高 | 公用洗手间保障供水、配备洗手液 | 中 | 高 | 高 | |
加强手卫生 | 中 | 高 | 高 | 通风、清洁、消毒 | 中 | 高 | 高 | |
设立应急区域 | 中 | 高 | 高 | 非接触扫码付费 | 中 | 高 | 高 | |
增加公共区域的清洁消毒频次 | 中 | 高 | 高 | 管控分流,减少顾客人数 | 高 | 中 | 高 | |
上课佩戴口罩 | 中 | 中 | 中 | 顾客员工均佩戴口罩 | 中 | 中 | 中 | |
取消聚集性的团体活动 | 高 | 低 | 中 | 关闭不营业 | 高 | 低 | 低 | |
学校关闭 | 高 | 低 | 低 | 餐厅饭店 | ||||
| 福利院、精神卫生院养老机构、监狱 | 公用设备设施清洁消毒 | 中 | 高 | 高 | ||||
健康状况监测 | 中 | 高 | 高 | 推广分餐制,餐厅(馆)提供公筷公勺 | 中 | 高 | 高 | |
减少探访人员数量频次、活动区域 | 中 | 中 | 中 | 不接待大规模聚餐活动 | 高 | 中 | 中 | |
实行封闭管理,不提供堂食 | 高 | 低 | 低 | 预约就餐,控制用餐人数 | 中 | 中 | 中 | |
| 交通场所 | 减少桌椅摆放或隔桌隔位安排就餐 | 中 | 中 | 中 | ||||
体温检测 | 中 | 高 | 高 | 关闭不营业 | 高 | 低 | 低 | |
增加公共区域的清洁消毒频次 | 中 | 高 | 高 | 农集贸市场 | ||||
通风换气 | 中 | 高 | 高 | 清洁、通风、消毒 | 中 | 高 | 高 | |
设立临时隔离应急区域 | 中 | 高 | 高 | 垃圾“日产日清”、密闭化运输 | 中 | 高 | 高 | |
网上购票 | 中 | 高 | 高 | 分区经营,重点经营区(如宰杀加工区)隔离防护 | 中 | 高 | 高 | |
控制乘客数量 | 中 | 中 | 中 | 关闭不营业 | 高 | 低 | 低 | |
分散就坐 | 中 | 中 | 中 | 缩短营业时间,同时采取限制顾客数量 | 中 | 中 | 中 | |
交通限制、停飞停运 | 中 | 低 | 低 | 公园、景点游览场所 | ||||
一般办公场所 | 公共设施清洁消毒 | 中 | 高 | 高 | ||||
员工健康监测 | 中 | 高 | 高 | 制定开、闭园时间,调控入园游客数量 | 中 | 中 | 中 | |
居家办公、网络办公、分散办公 | 中 | 高 | 高 | 实行线上等非接触购票支付方式 | 中 | 中 | 中 | |
减少开会频次和缩短会议时间 | 中 | 高 | 高 | 暂停容易引起人流聚集的活动和项目 | 中 | 中 | 中 | |
采用网络视频会议 | 中 | 高 | 高 | 关闭不营业 | 高 | 低 | 低 | |
错时上下班或弹性工作制 | 中 | 高 | 高 | |||||
停工 | 高 | 低 | 低 |
注:医院作为重点防控场所,其措施要点详见“三、医院防控”,在此不做描述;重点防控措施是指除一般个人、环境预防措施外,结合重点场所服务特点,需要额外关注的防控要点
1.疫情早期单一地区疾病暴发:以彻底阻断疾病传播为目的的区域内严格管控措施。包括增加社交距离、区域间交通管制、病例的发现与管理等综合社会防控措施,加强个人防护。区域内医疗资源超负荷时,可建立方舱庇护医院满足大量轻症病例的基本医疗和生活需求,减少轻症转重症[525],但上述防控措施的实施可能对人民生活和社会生产造成较大影响。
2.疫情在多地出现暴发和持续传播:以降低疾病在人群中的流行水平或切断社区持续传播为目的,将有效再生数(effective reproductive number,Rt)控制在1以下。主要措施为增加社交距离,环境消毒和个人防护,积极发现、追踪和隔离病例,但不对边境实施严格的封锁。
3.多地出现广泛持续社区传播:社会防控以减轻医疗系统的救治压力为目的,降低死亡。措施要点是及时诊断并隔离治疗COVID-19病例,关注脆弱人群、重点岗位人群,维持基本经济活动,保证社会秩序的正常运转,降低对经济和生活影响。
4.境外输入防控:国外疫情形势严峻时,强化国内病例和疫情的监测预警灵敏度,提高及时发现病例能力,实时评估输入风险水平,动态调整边境管控措施,必要时需对相关国家和地区采取旅行和贸易限制。
由于病毒和疾病特点,SARS-CoV-2可能在人类中长期存在。在确保防控效果的前提下,应该适时调整部分防控措施,譬如采用推广新技术新方法,逐步替代一些成本代价较高、对社会生活影响较大的措施,做好常态化防控的准备。
(冯录召、杨维中)
1.实行社区网格化管理,全面落实属地、部门、单位、个人的四方责任,对从事高风险行业人群及社区内高风险人群的闭环管理,落实各项具体疫情防控措施。
2.根据疫情严重程度,实施精准的社区封控管理,开展风险人群核酸检查,并运用大数据等手段进行病例追踪和密切接触者调查。
3.对确诊病例、疑似病例、密切接触者等人群实施非居家的隔离治疗或医学观察,并规范设置集中医学观察隔离点,做好感染控制工作。
4.疫情期间做好社区内重点场所、重点部位的环境清洁与消毒,加强人员培训,科学规范使用消毒设备及消毒剂。
5.宣传落实社区居民个人防控措施,并提供必要的心理支持和干预。
社区网格化管理将社区划分成一个个小的单元,全面落实属地、部门、单位、个人的四方责任,对于实施地毯式排查、高风险人群闭环管理、特殊人群生活服务保障,以及落实各项疫情防控措施等方面发挥着重要作用[526, 527, 528]。
根据疫情严重程度,采取精准的、限定范围的社区封控管理,能有效地遏制疫情的蔓延,并最大限度减少对社会和经济发展的影响[527,529]。当出现散发或聚集性疫情时,应基于疫情播散范围评估结果,以街道为单位进行精准封控管理,避免扩大化;在连续14 d未出现本土病例后,可经专家研判后进行社区解封。欧洲多个国家也采取了不同程度的封控措施,包括关闭国门、关闭学校、病例自我隔离、禁止聚集活动等措施[530]。封控措施能够减少发病和死亡的数量[531]。另一项在武汉的回顾性队列研究,发现包括社区封控管理在内的多举措公共卫生措施有效促进了疫情的控制[532]。核酸检测是诊断COVID-19的重要手段,特别是早期发现同样具有传染性的无症状感染者[519]。出现疫情时,应组织开展高风险人群或全员核酸检查,以评估疫情播散范围,实现病例早发现和控制传染源。可采用核酸混检策略以提高筛查效率[533]。在常态化疫情防控下,还应对口岸和冷链相关从业人员等高风险人群开展定期核酸检查。
在使用传统手段进行病例追踪和密切接触者筛查的同时,应充分利用大数据等科技手段提高追踪和调查的效率[534, 535, 536]。一项系统评价研究了数字化接触者追踪技术在疫情中发挥的作用[536],其中两项模型研究发现数字化接触者追踪并自我隔离可减少二代感染的数量,但没有采用人工接触者追踪并自我隔离方法减少得多;在两项暴发疫情的研究中,数字化接触者追踪能够发现更多的密切接触者,并提高工作效率。但数字化手段会受网络覆盖、缺少数据和较高的人员培训需求等影响。大数据行动轨迹排查能提高流行病学调查的效率与质量,而高质量的流行病学调查是开展精准社区防控的基础。因此,应在传统人工调查的基础上,充分利用信息化手段开展病例追踪和密切接触者调查。
对确诊病例、疑似病例、密切接触者等人群应实施非居家的隔离治疗或医学观察,以减少家庭内和社区内的传播,武汉方舱医院和集中医学隔离观察点的成功实施有效地减少了疫情的社区传播[525,537]。集中医学隔离观察点应规范合理设置,满足感染控制的要求[538]。
接触SARS-CoV-2污染的物品也是造成疾病传播的一种途径[519]。SARS-CoV-2在寒冷低温条件下可以存活更久。因此,感染疫情期间应做好社区内重点场所、重点部位的环境清洁与消毒,切断社区接触传播的途径。此外,应加强人员培训,科学规范使用消毒设备及消毒剂,避免不正确的认知和信息带来健康和环境危害[539]。
一项系统评价研究了保持距离、佩戴口罩和护眼装置对于预防SARS-CoV-2人际传播的效果,该研究发现保持社交距离的保护效果随着距离的增加而增加;佩戴口罩可以大幅降低感染风险,N95及类似口罩比一次性外科口罩或类似口罩的相关性更强;使用护眼装置同样能降低感染可能[540]。上述研究由于一致性很差,且具有较高的偏倚风险,因此不能提供高确定性的证据,但作为简便易行且理论上可以阻断呼吸道病毒在人际传播的物理措施,仍应被广泛采纳推荐,如居家通风、手卫生、遵守咳嗽礼仪、密闭聚集场所佩戴医用口罩、保持安全社交距离等,尤其是在疫情流行地区。同时,应开展多渠道宣传,以确保社区居民能够接收到正确的信息。
COVID-19流行会给各类人群带来多种心理健康问题,包括创伤后应激障碍、焦虑、抑郁等[541, 542, 543],系统评价发现这些心理问题的发生率以COVID-19患者为最高,医务工作者和一般人群次之[542]。应为社区居民提供必要的心理支持和干预,尤其要关注COVID-19患者(治疗过程中和康复后)及家属,以及处于社区封控期间的儿童、青少年、老年人、孕产妇等重点人群。
(张灿有、吴浩)
1.医疗机构需建立机构内COVID-19感染防控的管理组织,以落实感染防控的管理职能。
2.开展包括医务人员、工勤人员等在内的各类人员的全员培训,培训应根据其工作职责和岗位特点进行。
3.落实COVID-19感染预防与控制措施:
(1)开展患者、工作人员与陪护人员感染的监测。
(2)管理传染源:包括预检、分诊、合理安置患者、尽早识别疑似/确诊的COVID-19患者;加强人员管理与感染暴发的应急管理。
(3)切断传播途径:在标准预防的基础上完善接触隔离、飞沫隔离与必要时空气隔离相关措施。
(4)保护易感人群:包括正确选择和使用个人防护用品(PPE),加强工作人员和进入医疗机构人员的管理。
医疗机构应建立机构内COVID-19的管理组织,落实以下感染管理职能[544, 545, 546, 547],主要包括:
(1)按照国家相应法规制定机构内感染防控的制度,制定应急预案、严格执行,并定期更新。
(2)完善感染监测体系,做到明确职责、信息化管理并及时分析总结。
(3)定期对医疗机构的工作场所进行风险评估,并根据感染风险的高低实施相应的防控措施。
(4)加强患者、陪护和探视人员的管理,减少门急诊患者聚集;住院患者原则上不设陪护;机构内应设过渡病区或过渡病室,为疑有COVID-19症状的患者提供单独隔离、治疗区域,疑似及确诊COVD-19患者应及时转运至定点医疗机构;严格探视者管理。
(5)提供、协调感染防控所需人员与物资,包括保障机构内COVID-19的实验室检测能力、建筑布局符合感染防控的要求。
开展机构内包括医务人员、工勤人员在内的全员培训。应根据不同人员的岗位需要和工作职责,开展有针对性的COVID-19感染防控知识、方法与技能(包括职业暴露处置知识与技能)的培训与考核,并做好相应的记录,做到上岗前达到熟练掌握。
落实COVID-19预防与控制措施,主要包括开展患者、工作人员与陪护人员感染的监测、管理传染源、切断传播途径和保护易感人群。
1.开展患者、工作人员与陪护人员感染的监测:医疗机构应按法规要求持续监测、及时上报疑似或确诊的COVID-19患者,做好相应处置工作,做好早期预警预报[546]。
2.管理传染源:加强预检分诊,做到四早,即早发现、早报告、早隔离、早治疗,早发现是关键[544, 545, 548]。
(1)加强人员管理:医疗机构应对进入机构内的患者、陪护人员和探视人员进行健康宣教和提供感染防控物资与设施[546, 548]。进入机构内的人员均应佩戴医用口罩或医用外科口罩。
落实择期入院患者的SARS-CoV-2核酸检测,核酸检测阴性方可收入院,否则应被安置于过渡病区或过渡病室,及时采样完成核酸检测。
(2)探视人员管理[545]:原则上不探视。推荐无接触探视方式;严格陪护的管控。
(3)疑似/确诊患者管理:对于疑似或确诊COVID-19的患者,应集中收治。疑似与确诊COVID-19患者分开收治。疑似患者应单间安置,确诊患者可多人间安置,床间距应>1.1 m,隔离安置疑似患者的房间应配备独立卫生间和相关设施。若条件允许,患者可安置在负压病房内[544, 548]。限制患者活动范围,减少转运和外出[548]。如患者确需转运和外出时,在到达/转诊前需尽早将必要的预防措施告知接受区域的工作人员,提早准备[545]。患者出院或死亡后,应对病室进行彻底的终末消毒[548]。
疑似或确诊患者死亡,应对尸体及时进行处理。患者住院期间使用的个人物品经消毒后方可随患者或家属带回家[546]。处理前后需进行手卫生;评估处理时的风险选择合适个人防护用品(personal protective equipment,PPE);正确处理使用后的PPE[545]。
3.切断传播途径:COVID-19的预防应在标准预防基础上,采取接触隔离、飞沫隔离与必要时空气隔离的防控措施。
疑似/确诊COVID-19患者应采取集中收治,收治病区的建筑布局应符合三区两通道的要求,包括医务人员在内的工作人员在进入疑似/确诊COVID-19患者的病区前,应进行手卫生,按照工作人员的防护要求,在规定的区域内穿戴相应的防护用品后进入患者区域,诊疗结束后,应在指定的区域,按照规范的流程脱摘相应的防护用品。进入患者诊疗区医务人员应佩戴医用防护口罩、帽子、护目镜或防护面屏,穿隔离衣或防护服,戴手套和穿鞋套,当从事有喷溅的诊疗操作,如采集诊断性呼吸道标本、气管插管、开放式吸痰、插管前的手动通气、无创呼吸机正压通气、气管切开术、心肺复苏、支气管镜检查等时应穿防护服,有条件时可戴正压头套[540, 549]。
医疗机构应按照《医务人员手卫生规范》的要求配备合格、方便可及的手卫生设施,医务人员在诊疗工作中应严格遵循《医务人员手卫生规范》、《医疗机构消毒技术规范》、《医疗废物管理条例》及其配套文件和COVID-19疫情防控颁布的文件要求开展防护工作,并做好诊疗环境的清洁消毒以及正确处置医疗废物。
4.保护易感人群:参与COVID-19疑似/确诊患者的诊疗医务人员人数限制至诊疗必需的人数,以降低暴露风险[547]。建议医务人员和可能接触疑似/确诊患者的其他工作人员接种COVID-19疫苗。
职业暴露处置:应开展工作人员健康和职业暴露监测,对疑似/确诊患者提供诊疗服务的工作人员应每日监测体温和症状,并做好记录。对出现发热或者任何COVID-19相关症状者应及时进行排查。工作人员发生职业暴露后应立即离岗,由专家组进行暴露风险的评估,并根据评估结果采取相应的措施(如隔离观察14 d等),同时完善包括SARS-CoV-2核酸检测在内的病原学检测[544, 550]。
(路简羽、李六亿)
1.目前临床试验结果显示多数进入临床试验的疫苗免疫原性和安全性表现良好;部分Ⅲ期临床试验中期分析结果显示疫苗保护效果符合预期。
2.部分临床试验结果显示SARS-CoV-2抗体至少能持续6个月,疫苗长期的保护效果有待更多临床试验结果的收集和公布。
3.目前,我国已启动重点人群接种免疫策略,所有公民免费接种COVID-19疫苗。
疫苗被认为是控制传染病最符合卫生经济学效益的措施[551]。COVID-19疫情出现后,国内和国际上多家研发单位启动COVID-19疫苗的研发。根据WHO统计,目前全球正在从10种不同种类的技术平台开展COVID-19疫苗的研发,分别为灭活疫苗、非复制型载体疫苗、复制型载体疫苗、减毒活疫苗、DNA疫苗、RNA疫苗、蛋白亚单位疫苗、病毒样颗粒(virus-like particle,VLP)疫苗、复制型载体联合抗原呈递细胞研发的疫苗和非复制型载体联合抗原呈递细胞研发的疫苗。
根据WHO统计,截至2021年1月6日,目前全球共有63个候选疫苗进入临床试验,172个候选疫苗处于临床前阶段[552]。进入临床试验的疫苗中有21个候选疫苗进入Ⅱ/Ⅲ期或Ⅲ期临床试验,5个候选疫苗处于Ⅱ期临床试验阶段,18个候选疫苗处于Ⅰ/Ⅱ期临床试验阶段,19个候选疫苗处于Ⅰ期临床试验阶段。中国有12个候选疫苗进入临床试验阶段,包括5个灭活疫苗、3个病毒载体疫苗、3个亚单位疫苗和1个RNA疫苗。其中有5个疫苗进入Ⅲ期临床试验阶段,1个疫苗在阿联酋获得上市审批[553],目前已经进入Ⅲ期临床试验的疫苗信息见下表3。不同技术路线疫苗研发的特点见表4[554]。
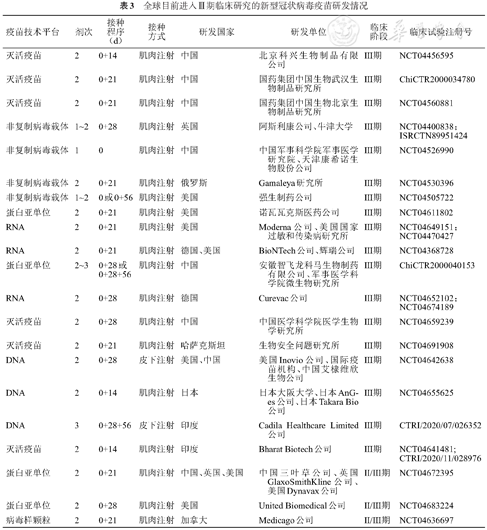
全球目前进入Ⅲ期临床研究的新型冠状病毒疫苗研发情况
全球目前进入Ⅲ期临床研究的新型冠状病毒疫苗研发情况
| 疫苗技术平台 | 剂次 | 接种 程序 (d) | 接种 方式 | 研发国家 | 研发单位 | 临床 阶段 | 临床试验注册号 |
|---|---|---|---|---|---|---|---|
| 灭活疫苗 | 2 | 0+14 | 肌肉注射 | 中国 | 北京科兴生物制品有限公司 | Ⅲ期 | NCT04456595 |
| 灭活疫苗 | 2 | 0+21 | 肌肉注射 | 中国 | 国药集团中国生物武汉生物制品研究所 | Ⅲ期 | ChiCTR2000034780 |
| 灭活疫苗 | 2 | 0+21 | 肌肉注射 | 中国 | 国药集团中国生物北京生物制品研究所 | Ⅲ期 | NCT04560881 |
| 非复制病毒载体 | 1~2 | 0+28 | 肌肉注射 | 英国 | 阿斯利康公司、牛津大学 | Ⅲ期 | NCT04400838;ISRCTN89951424 |
| 非复制病毒载体 | 1 | 0 | 肌肉注射 | 中国 | 中国军事科学院军事医学研究院、天津康希诺生物股份公司 | Ⅲ期 | NCT04526990 |
| 非复制病毒载体 | 2 | 0+21 | 肌肉注射 | 俄罗斯 | Gamaleya研究所 | Ⅲ期 | NCT04530396 |
| 非复制病毒载体 | 1~2 | 0或0+56 | 肌肉注射 | 美国 | 强生制药公司 | Ⅲ期 | NCT04505722 |
| 蛋白亚单位 | 2 | 0+28 | 肌肉注射 | 美国 | 诺瓦瓦克斯医药公司 | Ⅲ期 | NCT04611802 |
| RNA | 2 | 0+21 | 肌肉注射 | 美国 | Moderna公司、美国国家过敏和传染病研究所 | Ⅲ期 | NCT04649151;NCT04470427 |
| RNA | 2 | 0+21 | 肌肉注射 | 德国、美国 | BioNTech公司、辉瑞公司 | Ⅲ期 | NCT04368728 |
| 蛋白亚单位 | 2~3 | 0+28或 0+28+56 | 肌肉注射 | 中国 | 安徽智飞龙科马生物制药有限公司、军事医学科学院微生物研究所 | Ⅲ期 | ChiCTR2000040153 |
| RNA | 2 | 0+28 | 肌肉注射 | 德国 | Curevac公司 | Ⅲ期 | NCT04652102;NCT04674189 |
| 灭活疫苗 | 2 | 0+28 | 肌肉注射 | 中国 | 中国医学科学院医学生物学研究所 | Ⅲ期 | NCT04659239 |
| 灭活疫苗 | 2 | 0+21 | 肌肉注射 | 哈萨克斯坦 | 生物安全问题研究所 | Ⅲ期 | NCT04691908 |
| DNA | 2 | 0+28 | 皮下注射 | 美国、中国 | 美国Inovio公司、国际疫苗机构、中国艾棣维欣生物公司 | Ⅲ期 | NCT04642638 |
| DNA | 2 | 0+14 | 肌肉注射 | 日本 | 日本大阪大学、日本AnGes公司、日本Takara Bio公司 | Ⅲ期 | NCT04655625 |
| DNA | 3 | 0+28+56 | 皮下注射 | 印度 | Cadila Healthcare Limited公司 | Ⅲ期 | CTRI/2020/07/026352 |
| 灭活疫苗 | 2 | 0+14 | 肌肉注射 | 印度 | Bharat Biotech公司 | Ⅲ期 | NCT04641481; CTRI/2020/11/028976 |
| 蛋白亚单位 | 2 | 0+21 | 肌肉注射 | 中国、英国、美国 | 中国三叶草公司、英国GlaxoSmithKline公司、美国Dynavax公司 | Ⅱ/Ⅲ期 | NCT04672395 |
| 蛋白亚单位 | 2 | 0+28 | 肌肉注射 | 美国 | United Biomedical公司 | Ⅱ/Ⅲ期 | NCT04683224 |
| 病毒样颗粒 | 2 | 0+21 | 肌肉注射 | 加拿大 | Medicago公司 | Ⅱ/Ⅲ期 | NCT04636697 |
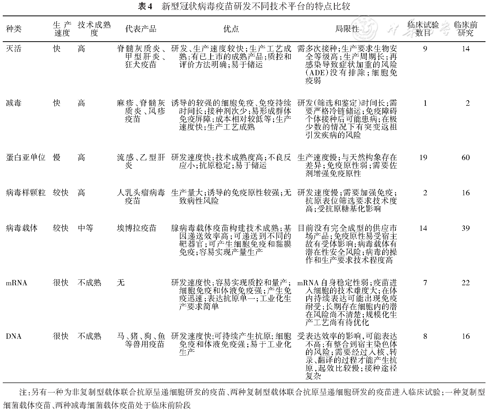
新型冠状病毒疫苗研发不同技术平台的特点比较
新型冠状病毒疫苗研发不同技术平台的特点比较
| 种类 | 生产速度 | 技术成熟度 | 代表产品 | 优点 | 局限性 | 临床试验数目 | 临床前研究 |
|---|---|---|---|---|---|---|---|
| 灭活 | 快 | 高 | 脊髓灰质炎、甲型肝炎、狂犬疫苗 | 研发、生产速度较快;生产工艺成熟;有已上市的成熟产品;质控和评价方法明确;易于储运 | 需多次接种;生产要求生物安全等级高;生产周期长;再感染导致症状加重的风险(ADE)没有排除;细胞免疫弱 | 9 | 14 |
| 减毒 | 快 | 高 | 麻疹、脊髓灰质炎、风疹疫苗 | 诱导的较强的细胞免疫、免疫持续时间长;接种剂次少;易形成群体免疫屏障;成本相对较低等;生产速度快;生产工艺成熟 | 研发(筛选和鉴定)时间长;需要严格冷链储运;免疫障碍个体接种后可能患病;在极少数的情况下有突变返祖引发疾病的风险 | 1 | 2 |
| 蛋白亚单位 | 慢 | 高 | 流感、乙型肝炎 | 研发速度快;技术成熟度高;不良反应小;抗原稳定;易于储运 | 生产速度慢;与天然构象存在差异;免疫原性弱;需要佐剂增强免疫原性 | 19 | 60 |
| 病毒样颗粒 | 较快 | 高 | 人乳头瘤病毒疫苗 | 生产量大;诱导的免疫原性较强;无致病性风险 | 研发速度慢;需要加强免疫;抗原表位筛选要求技术度高;受抗原糖基化影响 | 2 | 16 |
| 病毒载体 | 较快 | 中等 | 埃博拉疫苗 | 腺病毒载体疫苗构建技术成熟;基因递送效率高;可递送到不同的靶器官;可产生细胞免疫和黏膜免疫;容易实现产量生产 | 目前没有完全成型的供应市场产品;免疫原性易受宿主故有受体影响;病毒载体有潜在性安全风险;病毒的操作和生产要求技术程度高 | 14 | 39 |
| mRNA | 很快 | 不成熟 | 无 | 研发速度快;容易实现质控和量产;细胞免疫和体液免疫强;产生免疫迅速;表达抗原单一;工业化生产要求简单 | mRNA自身稳定性弱;疫苗进入细胞的技术难度大;在体内持续表达可能出现免疫耐受;长期存在细胞内的潜在风险尚不清楚;规模化生产工艺尚有待优化 | 7 | 22 |
| DNA | 很快 | 不成熟 | 马、猪、狗、鱼等兽用疫苗 | 研发速度快;可持续产生抗原; 细胞免疫和体液免疫强;易于工业化生产 | 受表达效率的影响,可能表达不高;有整合到宿主染色体的风险;需要经过入核、转录、翻译的过程才能产生抗原,起效比较慢;接种途径复杂 | 8 | 16 |
注:另有一种为非复制型载体联合抗原呈递细胞研发的疫苗、两种复制型载体联合抗原呈递细胞研发的疫苗进入临床试验;一种复制型细菌载体疫苗、两种减毒细菌载体疫苗处于临床前阶段
目前已经揭盲的Ⅲ期结果显示,截至2020年10月下旬,Moderna公司研发的mRNA疫苗已经完成Ⅲ期临床试验中的30 000余人入组。基于196例病例的中期分析结果显示,安慰剂组发生185例病例,疫苗组发生11例病例,疫苗保护效果的点估计值是94.1%(95%CI:89.3%~96.8%)[555]。其中有30例重症病例,均发生在安慰剂组。安全性的结果方面,大多数不良反应均为轻度和中度。辉瑞和BioNTech发表了COVID-19疫苗Ⅲ期临床研究结果[556],它们联合研发的mRNA疫苗的Ⅲ期临床试验已经完成43 548名受试者入组。试验组共发生8例病例,安慰剂组发生162例病例,第二剂次疫苗接种7 d后,疫苗保护效果的点估计值为95%(95%CI:90.3%~97.6%);累计发生10例重症病例,9例发生在安慰剂组,1例发生在试验组。阿斯利康和牛津大学合作研发的病毒载体疫苗Ⅲ期临床试验结果已发表[557],该研究共完成23 848名受试者入组,其中11 636名受试者被纳入到本次数据的分析。按照第一种程序(第一剂次接种一半含量抗原,第二剂次接种完整含量抗原,两针至少间隔1个月,n=2 741)接种后,最后一剂次疫苗接种14 d后,疫苗保护效果的点估计值为90.0%(95%CI:67.4%~97.0%)(试验组发生3例病例,对照组发生30例病例)。按照第二种程序(2剂次完整含量抗原,间隔至少1个月,n=8 895)接种后,最后一剂次疫苗接种14 d后,疫苗保护效果的点估计值为62.1%(95%CI:41.0%~75.7%)(试验组发生27例病例,对照组发生71例病例);两种程序合并分析后,疫苗保护效果的点估计值为70.4%(95%CI:54.8%~80.6%)。俄罗斯Gamaleya研究所研发的病毒载体疫苗Ⅲ期临床试验对纳入的21 977名成人进行中期分析,结果显示,在接种第一剂次疫苗21 d后,疫苗保护效果的点估计值为91.6% (95% CI:85.6%~95.2%)[558]。
随着COVID-19疫苗的研发进展,不同国家对疫苗的使用策略进行了不同的部署。中国于2020年7月22日正式启动了COVID-19疫苗的紧急使用[559]。英国于2020年12月2日批准COVID-19疫苗上市[560]。随后巴林、加拿大、沙特阿拉伯和墨西哥也批准通过了COVID-19疫苗的紧急授权使用[561]。阿联酋于2020年12月9日批准了COVID-19疫苗的上市许可[553]。美国也于2020年12月11日批准了COVID-19疫苗的紧急授权使用[562]。12月30日,国家药品监督管理局附条件批准COVID-19疫苗注册申请。
关于COVID-19疫苗的免疫接种策略,WHO发布了《国家制定COVID-19疫苗使用和接种机会的指南》来指导不同国家制定适合本国的免疫接种策略[563]。该文件中指出制定本国免疫策略的目标人群时需要遵守6个原则:人道主义、全球平等、互惠、同等尊重、国家平等、合法性。各个国家需要由国家免疫规划咨询委员会或技术工作组来领导本国优先接种目标人群和免疫策略的选择和制定。根据WHO的指南建议,第一阶段是覆盖所有参与国家的全人群3%接种率,期望优先接种医务工作者;然后再额外考虑17%接种率,期望优先考虑老年人和健康状况低下的人群。第二阶段逐步增加接种率,WHO根据各个国家的风险等级,同时考虑人道主义原则来增加对各个国家的疫苗供应量。
我国COVID-19疫情形势与国外不同,疫苗使用策略也不一样。COVID-19疫苗接种的主要策略需要结合国内疫情形势和防控工作目标来考虑。我国COVID-19疫苗的免疫策略已由紧急使用转向在重点人群接种。重点人群接种疫苗的意义,一方面是对这部分人群起到保护作用,另一方面有利于“外防输入、内防反弹”,有利于我国总体疫情防控。目前任务是把重点人群接种完成到位。后续我国会根据COVID-19的流行特征、疫苗的安全性和有效性、疫苗供应情况、疫情防控的目的,不断完善免疫策略,有序安排各类人群的接种。疫情的最终控制,依赖于人群建立免疫屏障,即最终多数人完成疫苗接种。目前我国从人群感染风险、疫情防控目的等角度出发制订了优先接种重点人群的策略,建议属于疫苗接种重点人群的个人应接尽接。
根据国家免疫策略,关于重点人群接种的建议如下:
1.重点人群界定:现阶段COVID-19疫苗接种的重点人群主要包括从事进口冷链、口岸检疫、船舶引航、航空空勤、生鲜市场、公共交通、医疗疾控等感染风险比较高的行业人员;前往中高风险国家或者地区工作、学习等人员。
2.疫苗及免疫程序:目前我国重点人群接种的COVID-19疫苗均为灭活疫苗,全程需要接种两剂次,间隔2~4周,疫苗的使用在接种指南或接种方案出台前,以说明书为准。
3.疫苗接种的禁忌症:现阶段COVID-19疫苗的接种禁忌症以说明书为准。通常接种疫苗的禁忌症包括:(1)对疫苗或疫苗成分过敏者;(2)患急性疾病者;(3)处于慢性疾病的急性发作期者;(4)正在发热者;(5)妊娠期女性。
4.疫苗接种场所:COVID-19疫苗的接种都是在当地卫生健康行政部门批准的接种单位进行。通常接种单位设在辖区的卫生服务中心、乡镇卫生院或者综合医院。如果接种涉及到一些重点对象比较集中的部门或企业,当地也会根据情况设立一些临时接种单位。
5.疫苗接种的注意事项:疫苗接种前,应提前了解COVID-19疫苗相关的知识及接种流程。接种时需携带相关证件,并根据当地防控要求,做好个人防护,配合现场预防接种工作人员询问,如实提供本人健康状况和接种紧急等信息。接种后需留观30 min;保持接种部位皮肤的清洁,避免用手搔抓接种部位;如发生疑似不良反应,报告接种单位,需要时及时就医。
6.接种后的免疫效果:任何一种疫苗接种后都不能保证100%的保护效果,根据前期灭活疫苗临床试验研究结果,接种第二剂次灭活疫苗大约两周后,接种人群可以产生较好的免疫效果。
7.其他事项:在人群没有建立免疫屏障之前,不管是未接种疫苗的个人,还是已接种疫苗的个人防护均不能放松,戴口罩、勤洗手、多通风、保持社交距离、尽量避免去人群密集场所、出现发热及时去发热门诊就医,同时,也要积极配合管理和技术部门有关COVID-19疫情防控的要求。
COVID-19疫情全球流行以来,各个国家和地区积极开展了多维度、综合性的疫情防控措施。尤其是COVID-19疫苗的研发,规模之大,技术平台种类之多,研发速度之快均属前所未有。随着Ⅲ期临床试验的开展和中期结果的公布,人们对COVID-19疫苗的信心也越来越大,部分国家已经率先审批上市了部分疫苗,也有部分国家已经批准COVID-19疫苗的紧急授权使用,这将会有助于全球疫情防控。但是疫苗在防控疫情中发挥作用,需要依赖于疫苗的安全性和有效性,也需要依赖于科学有效的免疫策略,更需要依赖于足够的疫苗接种率。Bartsch基于SARS-CoV-2的R0为2.5~3.5的假设,通过模型的方式估算,在只采用疫苗接种这一种干预措施的前提下,如果疫苗的有效率为60%,那么需要保证疫苗接种率达到100%才能有效控制COVID-19疫情[564]。在SARS-CoV-2的R0为2.5的假设下,如果疫苗的保护效力为70%,则需要保证至少75%的疫苗接种率;如果疫苗保护效力为80%,则需要保证60%的接种率[564]。在SARS-CoV-2的R0为3.5的假设下,如果COVID-19疫苗保护效果为80%,需要保证75%的疫苗接种率才能有效阻断SARS-CoV-2传播。所以,如果单纯地依靠疫苗接种措施来阻断COVID-19流行,需要保证至少70%的疫苗保护效力和至少80%的疫苗接种率[564]。这需要科学研发和评估疫苗质量、合理制定COVID-19疫苗接种的免疫策略、有效地组织宣传教育提升公众对疫苗的认知和信心。全民范围内疫苗接种率达到80%以上是非常艰巨的挑战,COVID-19疫情防控绝不能单独依赖疫苗接种这一种防控措施,需要多种措施并行实施、多个维度共同干预、多个国家地区协调合作,在全球范围内阻断SARS-CoV-2的传播。
(宋全伟、王华庆)
1.受体、辅受体。
2.病毒的动物溯源。
3.变异病毒的传播力、毒力、耐药性。
1.SARS-CoV-2导致靶细胞、靶器官损伤的机制。
2.SARS-CoV-2感染后淋巴细胞减低的机制及意义。
3.SARS-CoV-2感染导致病毒性感染中毒症机制。
1.SARS-CoV-2无症状感染者的比例及传染性。
2.COVID-19的病死率。
3.COVID-19患者再感染比例、危险因素,病毒变异对再感染的影响。
1.变异病毒感染的病情严重程度与临床表现。
2.COVID-19长期症状。
1.病原学诊断(如核酸检测、抗原检测)方法及效率优化。
2.早期联合使用抗病毒药物、抗病毒药物联合免疫调节药物的有效性与安全性。
3.早期使用高效价恢复期血浆的有效性与安全性。
4.单克隆中和抗体及抗体鸡尾酒疗法的有效性与安全性。
5.糖皮质激素的最佳应用时机、剂量、疗程与长期效果。
6.IL-6受体拮抗剂、JAK抑制剂等免疫调节生物制剂的有效性与安全性。
7.最佳呼吸支持策略。
8.新型抗病毒药物/广谱抗冠状病毒药物的筛选与评估。
9.预防COVID-19长期症状的院内与出院后管理策略。
COVID-19康复时机及最佳康复策略。
1.SARS-CoV-2病毒变异对疫苗效果的影响。
2.疫苗的长期预防效果与安全性。
3.疫苗接种方案优化(剂型、剂量、剂次)。
4.儿童、老年人的疫苗接种方案。
5.针对冠状病毒的广谱长效疫苗设计及优化。
1.呼吸道传染病的报告制度优化与监测体系建立。
2.提高应对重大紧急突发公共卫生事件的能力。
3.疫情防控与复工复产平衡。
(曹彬)
卞修武(陆军军医大学第一附属医院病理科);曹彬(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 中国医学科学院呼吸病学研究院);陈荣昌(深圳市人民医院呼吸与危重症医学科 深圳市呼吸疾病研究所);程璘令(广州医科大学附属第一医院呼吸与危重症医学科 广州呼吸健康研究院 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 呼吸疾病国家重点实验室);程真顺(武汉大学中南医院呼吸与危重症医学科);冯录召(中国医学科学院北京协和医学院群医学及公共卫生学院);高福(中国疾病预防控制中心);江山平(中山大学孙逸仙纪念医院呼吸与危重症医学科);李六亿(北京大学第一医院感染管理-疾病预防控制处);李时悦(广州医科大学附属第一医院呼吸与危重症医学科 广州呼吸健康研究院 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 呼吸疾病国家重点实验室);梁宗安(四川大学华西医院呼吸与危重症医学科);刘忠(中国医学科学院输血研究所);卢洪洲(上海市公共卫生临床中心感染与免疫科);彭志勇(武汉大学中南医院重症医学科);平轶芳(陆军军医大学第一附属医院病理科);瞿介明(上海交通大学医学院附属瑞金医院呼吸与危重症医学科);任丽丽(中国医学科学院病原生物学研究所);石正丽(中国科学院武汉病毒研究所);宋元林(复旦大学附属中山医院呼吸与危重症医学科);谭文杰(中国疾病预防控制中心病毒病预防控制所);王辰(中国医学科学院北京协和医学院);王华庆(中国疾病预防控制中心免疫中心);王健伟(中国医学科学院北京协和医学院);吴浩(首都医科大学丰台方庄社区卫生服务中心);吴玉章(陆军军医大学全军免疫学研究所);谢欲晓(中日友好医院康复医学科);熊维宁(上海交通大学医学院附属第九人民医院呼吸与危重症医学科);徐金富(同济大学附属上海市肺科医院呼吸与危重症医学科);严景华(中国科学院微生物研究所);杨维中(中国医学科学院北京协和医学院群医学及公共卫生学院);翟振国(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 中国医学科学院呼吸病学研究院);詹庆元(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 中国医学科学院呼吸病学研究院);张静(复旦大学附属中山医院呼吸与危重症医学科);张伟(海军军医大学第一附属医院呼吸与危重症医学科);赵红梅(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 中国医学科学院呼吸病学研究院);赵建平(华中科技大学同济医学院附属同济医院呼吸与危重症医学科);周敏(上海交通大学医学院附属瑞金医院呼吸与危重症医学科)
刘春涛(四川大学华西医院呼吸与危重症医学科);施毅(中国人民解放军东部战区总医院呼吸与危重症医学科);王贵强(北京大学第一医院感染疾病科);吴安华(中南大学湘雅医院感染控制中心);周新(上海交通大学附属第一人民医院呼吸与危重症医学科);宗志勇(四川大学华西医院感染性疾病中心)
陈耀龙,周奇,葛龙,罗旭飞,杨克虎(兰州大学健康数据科学研究院指南与标准研究中心 世界卫生组织指南实施与知识转化合作中心 中华医学会杂志社指南与标准研究中心 兰州大学GRADE中心 Cochrane兰州大学中心)
商潋瀚(北京中医药大学,中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 中国医学科学院呼吸病学研究院);王业明,王一民(中日友好医院呼吸中心呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心 中国医学科学院呼吸病学研究院);徐九洋(清华大学医学院);范国辉(中日友好医院临床医学研究所);张灿有(中国疾病预防控制中心);胡犇(中国科学院武汉病毒研究所);路简羽(北京大学第一医院感染管理-疾病预防控制处);宋全伟(中国疾病预防控制中心免疫规划中心)
本指南受到国家自然科学基金(82041011)、中国医学科学院医学与健康科技创新工程(2018-I2M-1-003/2020-I2M-CoV19-005)的资助,且资助机构不影响整个指南的制订过程
经收集汇总所有指南专家组成员利益冲突声明表后,部分指南专家组成员声明了参与如下药物的COVID-19临床研究(按姓氏汉语拼音排序):曹彬(瑞德西韦,洛匹那韦/利托那韦,糖皮质激素);程璘令(rhG-CSF);程真顺(瑞德西韦);江山平(氯喹);李时悦(rhG-CSF);刘忠(恢复期血浆);卢洪洲(干扰素κ联合三叶因子2);瞿介明(恢复期血浆、羟氯喹、糖皮质激素);宋元林(糖皮质激素);王辰(瑞德西韦,洛匹那韦/利托那韦);熊维宁(糖皮质激素);徐金富(糖皮质激素);张伟(恢复期血浆,托珠单抗);赵建平(瑞德西韦,鲁索替尼);周敏(恢复期血浆)。经指南方法学组讨论判定,所有参与指南制订的专家组成员均无经济利益冲突,而上述声明的学术利益关系同时也未对指南的推荐意见产生重要影响

英文缩略词表
英文缩略词表
| 英文缩写 | 英文全称 | 中文翻译 | |||
|---|---|---|---|---|---|
| ACE2 | angiotensin converting enzyme 2 | 血管紧张素转化酶2 | |||
| AGREE Ⅱ | appraisal of guidelines for research and evaluation Ⅱ | 临床指南研究与评估系统Ⅱ | |||
| AKI | acute kidney injury | 急性肾损伤 | |||
| AMSTAR | a measurement tool to assess systematic reviews | 系统评价偏倚风险评价工具 | |||
| ARDS | acute respiratory distress syndrome | 急性呼吸窘迫综合征 | |||
| BMI | body mass index | 体质指数 | |||
| CACP | Chinese Association of Chest Physicians | 中国医师协会呼吸医师分会 | |||
| CFR | case-fatality rate | 病死率 | |||
| CI | confidence interval | 置信区间 | |||
| COVID-19 | coronavirus disease 2019 | 2019冠状病毒病 | |||
| CRP | C-reactive protein | C-反应蛋白 | |||
| CT | computed tomography | 电子计算机断层扫描 | |||
| CTL | cytotoxic T lymphocyte | 细胞毒性T细胞 | |||
| CTS | Chinese Thoracic Society | 中华医学会呼吸病学分会 | |||
| DLCO | diffusing capacity of the lung for carbon monoxide | 肺一氧化碳弥散量 | |||
| DPP4 | dipeptidyl peptidase 4 | 二肽基肽酶4 | |||
| ECMO | extracorporeal membrane oxygenation | 体外膜式氧合 | |||
| FEV1 | forced expiratory volume in one second | 一秒用力呼气容积 | |||
| FiO2 | fraction of inspired oxygen | 吸入气中氧浓度 | |||
| FVC | forced vital capacity | 用力肺活量 | |||
| GISAID | Global Initiative on Sharing All Influenza Data | 全球流感数据共享倡议组织 | |||
| HFNC | high-flow nasal cannula oxygen therapy | 经鼻高流量湿化氧疗 | |||
| ICU | intensive care unit | 重症监护病房 | |||
| IFN-Ⅰ | type Ⅰ interferon | Ⅰ型干扰素 | |||
| IFR | infection fatality rate | 感染死亡比 | |||
| IL | interleukin | 白细胞介素 | |||
| IL-6R | interleukin-6 receptor | 白细胞介素-6受体 | |||
| IQR | interquartile range | 四分位间距 | |||
| ISG | IFN-stimulated gene | 干扰素激活相关基因 | |||
| IVIG | intravenous immunoglobulin | 静脉注射人免疫球蛋白 | |||
| JAK | Janus kinase | Janus激酶 | |||
| LMWH | low molecular weight heparin | 低分子肝素 | |||
| MERS | Middle East respiratory syndrome | 中东呼吸综合征 | |||
| MERS-CoV | Middle East respiratory syndrome coronavirus | 中东呼吸综合征冠状病毒 | |||
| NLR | neutrophil to lymphocyte ratio | 中性粒细胞-淋巴细胞比值 | |||
| NPI | non-pharmaceutical intervention | 非药物干预措施 | |||
| ORF | open reading frame | 开放阅读框 | |||
| PaO2 | partial pressure of oxygen | 动脉血氧分压 | |||
| PaCO2 | partial pressure of CO2 | 动脉二氧化碳分压 | |||
| PCR | polymerase chain reaction | 聚合酶链式反应 | |||
| PEEP | positive end-expiratory pressure | 呼气末正压 | |||
| PPE | personal protective equipment | 个人防护用品 | |||
| PT | prothrombin time | 凝血酶原时间 | |||
| QUADAS-2 | quality assessment of diagnostic accuracy studies | 诊断准确性研究的质量评价工具 | |||
| R0 | basic reproduction number | 基本再生数 | |||
| RBD | receptor-binding domain | 受体结合区 | |||
| RCT | randomized controlled trial | 随机对照试验 | |||
| rhG-CSF | recombinant human granulocyte colony stimulating factor | 重组人粒细胞集落刺激因子 | |||
| RIGHT | Reporting Items for Practice Guidelines in Healthcare | 国际实践指南报告标准 | |||
| ROB | risk of bias | 偏倚风险评价工具 | |||
| RPE | rating of perceived exertion | 运动强度与运动自觉量表 | |||
| Rt | effective reproductive number | 有效再生数 | |||
| RT-PCR | reverse transcription-polymerase chain reaction | 逆转录聚合酶链反应 | |||
| SARS | severe acute respiratory syndrome | 严重急性呼吸综合征 | |||
| SARS-CoV | severe acute respiratory syndrome coronavirus | 严重急性呼吸综合征冠状病毒 | |||
| SARS-CoV-2 | severe acute respiratory syndrome coronavirus 2 | 严重急性呼吸综合征冠状病毒2 | |||
| SARSr-CoV | severe acute respiratory syndrome-related coronavirus | 严重急性呼吸综合征相关冠状病毒 | |||
| SpO2 | peripheral oxygen saturation | 外周血氧饱和度 | |||
| SNP | single nucleotide polymorphism | 单核苷酸多态性 | |||
| Tem | effector memory T cells | 效应记忆T细胞 | |||
| Tfh | follicular helper T cells | 滤泡辅助性T细胞 | |||
| TMPRSS2 | transmembrane serine protease 2 | 跨膜丝氨酸蛋白酶2 | |||
| TnⅠ | troponin Ⅰ | 肌钙蛋白Ⅰ | |||
| TNF-α | tumor necrosis factor-α | 肿瘤坏死因子-α | |||
| UFH | unfractionated heparin | 普通肝素 | |||
| VA-ECMO | veno-arterial extracorporeal membrane oxygenation | 静脉-动脉体外膜式氧合 | |||
| VEGF | vascular endothelial growth factor | 血管内皮生长因子 | |||
| VLP | virus-like particle | 病毒样颗粒 | |||
| Vt | tidal volume | 潮气量 | |||
| VTE | venous thromboembolism | 静脉血栓栓塞症 | |||
| VV-ECMO | veno-venous extracorporeal membrane oxygenation | 静脉-静脉体外膜式氧合 | |||
| WHO | World Health Organization | 世界卫生组织 | |||



























