
分析2005-2015年中国胰腺癌发病及死亡的趋势并分别估计其年龄-时期-队列效应。
基于《中国肿瘤登记年报》数据,利用Joinpoint回归分析2005-2015年胰腺癌的发病率及死亡率的变化趋势,计算年度变化百分比、平均年度变化百分比。采用年龄-时期-队列模型对20~84岁人群的数据进行拟合,估计其效应参数。
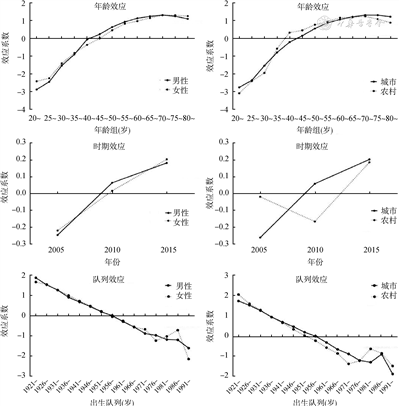
2005-2015年中国胰腺癌粗发病率及粗死亡率变化趋势基本一致,以2008年为界,先上升后下降;男性高于女性,城市高于农村。2005-2015年胰腺癌的总体发病中标率平均每年上升2.78%,总体死亡中标率平均每年上升2.24%。发病率以农村男性中标率变化最快,平均每年上升3.74%;死亡率以城市男性中标率变化最快,平均每年上升3.57%。发病率及死亡率的年龄效应总体随年龄增长而上升,在70~80岁时效应最大;时期效应总体随时间推移而上升;队列效应随出生年份推移而下降,在1976年后出现反弹和波动。
中国胰腺癌的发病率和死亡率稳中有升,应继续重视胰腺癌的防控工作。

胰腺癌是恶性程度最高的肿瘤之一,其5年生存率不足10%[1]。2018年全球胰腺癌新发病例为458 918例,位列主要癌症第14位;死亡病例为432 242例,位列第7位[2]。2015年,中国胰腺癌发病数为9.5万,死亡数为8.5万,分别位居中国癌症发病和死亡的第10位和第6位;发病率与死亡率均为城市高于农村,男性高于女性[3]。胰腺癌起病隐匿,发现时多数已无法手术切除,预后不良。因此,分析胰腺癌的发病、死亡趋势及影响因素对于胰腺癌防治具有重要意义。2013年,马臣等[4]基于1995-2007年中国肿瘤登记数据,对胰腺癌的发病趋势进行了分析和预测。本研究采用Joinpoint回归和年龄-时期-队列(Age-Period-Cohort)模型,对2005-2015年胰腺癌发病与死亡趋势进行分析,并探讨年龄、时期、出生队列对其的影响,以期为中国胰腺癌的防控提供支持。
1. 资料来源:胰腺癌各年份粗发病率、粗死亡率、中标率、年龄别发病率及年龄别死亡率均摘录于《中国肿瘤登记年报》(2008-2018年)。年报中原始数据收集于全国31省(自治区、直辖市)及新疆生产建设兵团的肿瘤登记处。以2018年年报为例,共收集501个肿瘤登记处数据,覆盖3.87亿人口,数据质控后最终纳入388个肿瘤登记处,覆盖3.2亿人口。中标率均根据当年各年龄别发病率或年龄别死亡率与2002年中国标准人口计算。
2. 研究方法:
(1)趋势分析:采用Joinpoint回归对胰腺癌发病率及死亡率进行趋势分析,计算年度变化百分比(annual percentage change,APC)、平均年度变化百分比(average annual percentage change,AAPC)及其95%CI。
(2)年龄-时期-队列模型拟合:分析中国成年人年龄、时期、出生队列对胰腺癌发病率及死亡率的影响。以5岁为1个年龄段,将20~84岁分为13个年龄段。采用Poisson对数线性模型对年龄-时期-队列模型进行内源估计算子(intrinsic estimator,IE)求解。在早年的年龄-时期-队列模型分析中,多根据5年平均率来计算[5],但这样会扩大计算所得出生队列的范围,减小描述发病风险的时间精度,因此近年来多根据单年率进行计算,且该方法也更适用于缺乏原始发病例数和暴露人口的资料[6]。本研究采用2005、2010、2015年的年龄别数据进行年龄-时期-队列模型模拟,估计年龄、时期、出生队列对胰腺癌发病及死亡风险的效应参数。
3. 统计学分析:Joinpoint回归采用美国国家癌症研究所开发的Joinpoint Regression Program 4.8.0.1软件进行。年龄-时期-队列模型采用Stata 15.1的APC-IE软件包进行。
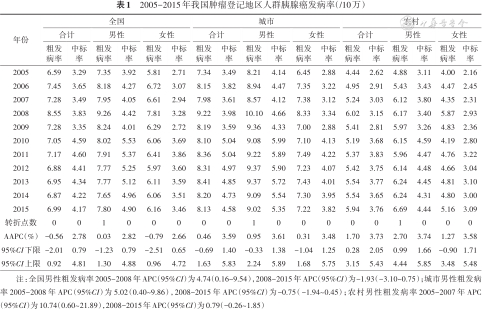
1. 胰腺癌发病率变化趋势:2005年中国肿瘤登记地区覆盖人口约为6 937万人,占全国人口5.31%;至2015年,覆盖人口约为3.2亿人,占比增至23.55%。2015年全国肿瘤登记地区胰腺癌总发病病例数为22 434例。2005-2008年中国胰腺癌总体粗发病率呈现波动上升趋势,2008-2010年呈现下降趋势,而后出现波动,具体数值由6.59/10万(2005年)上升至8.55/10万(2008年)再回落至6.99/10万(2015年)。男性发病率高于女性,其变化趋势均与总体保持一致;城市发病率高于农村,城市发病率变化趋势与总体一致,农村粗发病率在2005-2008年上升趋势更为稳定,在2014年后出现抬头趋势(图1)。Joinpoint回归显示,全国男性及城市男性粗发病率均在2008年出现1个转折点,农村男性粗发病率在2007年出现1个转折点,男性中标率、女性粗发病率及中标率的变化趋势均未出现有统计学意义的转折点。除全国总体粗发病率及女性粗发病率的AAPC为负值外,其余均为正值;其中,男性高于女性,农村高于城市。总体中标率AAPC为2.78%,农村男性中标率AAPC最大,为3.74%。见表1。
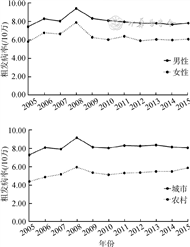

胰腺癌发病率
2005-2015年我国肿瘤登记地区人群胰腺癌发病率(/10万)
2005-2015年我国肿瘤登记地区人群胰腺癌发病率(/10万)
| 年份 | 全国 | 城市 | 农村 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 合计 | 男性 | 女性 | 合计 | 男性 | 女性 | 合计 | 男性 | 女性 | ||||||||||
| 粗发病率 | 中标率 | 粗发病率 | 中标率 | 粗发病率 | 中标率 | 粗发病率 | 中标率 | 粗发病率 | 中标率 | 粗发病率 | 中标率 | 粗发病率 | 中标率 | 粗发病率 | 中标率 | 粗发病率 | 中标率 | |
| 2005 | 6.59 | 3.29 | 7.35 | 3.92 | 5.81 | 2.71 | 7.34 | 3.49 | 8.21 | 4.14 | 6.45 | 2.88 | 4.44 | 2.62 | 4.88 | 3.11 | 4.00 | 2.16 |
| 2006 | 7.45 | 3.65 | 8.18 | 4.27 | 6.72 | 3.07 | 8.15 | 3.82 | 8.94 | 4.47 | 7.35 | 3.22 | 4.95 | 2.91 | 5.43 | 3.43 | 4.47 | 2.45 |
| 2007 | 7.28 | 3.49 | 7.95 | 4.05 | 6.61 | 2.94 | 7.98 | 3.61 | 8.57 | 4.12 | 7.38 | 3.12 | 5.24 | 3.03 | 6.12 | 3.80 | 4.35 | 2.31 |
| 2008 | 8.55 | 3.83 | 9.26 | 4.42 | 7.81 | 3.28 | 9.22 | 3.98 | 10.10 | 4.66 | 8.33 | 3.34 | 6.02 | 3.15 | 6.17 | 3.40 | 5.87 | 2.93 |
| 2009 | 7.28 | 3.35 | 8.24 | 4.01 | 6.29 | 2.72 | 8.19 | 3.59 | 9.36 | 4.33 | 7.00 | 2.88 | 5.41 | 2.81 | 5.97 | 3.26 | 4.83 | 2.36 |
| 2010 | 7.05 | 4.59 | 8.02 | 5.53 | 6.06 | 3.69 | 8.10 | 5.04 | 9.08 | 5.99 | 7.10 | 4.13 | 5.19 | 3.68 | 6.15 | 4.59 | 4.19 | 2.80 |
| 2011 | 7.17 | 4.60 | 7.91 | 5.37 | 6.41 | 3.86 | 8.36 | 5.04 | 9.22 | 5.89 | 7.49 | 4.22 | 5.37 | 3.83 | 5.96 | 4.47 | 4.76 | 3.22 |
| 2012 | 6.88 | 4.41 | 7.77 | 5.25 | 5.97 | 3.60 | 8.31 | 4.97 | 9.37 | 5.90 | 7.23 | 4.07 | 5.42 | 3.75 | 6.14 | 4.48 | 4.66 | 3.04 |
| 2013 | 6.95 | 4.34 | 7.77 | 5.12 | 6.11 | 3.59 | 8.41 | 4.85 | 9.37 | 5.72 | 7.43 | 4.01 | 5.54 | 3.77 | 6.24 | 4.45 | 4.81 | 3.10 |
| 2014 | 6.87 | 4.22 | 7.65 | 4.96 | 6.06 | 3.51 | 8.20 | 4.73 | 9.09 | 5.54 | 7.30 | 3.95 | 5.54 | 3.65 | 6.24 | 4.31 | 4.80 | 3.00 |
| 2015 | 6.99 | 4.17 | 7.80 | 4.90 | 6.16 | 3.46 | 8.13 | 4.58 | 9.02 | 5.35 | 7.22 | 3.82 | 5.94 | 3.76 | 6.69 | 4.44 | 5.16 | 3.09 |
| 转折点数 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| AAPC(%) | -0.56 | 2.78 | 0.03 | 2.82 | -0.79 | 2.66 | 0.46 | 3.59 | 0.95 | 3.61 | 0.31 | 3.48 | 1.70 | 3.73 | 2.70 | 3.74 | 1.27 | 3.58 |
| 95%CI下限 | -2.01 | 0.79 | -1.23 | 0.79 | -2.51 | 0.65 | -0.69 | 1.40 | -0.33 | 1.38 | -1.04 | 1.25 | 0.28 | 2.05 | 0.99 | 1.66 | -0.90 | 1.71 |
| 95%CI上限 | 0.92 | 4.81 | 1.30 | 4.88 | 0.96 | 4.72 | 1.63 | 5.83 | 2.24 | 5.89 | 1.68 | 5.75 | 3.15 | 5.43 | 4.44 | 5.85 | 3.48 | 5.48 |
注:全国男性粗发病率2005-2008年APC(95%CI)为4.74(0.16~9.54),2008-2015年APC(95%CI)为-1.93(-3.10~0.75);城市男性粗发病率2005-2008年APC(95%CI)为5.02(0.40~9.86),2008-2015年APC(95%CI)为-0.75(-1.94~0.45);农村男性粗发病率2005-2007年APC(95%CI)为10.74(0.60~21.89),2008-2015年APC(95%CI)为0.79(-0.26~1.85)
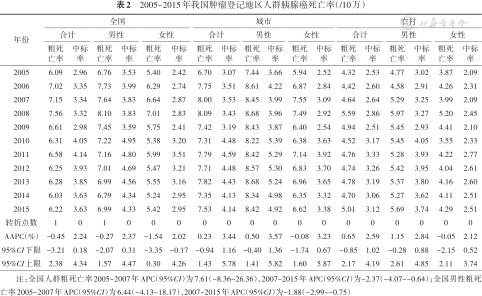
2. 胰腺癌死亡率变化趋势:2015年全国肿瘤登记地区胰腺癌总死亡病例数为19 947例。2005-2015年全国胰腺癌死亡率与发病率变化趋势大致相同。粗死亡率以2008年为分界点,由6.09/10万(2005年)上升至7.56/10万(2008年)再回落至6.22/10万(2015年)。其中,死亡率男性高于女性,城市高于农村(图2)。Joinpoint回归显示,全国粗死亡率和全国男性粗死亡率均在2007年出现1个转折点,其他人群粗死亡率及中标率均未出现有统计学意义的转折点。全国平均粗死亡率、男性/女性粗死亡率、城市/农村女性粗死亡率的AAPC为负值,其余为正值。总体中标率AAPC为2.24%,城市男性中标率AAPC最大,为3.57%。见表2。
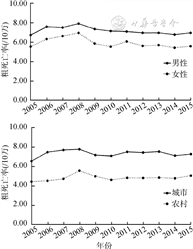

2005-2015年我国肿瘤登记地区人群胰腺癌死亡率(/10万)
2005-2015年我国肿瘤登记地区人群胰腺癌死亡率(/10万)
| 年份 | 全国 | 城市 | 农村 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 合计 | 男性 | 女性 | 合计 | 男性 | 女性 | 合计 | 男性 | 女性 | ||||||||||
粗死 亡率 | 中标率 | 粗死 亡率 | 中标率 | 粗死 亡率 | 中标 率 | 粗死 亡率 | 中标率 | 粗死亡率 | 中标率 | 粗死 亡率 | 中标率 | 粗死 亡率 | 中标率 | 粗死 亡率 | 中标率 | 粗死 亡率 | 中标率 | |
| 2005 | 6.09 | 2.96 | 6.76 | 3.53 | 5.40 | 2.42 | 6.70 | 3.07 | 7.44 | 3.66 | 5.94 | 2.52 | 4.32 | 2.53 | 4.77 | 3.02 | 3.87 | 2.09 |
| 2006 | 7.02 | 3.35 | 7.73 | 3.99 | 6.29 | 2.74 | 7.75 | 3.51 | 8.61 | 4.22 | 6.87 | 2.84 | 4.42 | 2.60 | 4.58 | 2.91 | 4.26 | 2.31 |
| 2007 | 7.15 | 3.34 | 7.64 | 3.83 | 6.64 | 2.87 | 8.00 | 3.53 | 8.45 | 3.99 | 7.55 | 3.09 | 4.64 | 2.64 | 5.29 | 3.25 | 3.99 | 2.09 |
| 2008 | 7.56 | 3.32 | 8.10 | 3.83 | 7.01 | 2.83 | 8.09 | 3.43 | 8.68 | 3.96 | 7.49 | 2.92 | 5.59 | 2.86 | 5.97 | 3.27 | 5.20 | 2.45 |
| 2009 | 6.61 | 2.98 | 7.45 | 3.59 | 5.75 | 2.41 | 7.42 | 3.19 | 8.43 | 3.87 | 6.40 | 2.54 | 4.94 | 2.51 | 5.45 | 2.93 | 4.41 | 2.10 |
| 2010 | 6.31 | 4.05 | 7.22 | 4.95 | 5.38 | 3.20 | 7.31 | 4.48 | 8.22 | 5.39 | 6.38 | 3.63 | 4.52 | 3.17 | 5.45 | 4.05 | 3.55 | 2.33 |
| 2011 | 6.58 | 4.14 | 7.16 | 4.80 | 5.99 | 3.51 | 7.79 | 4.59 | 8.42 | 5.29 | 7.14 | 3.92 | 4.76 | 3.33 | 5.28 | 3.93 | 4.22 | 2.77 |
| 2012 | 6.25 | 3.93 | 7.01 | 4.69 | 5.47 | 3.21 | 7.71 | 4.48 | 8.57 | 5.30 | 6.83 | 3.70 | 4.74 | 3.26 | 5.42 | 3.95 | 4.04 | 2.61 |
| 2013 | 6.28 | 3.85 | 6.99 | 4.56 | 5.55 | 3.16 | 7.82 | 4.43 | 8.68 | 5.24 | 6.96 | 3.65 | 4.78 | 3.19 | 5.37 | 3.80 | 4.16 | 2.60 |
| 2014 | 6.03 | 3.63 | 6.79 | 4.34 | 5.24 | 2.95 | 7.35 | 4.13 | 8.34 | 4.98 | 6.35 | 3.32 | 4.70 | 3.06 | 5.27 | 3.62 | 4.11 | 2.51 |
| 2015 | 6.22 | 3.63 | 6.99 | 4.33 | 5.42 | 2.95 | 7.53 | 4.14 | 8.42 | 4.92 | 6.62 | 3.38 | 5.01 | 3.12 | 5.69 | 3.74 | 4.29 | 2.51 |
| 转折点数 | 1 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| AAPC(%) | -0.45 | 2.24 | -0.27 | 2.37 | -1.54 | 2.02 | 0.23 | 3.44 | 0.50 | 3.57 | -0.08 | 3.23 | 0.65 | 2.59 | 1.15 | 2.84 | -0.05 | 2.12 |
| 95%CI下限 | -3.21 | 0.18 | -2.07 | 0.31 | -3.35 | -0.17 | -0.94 | 1.16 | -0.40 | 1.36 | -1.74 | 0.67 | -0.85 | 1.02 | -0.28 | 0.88 | -2.15 | 0.52 |
| 95%CI上限 | 2.38 | 4.34 | 1.57 | 4.47 | 0.30 | 4.26 | 1.43 | 5.78 | 1.41 | 5.82 | 1.60 | 5.87 | 2.17 | 4.19 | 2.61 | 4.85 | 2.11 | 3.74 |
注:全国人群粗死亡率2005-2007年APC(95%CI)为7.61(-8.36~26.36),2007-2015年APC(95%CI)为-2.37(-4.07~-0.64);全国男性粗死亡率2005-2007年APC(95%CI)为6.44(-4.13~18.17),2007-2015年APC(95%CI)为-1.88(-2.99~-0.75)
3. 年龄-时期-队列模型分析:胰腺癌发病率的年龄、时期、队列效应见图3。年龄效应随年龄增长总体呈现上升趋势,男性、女性及城乡的年龄效应变化趋势基本一致。其中,男性、城乡居民均在70~74岁时年龄效应最大;女性在75~79岁时年龄效应最大。模型参数估计结果显示,总体人群70~74岁时的效应系数比20~24岁时增加了3.943,即发病风险增加为20~24岁时的约52倍(RR=e3.943=51.573)。男性、女性的时期效应变化趋势一致,随年份推移效应增加;城市居民的时期效应总体呈现上升趋势,但农村居民的时期效应先下降后上升,在2010年效应最低。队列效应随出生年份推移总体呈下降趋势;1976年之前,队列效应下降趋势平稳,1976年之后队列效应随出生年份呈波动式下降。参数估计结果显示,与1921-1925年之间出生的人相比,1991-1995年出生的人队列效应系数降低了3.648,即相应的发病风险降低为1921- 1925年出生人群的0.026倍(RR=e-3.648=0.026)。

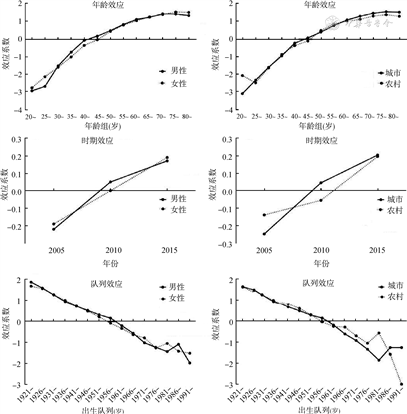
胰腺癌死亡率的年龄-时期-队列模型的年龄、时期、队列效应与发病率的各效应总体趋势一致(图4)。年龄效应随年龄增长而增加,参数估计结果显示,总体人群在75~80岁时年龄效应系数最高,比20~24岁时增加了4.356,即死亡风险为20~24岁时的约78倍(RR=e4.356=77.945)。时期效应随年份推移而增加,男女性趋势基本一致,城市较农村增加更为明显。队列效应总体随出生年份推移而下降,在1976年之后出现波动。其中,城市人群队列效应在1981年后出现反弹后维持稳定,农村人群队列效应在1976年出现反弹,在1981年后继续下降,且降速更快。1991-1995年出生的农村人群的队列效应明显低于同期出生城市人群的队列效应。

2005-2015年,中国胰腺癌总体发病率稳中有升,与1998-2007年我国胰腺癌发病变化趋势相比更为稳定[4]。其中,男性增速高于女性,农村增速高于城市,农村男性中标率增速最快。胰腺癌死亡率与发病率变化趋势一致,但更为平稳。全国男性及城市男性粗发病率均在2008年出现1个转折点,农村男性粗发病率在2007年出现1个转折点,但年龄调整后的中标率却均未出现转折点,说明粗率出现转折点可能与纳入统计的癌症登记处的人口年龄构成变化有关。以全国男性数据为例,2006- 2010年全国肿瘤登记地区覆盖人口中70岁以上男性占全年龄段男性的百分比分别为6.50%、6.69%、7.21%、6.82%、6.59%,该占比在2008年时最高。本研究结果显示,男性胰腺癌发病的年龄效应在70~74岁时最高,因此当胰腺癌发病风险更高的年龄段人口占比增大时,会使胰腺癌粗发病率增加,故全国男性粗发病率在2008年出现转折点。研究显示,全球范围内,胰腺癌总体发病率与死亡率均呈现上升趋势,发病率的增速女性高于男性,与我国情况略有不同;其中,人类发展指数越高的国家,胰腺癌发病率及死亡率越高[7]。目前,西方国家推荐对有胰腺癌家族史和遗传倾向的>50岁人群进行一年1次的超声内镜或核磁共振检查[8],以期尽早发现胰腺癌患者,为治疗争取时间。而在我国,虽然胰腺癌早期诊断的相关研究迅速增加[9],相关防治政策也不断推进,但仍缺少对高危人群进行规律筛查的研究和实践。近年来,全球胰腺癌的治疗技术不断发展,5年生存率略有提升,目前维持在9%左右[1,10]。而据中国癌症登记数据,我国胰腺癌5年生存率略有下降,从2003-2005年的11.7%降至2013-2015年的7.2%[11]。近年来,随着胰腺癌治疗手段的丰富与提高,我国胰腺癌的治疗水平也有一定程度的进展。但由于早年间胰腺癌诊断能力及动力不足,一些晚期胰腺癌患者在死亡前并未被明确诊断,导致纳入统计的早、中期可切除的患者占比更高,由此获得的5年生存率可能高于实际情况。
胰腺癌发病及死亡年龄效应均随年龄增长而上升,在70~80岁左右达到最高。年龄是胰腺癌的危险因素之一,绝大部分的胰腺癌患者集中在40~80岁之间,老年患者胰腺癌的发病风险显著高于年轻人[12]。值得注意的是,近年来,胰腺癌的发病也出现了年轻化的趋势[13],2019年美国一项调查显示29~45岁的胰腺癌患者发病率有所上升[14],我国1976年后出生的人群胰腺癌发病和死亡的队列效应也出现波动。这提示我们不仅要重视老年胰腺癌高危人群的早诊早治工作,也要重视年轻人胰腺癌的发病机制和预防工作。
时期效应总体随时间的推移呈上升趋势,这可能是胰腺癌的发生与不良生活方式,如吸烟、体力活动减少、膳食结构改变、糖尿病等因素有关[8]。农村发病的时期效应在2010年出现了降低,与城市发病的时期效应变化不一致。2003年,新农合作医疗开始试点实行,至2010年基本实现全覆盖,这一举措极大的提高了农村居民医疗服务的可及性[15]。总体而言,多种因素的综合作用使得农村发病的时期效应变化趋势与城市不同。
队列效应随出生年份推移总体呈现下降趋势,这主要得益于人民经济情况、生活水平、医疗服务质量的提高。其中,孕妇的营养和健康水平逐渐提升[16];儿童青少年身高大幅增高;居民营养不良和贫血状况均得到明显改善[17],生命早期的健康水平对于该出生队列人群未来的胰腺癌发生发展影响重大。随着健康中国建设不断推进,居民健康素养也稳步提升,2016年中国居民健康素养水平为11.58%,较2008年的6.48%增长了5.1%[18]。然而,在1976年以后,队列效应出现波动,其主要原因可能与近年来的环境污染和青年人、中年人逐渐增大的生活压力有关,这些因素可能会部分抵消有利条件对疾病的保护效应。
从疾病特点来讲,胰腺癌恶性程度高、预后差,手术切除仍为重要的治疗手段。但由于其临床症状不典型、缺乏特异性早期诊断标志物等特点,导致约80%患者就诊时,已经处于局部进展期或远处转移阶段,失去手术的机会[19]。放化疗作为胰腺癌患者的主要辅助治疗方案,常常因治疗耐受导致效果并不理想[20]。近年来,尽管免疫治疗、靶向治疗等新方法在肺癌、乳腺癌等肿瘤中取得显著进展,但在胰腺癌中的疗效却不尽人意[21, 22]。因此,经过几十年的探索,胰腺癌患者的整体预后并未得到显著改善。筛查胰腺癌高危人群,寻找早期诊断标志物,探索治疗新方法、新思路将是今后胰腺癌重点研究方向。
本研究存在局限性。首先,本研究利用2008- 2018年发表的《中国肿瘤登记年报》公开数据进行分析,原始数据来源于全国肿瘤登记处,而非随机抽样,对于整体中国人群的代表性及外推结果仍有一定限制。此外,由于年龄别发病率按照每5年一个年龄段进行报道,在本研究进行年龄-时期-队列模型拟合时,时期也只能选择每隔5年的年份进行分析,因此最后纳入模型的只有3个时期:2005、2010、2015年,用于解释时期效应变化趋势仍不够充分。
综上所述,本研究对我国2005-2015年胰腺癌发病与死亡趋势进行了分析,探讨了年龄、时期、队列对其发病风险的影响。胰腺癌的发病和死亡的总体趋势相对稳定。老年人群发病风险高,预后差,年轻人的队列效应也出现反弹趋势,这提示我们仍要重视胰腺癌的防治工作。
所有作者均声明不存在利益冲突



























