
脑小血管病(CSVD)的临床诊断高度依赖于神经影像学技术,其影像学特征改变包括脑白质高信号、腔隙及腔隙性卒中、脑微出血和血管周围间隙等,反映了继发于小血管损伤的脑组织改变。随着影像学技术的快速发展,一些特殊的磁共振成像(MRI)序列、功能MRI及正电子发射断层扫描等技术也越来越多地被应用到CSVD的临床诊断中。因此,加强对CSVD影像学特征性改变的认识和定义的理解,统一影像学的获取和评估方法,对于CSVD的临床诊断、疾病探索具有重要的意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,2021 年从第2 期开始共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
脑小血管病(cerebral small vessel disease,CSVD)是一类在老年人群中常见的脑血管病,临床可表现为脑卒中、认知功能障碍和痴呆、步态异常等。CSVD累及的血管通常为穿支动脉、微动脉、毛细血管和微静脉等脑小血管,现有的检查手段不能对其管壁损害进行直观评价,因此继发于CSVD相关脑组织损伤的影像学表现常被作为CSVD的临床诊断依据。基于头颅核磁共振成像(magnetic resonance imaging,MRI)检出的CSVD特征性脑组织损伤包括:脑白质高信号(white matter hyperintense,WMH)、腔隙(lacunes)、脑微出血(cerebral microbleeds)和扩大的血管周围间隙(perivascular space,PVS)。然而对于这些影像学标志物的定义、影像采集和评估方法并没有完全统一的标准。既往在临床及科研中,常采用STRIVE(standards for reporting vascular changes on neuroimaging)标准对CSVD进行诊断和评估,而随着影像学技术的发展,一些新兴的技术如弥散张量成像(diffusion tensor imaging,DTI)、动脉自旋标记(arterial spin labeling,ASL)、功能性MRI(functional MRI)和正电子发射断层扫描(positron emission computed tomography)等也越来越多地被应用在CSVD的诊断当中。
CSVD通常是基于影像来诊断的。由于CT的敏感度和显示病变范围的能力有限,因此除脑出血外不推荐对CSVD使用常规CT检查[1]。对CSVD进行临床诊断时首选MRI,但需多个序列综合评估。常规MRI检查序列应当包括T1加权成像(T1WI)、T2加权成像(T2WI),液体衰减反转恢复序列(fluid attenuated inversion recover,FLAIR)、弥散加权成像(diffusion weighted imaging,DWI)、T2*加权梯度回波序列(gradient-recalled echo)或磁敏感加权成像(susceptibility weighted imaging,SWI),详见表1。
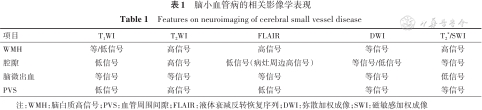
脑小血管病的相关影像学表现
Features on neuroimaging of cerebral small vessel disease
脑小血管病的相关影像学表现
Features on neuroimaging of cerebral small vessel disease
| 项目 | T1WI | T2WI | FLAIR | DWI | T2*/SWI |
|---|---|---|---|---|---|
| WMH | 等/低信号 | 高信号 | 高信号 | 等信号 | 高信号 |
| 腔隙 | 低信号 | 高信号 | 低信号(病灶周边高信号) | 等信号/低信号 | 等信号 |
| 脑微出血 | 等信号 | 等信号 | 等信号 | 等信号 | 低信号 |
| PVS | 低信号 | 高信号 | 低信号 | 等信号 | 等信号 |
注:WMH:脑白质高信号;PVS:血管周围间隙;FLAIR:液体衰减反转恢复序列;DWI:弥散加权成像;SWI:磁敏感加权成像
除常规MRI外,近年来DTI也可以通过测量水分子扩散检测超微结构组织的损伤。DTI最常见的测量指标包括分数各向异性(fractional anisotropy,FA)和平均扩散率(mean diffusivity,MD)[2]。在脑白质损伤的脑组织中,表现为FA减小和MD增加[3]。而基于DTI的自由水分析对组织微血管损伤更加特异,可以在CSVD的早期进行预测[4]。同样对早期CSVD敏感的影像学技术还有高场强MRI,一项关于常染色体显性遗传病合并皮质下梗死和白质脑病的研究发现7 T MRI可以检测出1 mm以内的微梗死,与常规1.5 T和3 T MRI相比分辨率明显提高[5]。
除此之外,利用脑灌注成像可以反映组织的微血管分布和灌注情况,对CSVD的诊断具有一定帮助。目前常用的灌注成像序列包括动态磁敏感对比增强(dynamic susceptibility contrast)和ASL,其中ASL可以将血液磁标记为内源性示踪剂,用于大血管和小血管的评估,同时结合乙酰唑胺试验可以评估脑血管功能储备,近年来备受关注[6]。
基于既往研究,CSVD的影像学改变包括新发的皮质下小梗死、WMH、腔隙、脑微出血、PVS,以及凸面皮质含铁血黄素沉积、脑微梗死和脑萎缩等。
“Leukoaraiosis”一词于1986年被Hachinski提出,当时创造这个新词的原因在于随着头颅CT的应用,人们发现脑白质弥漫性低密度改变与痴呆及脑血管病危险因素相关[7]。最早认为这是Binswanger病的影像学改变,但很快人们认识到LA相关的病理改变远较Binswanger病更加广泛和复杂,因此,LA逐渐被认定为一个独立的影像学特征。LA是指对称性的、弥漫的脑白质异常,在头颅CT为低密度,在头颅MRI T2WI序列和FLAIR像为高信号。随着头颅MRI的广泛应用,WMH这个词在文献中的出现率已大大高于LA。
“Lacunes”一词源于法文,由法国病理学家Dechambre首先在1838年使用并描述了深部脑实质内存在的一种充满液体的小空洞(cavity),1965年Fisher发表了著名的文章Lacunes:small,deep cerebral infarcts,指出腔隙通常发生为脑深部小梗死灶的愈合阶段[8]。腔隙通常在影像学检查中偶然发现,可不伴有明显的急性神经功能缺损症状,可由皮质下小梗死或小出血灶演变而来[9]。
在急性缺血性卒中患者中,约有25%的病灶位于皮质下,大多<20 mm,通常被认为是穿支动脉或小血管病变导致的急性卒中。既往根据其特定的临床症状,被称为腔隙性卒中或腔隙性梗死综合征,近年来的文献称其为新发的皮质下小梗死(recent small subcortical infarcts)[10]。
脑微梗死的直径通常为0.2~1.0 mm,采用常规MRI序列无法发现,急性期在DWI可表现为高信号[11]。随着高场强MRI的应用,微梗死的检出敏感度已经大大提高,其对CSVD的诊断价值也不断被研究和探索[5]。
CSVD会有一系列出血性的脑部损害。包括脑微出血、CSS和自发性脑出血。
脑微出血是一个影像学诊断,它是应用特殊的顺磁敏感影像序列发现的脑实质内极微量的陈旧出血。由于顺磁性的含铁血黄素可以引起局部磁场的不均匀,使含铁血黄素局部及周围组织产生相位差异而致信号丢失。脑微出血目前认为是CSVD的另一个重要的特征性的影像学改变。
CSS通常位于幕上脑凸起的皮质表面,可能是蛛网膜下腔出血后的慢性改变,也可能是由血管畸形、脑淀粉样血管病、硬脑膜缺损等原因导致的皮质表面出血导致,通常在T2*加权MRI或SWI序列表现为沿着皮质表面的线样低信号[10]。
CSVD相关的自发性脑出血需要与其他原因导致的继发性脑出血、外伤性脑出血相鉴别,通常与脑淀粉样血管病相关的脑出血位于脑叶,尤其是后部脑叶,而与动脉粥样硬化相关CSVD变引起的脑出血,主要位于大脑深部结构,包括基底节、内囊、丘脑和脑桥等[12]。
PVS是穿支血管自蛛网膜下腔进入脑实质后环绕在动静脉和微动静脉周围的潜在腔隙。PVS又称为Virchow-Robin间隙,这是根据德国病理学家Rudolf Virchow和法国病理学家Charles Philippe Robin的名字来命名的。在过去很长一段时间,影像学发现的PVS一直被认为是正常结构,而进一步研究发现PVS与WMH的严重程度及腔隙的出现密切相关,PVS逐渐被认为是CSVD的另一个影像学标志物[13, 14]。
在文献中脑萎缩也常被描述为CSVD的一种重要的影像学改变,表现为脑体积的减少。但脑萎缩是多种脑部疾病共有的现象,而非CSVD所特有。
2000年Erkinjuntti等[15]提出了皮质下血管性痴呆的影像诊断标准,其中包括了脑白质损伤和腔隙性卒中的定义。2006年美国国家神经疾病与卒中研究所和加拿大卒中合作组第一次将CSVD的影像学特征作为血管性认知障碍影像诊断的一部分,美国心脏协会和卒中协会在2011年同样将CSVD的影像学改变纳入血管性轻度认知障碍和痴呆的诊断标准中,但这些指南并没有为CSVD的影像学诊断标准进行定义[16, 17]。直到2013年,为了规范CSVD影像学改变的定义和诊断标准,由英国、德国和加拿大的专家组成的神经退行性疾病精英中心(Centres of Excellence in Neurodegeneration)共同制订了STRIVE标准,同时加入新发皮质下小梗死和脑萎缩作为CSVD的影像学改变[10]。STRIVE仍是目前临床诊断和研究中广泛使用和推荐的CSVD影像诊断标准。
STRIVE标准中定义血管源性WMH为“在T2WI中表现为高信号、T1WI表现为低或等信号(不同于脑脊液低信号)的病灶”,而在头颅CT检查中这些病灶表现为脑白质低密度[10]。
目前认为评定WMH通常需要关注两个特征变量,一是WMH的位置,二是WMH的严重程度(表2)。

脑小血管病的影像学标志物评估
Assessment of cerebral small vessel disease markers on neuroimaging
脑小血管病的影像学标志物评估
Assessment of cerebral small vessel disease markers on neuroimaging
| 项目 | 病灶大小 | 位置 | 评估序列 | 评估方法 |
|---|---|---|---|---|
| WMH | 不定 | 广泛白质中,常分为侧脑室旁和深部两种 | T1WI、T2WI、FLAIR | 视觉半定量评估:Fazekas 评分量表[24]、Scheltens量表[25]、ARWMC量表[26]等; 定量评估:基于体素的形态学评价[27] |
| 腔隙 | 3~15 mm(轴位) | 基底节区、脑白质和脑桥,小脑少见 | T1WI、T2WI、FLAIR(脑脊液信号) | 病变的大小、部位和数量,注意与PVS鉴别 |
| 腔隙性卒中 | ≤20 mm(轴位) | 穿支动脉供血区 | DWI最佳 | 病变的大小、部位和数量,注意临床症状的相关性以及影像采集距离发病的时间 |
| 脑微出血 | ≤10 mm(轴位) | 深部及幕下结构:提示可能与高血压动脉硬化性CSVD有关; 大脑皮质脑叶:提示可能与脑淀粉样变CSVD有关 | T2*或SWI最佳 | 脑微出血存在的大小、部位和数量,其中部位通常划分为幕下、深部及脑叶; 视觉评分量表:解剖评分量表[28]、观察者脑微出血评分量表[29]等; 定量评估:磁敏感定量成像技术[30] |
| PVS | ≤2 mm(轴位) | 基底节区,尤其是前穿质附近:豆纹动脉周围; 皮质下灰白质交界区:皮质穿支动脉周围; 脑桥中脑交界区和中脑间脑交界区; 海马也有报道,小脑罕见 | T1WI、T2WI、FLAIR(脑脊液信号) | 无统一标准,多采用分别在基底节区和白质评估PVS数量和严重程度的方法,或依据视觉半定量评估[31] |
注:WMH:脑白质高信号;PVS:血管周围间隙;CSVD:脑小血管病;FLAIR:液体衰减反转恢复序列;DWI:弥散加权成像;SWI:磁敏感加权成像
需要特别指出的是,头颅MRI影像所见的WMH实际并不特异,好发于儿童的脑白质营养不良和好发于青壮年的脑白质炎性脱髓鞘病都可以表现出WMH的影像学改变。即使在老年人中,也可能在尸检时发现的脑白质损伤中找到意料之外的病理改变,如脑积水、淋巴瘤等。因此,在WMH的诊断和研究中有两个方面应该得到重视:(1)CSVD相关的脑白质病变是绝大多数老年人WMH的原因;(2)应根据临床表现和影像学特征对WMH进行进一步的鉴别诊断。
STRIVE标准将血管源性腔隙定义为“直径为3~15 mm的圆形或卵圆形位于皮质下充满液体的小洞(信号接近脑脊液信号),源于既往穿支动脉分布区的急性皮质下小梗死或出血灶”[10]。
无急性卒中症状的腔隙仅仅依赖于影像学技术被发现和诊断。但腔隙性卒中(或腔隙性脑梗死)的诊断要复杂得多,往往不能简单将小灶的深部梗死认定为小血管病相关的腔隙性脑梗死,还要加入其他辅助检查进一步明确病因和发病机制,如除外大血管病变、心源性卒中等。STRIVE标准中将影像上的腔隙性卒中定义为“影像学证实在穿支小动脉供血区域内新近发生的小梗死灶,轴位最大直径≤20 mm,并与数周内发生的临床症状一致”[10]。在冠状位或矢状位,腔隙性卒中的直径可以超过20 mm,病灶的直径没有下限[1]。需要特别注意的是,尽管鉴别上存在一定的困难,但载体动脉斑块阻塞穿支动脉开口时导致的梗死不应当被认为是腔隙性卒中。
腔隙的诊断主要依据4方面的信息,包括病灶的部位、病灶的信号、病灶的大小(表2)和除外PVS可能。如果将全部序列为水信号的病灶判定为腔隙,则特别需要谨慎除外另一种内部为液体信号的小洞样结构,即PVS。尽管绝大多数PVS直径较小,但既往的病理和影像学研究结果提示,在直径大于3 mm的病灶中,PVS并不罕见,所以除外大的PVS非常必要[18, 19]。有以下几种方法可以帮助进行鉴别:(1)通常认为腔隙病灶周边边界不规整,而PVS多表现为光滑边界;(2)由于腔隙病灶周围存在胶质增生,在FLAIR上可见病灶周边有高密度信号环绕,而PVS往往没有,但对于存在与WMH中的PVS仍不易鉴别;(3)应用高分辨MRI和三维多角度成像技术可以对小空洞形态进行更细致的分析,凡是沿穿支动脉长轴方向呈现囊状扩张,同时囊状结构伴有血管形态延伸的病灶,应诊断为PVS;(4)根据PVS好发位置进行区分也有一定价值[20]。
STRIVE标准将脑微出血定义为“在T2*加权MRI或SWI序列上可见的圆形、卵圆形边界清楚、均质的信号丢失小灶,直径通常在2~5 mm,最大可至10 mm,在CT、FLAIR、T1WI和T2WI序列相应部位均不可见”。
2009年微出血研究组推荐的诊断标准更具可操作性,它包括了3条诊断标准和4条排除标准[21]。首先病灶在核磁T2*序列上应表现为圆形或卵圆形的黑色信号,病变具有放大效应。同时应除外:(1)软脑膜血管横断面:脑微出血病灶应至少有一半以上被脑组织围绕;(2)铁或钙沉积:通常依据易沉积的部位、形态和经验除外;(3)根据病史除外外伤弥漫性轴索损伤;(4)其他类似信号结构,脑微出血病灶在T1WI和T2WI序列上应为等信号。该诊断标准认为脑微出血并无直径界限。既往研究有关脑微出血的直径定义常不一致,2~10 mm均有报道,这是由于脑微出血的大小取决于影像学参数和磁场强度,很难在各个研究中保持一致。
SWI敏感性优于T2*,因此推荐SWI作为评估脑微出血的首选方法[22]。脑微出血检出的敏感度还取决于MRI场强,既往研究提示7 T MRI对脑微出血的检出率高于3 T和1.5 T MRI,尤其对于较小的脑微出血,但高场强也易受其他金属沉积、静脉中脱氧血红蛋白和放大效应等因素的影响[23]。
需要注意的是,WMH、腔隙性梗死和腔隙、脑微出血和PVS虽然是公认CSVD的影像标志物,但并不具有特异性。脑小血管管壁损害是衰老过程中必然发生的现象,因此上述4种影像学改变均随着年龄的增长而显著增加,在正常老年人和有临床意义的CSVD患者间并无严重程度的绝对界限。同时这4种影像学改变也会在其他疾病中出现,例如WMH也可以是炎性脱髓鞘病或脑白质营养不良所致;位于深部的小灶陈旧软化脑梗死病灶也可以由大动脉粥样硬化、斑块脱落继发动脉到动脉栓塞所致;脑内海绵状血管瘤、动静脉畸形及特定类型肿瘤可导致脑微出血;黏多糖贮积症患者可见颅内多发、大量及位于特殊部位(胼胝体等处)的PVS。因此,CSVD的影像学诊断应充分结合患者的病史和临床表现来进行鉴别诊断,避免过度泛化。在诊断CSVD时,需要注意尽管存在仅有单一影像学改变的CSVD,但数个影像标志物同时存在,可高度提示CSVD。
目前已有的CSVD影像学诊断标准是在专家共识的基础上制订的,而且由于学科和影像学技术的快速发展,还需要更多的大型研究提供足够的证据支持,不断完善和更新标准。此外,由于缺乏神经病理学的相关研究,使得现有的影像学诊断标准不能得到进一步的验证,未来的神经影像病理关联性研究将会是进一步探索的关键。
作者声明不存在利益冲突
None declared
1. 脑小血管病的影像学特征改变不包括下列哪一项?
A. 脑微梗死
B. 皮质表面含铁血黄素沉积
C. 脑微出血
D. 蛛网膜下腔高密度影
E. Virchow-Robin间隙
2. 血管周围间隙好发的部位不包括?
A. 皮质下灰白质交界区
B. 豆状核
C. 脑桥中脑交界区
D. 小脑
E. 前穿质附近
3. 关于头颅磁共振成像上腔隙和血管周围间隙的鉴别,哪一项正确?
A. 在头颅磁共振成像所有序列都表现为水信号的病灶为血管周围间隙
B. 沿穿支动脉长轴方向呈现囊状扩张的病灶,应诊断为腔隙
C. 位于脑干的病灶应诊断为腔隙
D. 大多数腔隙灶在液体衰减反转恢复序列(FLAIR)上可见病灶周边有高密度信号环绕
E. 轴位<3 mm的病灶一定是血管周围间隙,≥3 mm的一定是腔隙
4. 关于脑微出血的描述,哪项不正确?
A. 在T2*或磁敏感加权成像序列上显示的病灶通常小于其实际出血病灶的大小
B. 在FLAIR、T1WI和T2WI序列相应部位均不可见
C. 可以通过磁敏感定量成像技术进行定量评估
D. 病灶直径通常在2~5 mm
E. 位于深部及幕下脑结构中的脑出血,提示可能与高血压动脉硬化性脑小血管病有关
5. 关于脑小血管病特征性表现的描述,哪项不正确?
A. 脑萎缩并非脑小血管病所特有的影像学改变
B. 血管周围间隙是脑小血管病特有的影像学改变
C. 位于脑沟附近的小圆形磁敏感成像低信号,需要与小静脉鉴别
D. 目前脑小血管病通常是基于影像来进行临床诊断的
E. 脑大动脉粥样硬化性狭窄的患者也可以出现腔隙性脑梗死



























