
系统总结和评价全球范围内宫颈癌筛查指南的制定现状。
以“宫颈癌/宫颈癌前病变”“筛查”“指南/专家共识/推荐意见”以及“cervical cancer/cervical intraepithelial neoplasia”“screening”“guidelines/recommendations”为关键词,检索PubMed、Embase、中国知网、万方数据库中的宫颈癌筛查指南,语种限定为中文和英文。截至2020年9月1日前,共纳入29篇有效文献,对纳入文献的基本信息、推荐意见等进行汇总描述和总结。
29篇文献中,大多数指南针对宫颈癌及癌前病变一般发病风险的人群,目标人群集中在25~65岁;细胞学检查和人乳头瘤病毒(HPV)检测是常用的两种筛查方法,且越来越多的国家逐渐推荐使用HPV检测作为宫颈癌的初筛方法;大多数指南推荐筛查间隔为5年(HPV检测或HPV和细胞学联合筛查策略)或3年(细胞学筛查策略);针对筛查异常人群,大多数指南推荐分流或重复检测来进一步识别高风险人群,针对宫颈病变发病风险较高人群,则推荐进行阴道镜转诊或即时治疗。仅有部分指南涉及疫苗接种人群,并推荐采用与未接种疫苗、具有一般风险人群相同的筛查策略。
目前大部分宫颈癌筛查指南仅涉及一般风险人群且主要来自发达国家。筛查措施逐渐由传统的细胞学检查向以HPV检测为主的筛查方案转变。各国或地区指南尚缺少针对特殊人群如何进行宫颈癌筛查的相关推荐。

宫颈癌是影响全球女性健康的第四大恶性肿瘤,同时也是我国女性常见的恶性肿瘤之一,防控形势严峻[1]。宫颈癌疾病负担严重但却有很好的防控前景,2020年世界卫生组织(WHO)正式发布《加速消除宫颈癌全球战略》,明确了2030年各国在人乳头瘤病毒(HPV)疫苗接种、宫颈癌筛查与治疗方面需达到的阶段性目标[2]。近年来我国在宫颈癌防控领域投入巨大,但距消除宫颈癌的目标仍存在较大差距[3],尤其在HPV疫苗尚未在我国得到广泛接种的情况下,筛查仍是宫颈癌防控的主要手段。
筛查指南对规范实施宫颈癌筛查具有重要引领作用。我国于2005年制定了首个《中国癌症筛查及早诊早治技术指南》[4],其中对宫颈癌筛查给予一定指导建议,并于2017年发布《子宫颈癌综合防控指南》[5]。随着全球宫颈癌筛查技术和策略的不断发展,研究证据不断扩充,我国亟需对现有筛查指南进行实时更新,探索制定适宜本国的防控策略。据此,本文对目前全球范围内宫颈癌筛查指南进行系统梳理,深入了解全球指南的制定现状及推荐意见,为我国更新指南提供参考。
以宫颈癌/宫颈癌前病变、筛查、指南/专家共识/推荐意见为中文检索词,以cervical cancer/cervical intraepithelial neoplasia、screening、guidelines/recommendations为英文检索词,并考虑主题词的不同表达形式编制检索式,分别检索PubMed、Embase、中国知网、万方数据库,检索时间限定为建库至2020年9月1日,语种限定为中文和英文。同时,还检索WHO、国际癌症研究署(IARC)、英国国家筛查委员会(NCS)、澳大利亚国家健康与医疗研究局(NHMRC)、新西兰卫生部、国际指南协作网(GIN)、中国临床指南文库(CGC)等与筛查指南可能相关的网站。
1. 纳入标准:(1)公开发表的原创的与宫颈癌筛查相关的指南/专家共识/推荐意见(如有多次更新版本,则纳入最新版本;如同时存在指南/专家共识/推荐意见,优先纳入指南,其次为专家共识或推荐意见);(2)由官方或其他专业组织(行业学会、协会、学术机构、专家组)制定和发布均纳入;(3)语种仅限中、英文。
2. 排除标准:(1)宫颈癌筛查指南/专家共识/推荐意见的介绍、评析、应用指导、效果评价等;(2)非最新版本指南;(3)非宫颈癌筛查指南/专家共识/推荐意见(如原始研究);(4)非英文、中文语种;(5)重复文献或未找到全文。最终共纳入文献29篇,文献筛选过程详见图1。
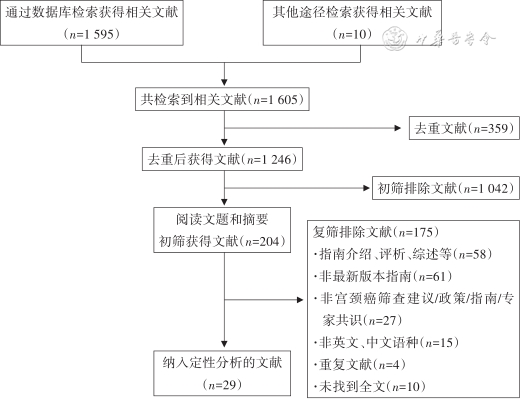

制定文献信息摘录表,包括:指南基本信息(发布国家/地区、发布时间、发布机构、指南名称、指南版本等);宫颈癌筛查推荐意见(筛查目标人群、筛查措施、筛查间隔、筛查异常人群管理及针对特殊人群的筛查建议等)。对所有宫颈癌筛查指南的发布情况、筛查推荐意见方面进行汇总描述。
在初步筛选文献时,制定统一的筛选流程和说明,并统一培训文献筛选者,利用EndNote X9.1软件进行文献查重,排除重复文献,然后依据文献纳入排除标准,进行双人独立平行文献筛选,完成后对不一致的文献进行核查。对于意见不统一的文献由第三人仲裁。
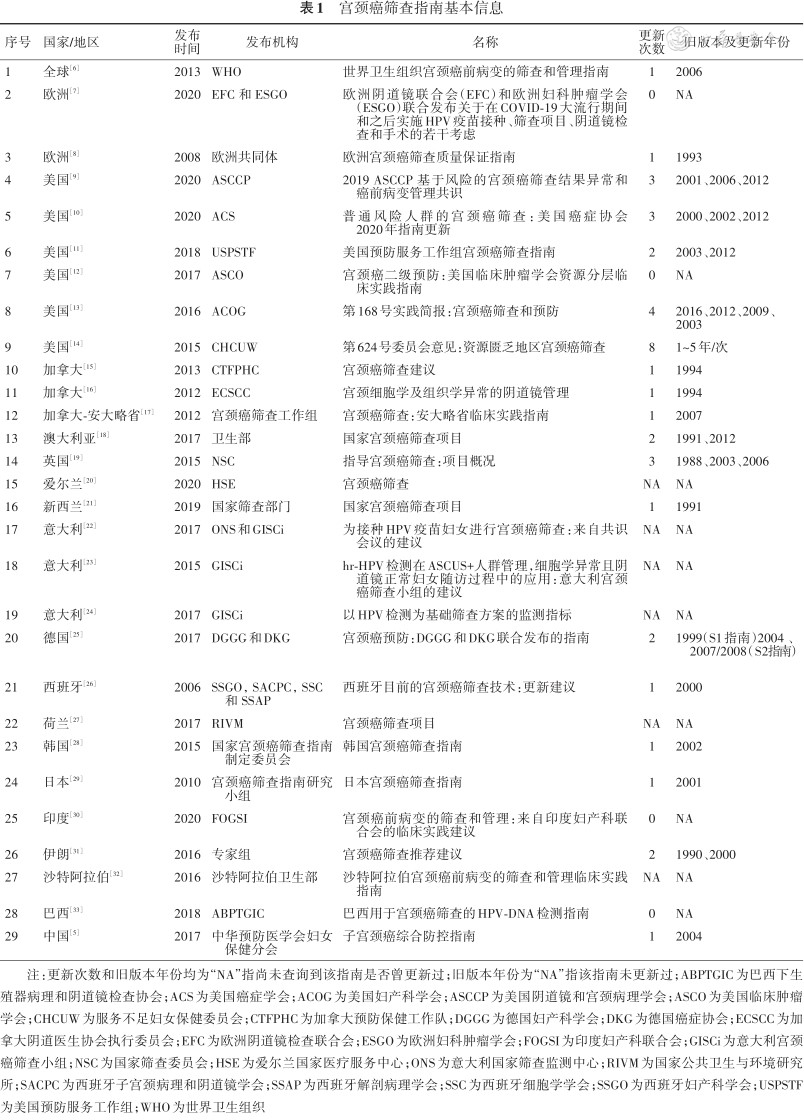
目前WHO、欧盟及部分发达和少数发展中国家均发布了宫颈癌筛查指南。纳入的29部指南基本信息见表1。按发布指南的国家/地区、发布时间、指南名称、发布机构、指南更新次数、各个版本发布年份等对宫颈癌筛查指南的基本信息进行梳理。汇总各机构发布的最新指南,发布时间范围为2006至2020年。指南发布机构共涉及各国/地区的(妇科)肿瘤/宫颈癌研究协会、国家癌症筛查中心/委员会、细胞学/阴道镜/病理学会等相关部门。12/17的指南来自发达国家,65.5%(19/29)的指南发布机构对相关指南进行了更新。
宫颈癌筛查指南基本信息
宫颈癌筛查指南基本信息
| 序号 | 国家/地区 | 发布 时间 | 发布机构 | 名称 | 更新 次数 | 旧版本及更新年份 |
|---|---|---|---|---|---|---|
| 1 | 全球[6] | 2013 | WHO | 世界卫生组织宫颈癌前病变的筛查和管理指南 | 1 | 2006 |
| 2 | 欧洲[7] | 2020 | EFC 和 ESGO | 欧洲阴道镜联合会(EFC)和欧洲妇科肿瘤学会(ESGO)联合发布关于在COVID-19大流行期间和之后实施HPV疫苗接种、筛查项目、阴道镜检查和手术的若干考虑 | 0 | NA |
| 3 | 欧洲[8] | 2008 | 欧洲共同体 | 欧洲宫颈癌筛查质量保证指南 | 1 | 1993 |
| 4 | 美国[9] | 2020 | ASCCP | 2019 ASCCP 基于风险的宫颈癌筛查结果异常和癌前病变管理共识 | 3 | 2001、2006、2012 |
| 5 | 美国[10] | 2020 | ACS | 普通风险人群的宫颈癌筛查:美国癌症协会2020年指南更新 | 3 | 2000、2002、2012 |
| 6 | 美国[11] | 2018 | USPSTF | 美国预防服务工作组宫颈癌筛查指南 | 2 | 2003、2012 |
| 7 | 美国[12] | 2017 | ASCO | 宫颈癌二级预防:美国临床肿瘤学会资源分层临床实践指南 | 0 | NA |
| 8 | 美国[13] | 2016 | ACOG | 第168号实践简报:宫颈癌筛查和预防 | 4 | 2016、2012、2009、2003 |
| 9 | 美国[14] | 2015 | CHCUW | 第624号委员会意见:资源匮乏地区宫颈癌筛查 | 8 | 1~5年/次 |
| 10 | 加拿大[15] | 2013 | CTFPHC | 宫颈癌筛查建议 | 1 | 1994 |
| 11 | 加拿大[16] | 2012 | ECSCC | 宫颈细胞学及组织学异常的阴道镜管理 | 1 | 1994 |
| 12 | 加拿大-安大略省[17] | 2012 | 宫颈癌筛查工作组 | 宫颈癌筛查:安大略省临床实践指南 | 1 | 2007 |
| 13 | 澳大利亚[18] | 2017 | 卫生部 | 国家宫颈癌筛查项目 | 2 | 1991、2012 |
| 14 | 英国[19] | 2015 | NSC | 指导宫颈癌筛查:项目概况 | 3 | 1988、2003、2006 |
| 15 | 爱尔兰[20] | 2020 | HSE | 宫颈癌筛查 | NA | NA |
| 16 | 新西兰[21] | 2019 | 国家筛查部门 | 国家宫颈癌筛查项目 | 1 | 1991 |
| 17 | 意大利[22] | 2017 | ONS和GISCi | 为接种HPV疫苗妇女进行宫颈癌筛查:来自共识会议的建议 | NA | NA |
| 18 | 意大利[23] | 2015 | GISCi | hr-HPV检测在ASCUS+人群管理,细胞学异常且阴道镜正常妇女随访过程中的应用:意大利宫颈癌筛查小组的建议 | NA | NA |
| 19 | 意大利[24] | 2017 | GISCi | 以HPV检测为基础筛查方案的监测指标 | NA | NA |
| 20 | 德国[25] | 2017 | DGGG和DKG | 宫颈癌预防:DGGG和DKG联合发布的指南 | 2 | 1999(S1指南)2004、 2007/2008(S2指南) |
| 21 | 西班牙[26] | 2006 | SSGO,SACPC,SSC和 SSAP | 西班牙目前的宫颈癌筛查技术:更新建议 | 1 | 2000 |
| 22 | 荷兰[27] | 2017 | RIVM | 宫颈癌筛查项目 | NA | NA |
| 23 | 韩国[28] | 2015 | 国家宫颈癌筛查指南制定委员会 | 韩国宫颈癌筛查指南 | 1 | 2002 |
| 24 | 日本[29] | 2010 | 宫颈癌筛查指南研究小组 | 日本宫颈癌筛查指南 | 1 | 2001 |
| 25 | 印度[30] | 2020 | FOGSI | 宫颈癌前病变的筛查和管理:来自印度妇产科联合会的临床实践建议 | 0 | NA |
| 26 | 伊朗[31] | 2016 | 专家组 | 宫颈癌筛查推荐建议 | 2 | 1990、2000 |
| 27 | 沙特阿拉伯[32] | 2016 | 沙特阿拉伯卫生部 | 沙特阿拉伯宫颈癌前病变的筛查和管理临床实践指南 | NA | NA |
| 28 | 巴西[33] | 2018 | ABPTGIC | 巴西用于宫颈癌筛查的HPV-DNA检测指南 | 0 | NA |
| 29 | 中国[5] | 2017 | 中华预防医学会妇女保健分会 | 子宫颈癌综合防控指南 | 1 | 2004 |
注:更新次数和旧版本年份均为“NA”指尚未查询到该指南是否曾更新过;旧版本年份为“NA”指该指南未更新过;ABPTGIC为巴西下生殖器病理和阴道镜检查协会;ACS为美国癌症学会;ACOG为美国妇产科学会;ASCCP为美国阴道镜和宫颈病理学会;ASCO为美国临床肿瘤学会;CHCUW为服务不足妇女保健委员会;CTFPHC为加拿大预防保健工作队;DGGG为德国妇产科学会;DKG为德国癌症协会;ECSCC为加拿大阴道医生协会执行委员会;EFC为欧洲阴道镜检查联合会;ESGO为欧洲妇科肿瘤学会;FOGSI为印度妇产科联合会;GISCi为意大利宫颈癌筛查小组;NSC为国家筛查委员会;HSE为爱尔兰国家医疗服务中心;ONS为意大利国家筛查监测中心;RIVM为国家公共卫生与环境研究所;SACPC为西班牙子宫颈病理和阴道镜学会;SSAP为西班牙解剖病理学会;SSC为西班牙细胞学学会;SSGO为西班牙妇产科学会;USPSTF为美国预防服务工作组;WHO为世界卫生组织
指南的制定主要考虑目标人群的选择、筛查措施的评价以及筛查阳性人群的管理三个环节。针对一般风险人群的推荐意见(附录1),主要包括指南发布的筛查人群、筛查措施、筛查间隔及筛查阳性人群的管理。
各地区需根据本地不同年龄段女性的疾病负担和可用资源的具体情况来推荐宫颈癌筛查的起始和终止年龄。
1. 起始年龄:2013年,WHO推荐对≥30岁妇女进行宫颈癌筛查[6]。大多数国家/地区宫颈癌筛查指南中推荐筛查起始年龄为25岁[10,15,18, 19, 20, 21,24,26,33],少部分国家建议筛查起始年龄为20~21岁[11,13,16,25,28, 29],或者在初次性生活或婚后3年开始进行筛查[26,32]。荷兰推荐对指定年龄的女性进行筛查(30、35、40、45、50、55或60岁)[27]。美国临床肿瘤学会(ASCO)以及印度妇产科联合会(FOGSI)推荐根据国家不同地区的资源配置情况,选择不同的筛查起始年龄[12,30]。
2. 终止年龄:大部分国家推荐选择64~65岁作为筛查终止年龄[5,9, 10, 11,13,17,19, 20,24,30,32, 33],部分国家选择69、73或74岁作为筛查终止年龄[15,18,21,28,31]。大多数终止筛查的人群需满足既往接受充分筛查且无宫颈癌高危因素等条件。WHO建议如果无法保证对≥30岁全人群进行宫颈癌筛查,可优先选择部分年龄段(如30~49岁)或指定年龄进行筛查[6]。我国指南建议筛查起始年龄为25~30岁,65岁以上女性若过去10年内每3年一次连续3次细胞学检查无异常或每5年一次连续2次HPV检测阴性,无子宫颈上皮内瘤样病变(CIN)史,则不需要继续筛查[5]。
细胞学检查和HPV检测是主要推荐的两种筛查方法。由于HPV检测技术具有客观且灵敏度高等优势,越来越多的国家开始考虑推荐使用HPV检测作为宫颈癌筛查的初筛方法[5, 6, 7,9, 10, 11, 12, 13, 14,17, 18, 19, 20,24,27,30,32, 33]。澳大利亚、英国及荷兰同时推荐采用自我取样HPV检测作为初筛方法[18, 19,27]。但考虑到小年龄组女性虽然HPV感染率高,但发生逆转的可能性也更大,大多数国家对25、30或35岁以下女性仍然推荐使用细胞学检查作为宫颈癌筛查的有效手段[5,11,13,24, 25, 26,30,33]。部分国家因尚无充分研究证明HPV检测相较于细胞学检查具有明显优势,仍推荐使用细胞学检查或者HPV与细胞学联合筛查作为初筛方法(如加拿大[15]、韩国[28]和日本[29])。我国指南推荐在25~29岁年龄组女性中使用细胞学检测,在30~64岁年龄组女性中采用HPV检测、HPV和细胞学联合筛查或醋酸和复方碘液染色肉眼观察(VIA/VILI)[5]。
各国/地区根据不同筛查结果人群宫颈病变的发病风险对筛查异常人群采取不同的管理策略,主要包括分流、阴道镜检查或活检及即时治疗等。
1. 分流管理:针对HPV阳性人群,大多数国家推荐使用细胞学检查或者HPV检测进行分流管理,根据分流结果决定是否进行阴道镜转诊或者即时治疗[5,12,17, 18, 19, 20, 21,24, 25,30,33]。针对细胞学检查异常的女性(尤其意义不明确的非典型鳞状细胞(ASCUS)或低度鳞状上皮内病变),也常推荐采用HPV检测进行进一步的分流管理,最终综合HPV检测和细胞学检查的结果,决定筛查异常人群的管理及随访策略[5,8,23,25,30,33]。
2. 重复检测:对于HPV检测和细胞学检查结果不一致的情况,可推荐在一定时间内通过重复检测对其进行监测,根据监测结果进一步调整管理策略[5,13,16,25,30]。
3. 阴道镜检查或活检:针对筛查结果阳性且发病风险较高的人群,推荐直接进行阴道镜转诊并在必要时活检进行病理诊断。大多数国家针对HPV16/18阳性、细胞学检查结果为高度鳞状上皮内病变或者以上病变(HSIL+)以及HPV检测和细胞学检查同时存在异常的患者建议直接进行阴道镜转诊。
4. 即筛即治:WHO指南于2013年推荐在中低收入国家采用“即筛即治”阳性人群管理策略,即在没有条件进行有组织的以细胞学检查为基础的筛查策略情况下,推荐应用HPV检测或醋酸染色肉眼观察(VIA)初筛,针对筛查阳性的患者,立即进行治疗[6]。部分国家(如印度)针对资源有限地区同样推荐可对细胞学严重病变者进行立即治疗[14,30]。
5. 风险管理:2020年美国阴道镜和宫颈病理学会(ASCCP)最新指南将当前发生重度宫颈上皮内瘤样及以上病变(CIN3+)风险值为4%和60%分别作为阴道镜转诊及快速治疗的风险界值,并公布了结合既往及当前筛查结果来估算患者CIN3+发病的风险值,以作为人群风险管理的依据[9]。我国指南建议采用分流或重复检测对筛查异常人群进行管理[5]。
宫颈癌筛查除了针对一般风险人群,还需要对部分特殊人群的筛查策略进行特别推荐,主要包括免疫缺陷人群、HPV疫苗接种人群、子宫全切人群及妊娠妇女。
免疫缺陷人群包括实体器官或干细胞移植、人类免疫缺陷病毒(HIV)感染或其他原因引起的免疫抑制人群。目前针对该人群的筛查策略主要为HIV感染人群制定,而其他类型免疫抑制人群则可遵循与HIV感染人群相同的筛查策略。美国ASCO、ASCCP和美国癌症学会(ACOG)颁布的指南中均对HIV感染人群的筛查策略给予一定的建议,其中ASCCP最新发布的指南[9]与美国成人和青少年艾滋病毒机会性感染小组于2018年更新的“HIV感染人群预防和治疗指南”相一致[34],建议HIV感染人群应在首次插入式性行为后1年内开始接受筛查;针对≤30岁女性,推荐采用细胞学检查,针对>30岁女性,采用HPV和细胞学联合筛查策略;起始筛查间隔为1年/次,如连续3年检查结果正常,则转为3年/次。WHO推荐的宫颈癌“即筛即治”策略同样适用于HIV感染人群,筛查频率至多为3年/次。美国ASCO建议免疫缺陷患者一生中参加筛查的次数应该是一般风险人群的两倍[12]。我国指南针对免疫缺陷人群建议缩短宫颈癌筛查间隔[5]。
在涉及HPV疫苗接种人群的筛查指南中,均建议疫苗接种人群应该继续进行宫颈癌筛查,且大部分指南推荐采用与未接种疫苗、具有一般风险人群相同的筛查策略。意大利国家筛查监测中心(ONS)和宫颈癌筛查小组于2017年发布的专家共识,推荐针对在12岁(±1岁)进行疫苗接种的人群,筛查起始年龄应该在30岁以上,并采用以HPV检测为基础的筛查策略,筛查间隔在5年以上[22]。我国宫颈癌筛查指南建议HPV疫苗接种后,针对特定年龄的推荐方案同未接种疫苗者一样定期接受宫颈癌筛查[5]。
涉及该人群的大部分指南推荐针对既往无中度宫颈上皮内瘤样及以上病变(CIN2+)且接受子宫全切的妇女,可停止宫颈癌筛查[5,10, 11, 12, 13,28]。美国ASCCP发布的指南中指出行子宫切除术但过去25年内未诊断为CIN2+或已完成25年监测期的患者,一般不建议进行筛查;而诊断为CIN2或CIN3或宫颈原位腺癌(AIS)进行治疗的患者,建议治疗后连续3年进行HPV检测,连续阴性结果后3年/次进行HPV检测,持续监测25年[9]。我国指南建议因良性病变进行子宫切除术的女性可停止筛查[5]。
目标人群与筛查措施的选择与一般风险人群相同。关于筛查阳性人群的管理,美国ASCCP[9]、加拿大[16]和德国[25]发布的指南建议采用与未妊娠妇女相同的原则进行管理,但需注意:(1)不能行宫颈管检查或子宫内膜搔刮/活检;(2)只有在细胞学、阴道镜或组织学怀疑宫颈癌的情况下,才建议进行诊断性切除或重复活检;(3)若细胞学/阴道镜/组织学检查结果排除了HSIL+,建议推迟到产后进行复查;(4)若怀疑或病理诊断CIN2/CIN3,建议持续监测病情并推迟到分娩后再次进行复查或治疗。我国指南建议有妊娠意愿的女性应在孕前检查时询问近一年内是否进行过宫颈癌筛查,如没有,应建议进行子宫颈癌筛查,或在第一次产检时进行[5]。
本研究对全球宫颈癌筛查指南的制定现状进行回顾分析,共纳入29部、涉及17个国家的宫颈癌筛查指南,且大多数来自发达国家。指南涉及内容全面,涵盖了针对一般风险人群以及特殊人群的筛查策略,同时各地区指南的内容、质量也因当地宫颈癌疾病负担和医疗资源配置不同而差异较大。
因地制宜选择最佳的筛查策略是实施组织性筛查项目取得效果的关键,其中筛查方法是筛查策略的重要组成部分。传统细胞学检查曾在发达国家广泛应用,但需要训练有素的专业人员和设备[35, 36, 37],因此很难在发展中国家推广。高危型HPV诊断技术已被证实具有更高的灵敏度和可重复性[38, 39]。近年来,部分欧洲国家已将HPV检测作为细胞学检查的替代方法纳入了宫颈癌筛查。WHO也颁布了将HPV检测技术逐步引入中低收入国家(LMIC)的指南和建议[40]。2020年,一项基于中国首次大规模队列人群的宫颈癌筛查随机对照临床研究结果表明[41],采用高危型HPV检测作为初筛技术,具有较好的筛查效果与成本效益,这为我国最终消除宫颈癌提供了充分的科学证据。
对筛查阳性人群进行及时且有效的管理,是保证筛查策略效率的第二个关键。筛查阳性者行阴道镜转诊是高资源国家(HIC)以细胞学检查为基础的宫颈癌筛查项目的必备环节。但在低资源地区,由于设备昂贵、对技术人员要求较高及缺乏病理学诊断医生等,均为阴道镜应用于LMICs的宫颈癌筛查项目提出了新的挑战。随着HPV检测技术的推广应用,越来越多的国家也将其用于HPV阳性或细胞学ASCUS人群的分流管理。对筛查阳性者有效管理的主要目标是减少妇女前往卫生机构的就诊次数,并确保筛查出的宫颈病变妇女能够得到及时有效的治疗。2013年,WHO提出的“即筛即治”的宫颈癌筛查策略,可进一步简化筛查流程,很大程度上提高降低LMICs宫颈癌疾病负担的可能性。
宫颈癌筛查和管理策略的实施,需考虑的另一重要因素是HPV疫苗接种。HPV疫苗的大规模接种将降低宫颈癌的患病率,同时伴随着细胞学检查灵敏度和阳性预测值的下降[42]。此外,早期HPV疫苗仅针对HPV16/18型别,而由其他致癌性HPV型别引起的高级别癌前病变可能进展得更为缓慢,需对其采取不同的管理和治疗策略。但目前全球范围内仅有部分指南涉及疫苗接种人群,并推荐采用与未接种疫苗、具有一般风险人群相同的筛查策略。这一系列问题将给疫苗上市后的宫颈癌筛查和管理策略带来新的挑战,需引起广泛关注。
我国《子宫颈癌综合防控指南》[5]通过参考国内外循证依据,从临床医学、公共卫生和卫生管理三个方面进行了全面的阐述,为指导和规范我国宫颈癌防控工作提供了依据。但现阶段,我国宫颈癌筛查服务的实施仍面临着较大挑战,使得我国现有指南的应用和推广具有一定的局限性。因此为推进健康中国建设及响应WHO全球消除宫颈癌的倡议,在借鉴全球不同国家宫颈癌筛查指南的同时,依据我国医疗资源配置现状,建立资源分层指导建议,并结合疫苗接种策略构建适合我国不同资源地区的宫颈癌综合防控策略,最终使得我国宫颈癌疾病负担得到有效遏制,加速我国宫颈癌消除的步伐。

各宫颈癌筛查指南针对一般风险人群的推荐意见
各宫颈癌筛查指南针对一般风险人群的推荐意见
| 机构及年份 | 筛查人群 | 筛查措施 | 筛查间隔(筛查正常) | 筛查阳性人群管理 |
|---|---|---|---|---|
| WHO.2013[1] | ≥30岁女性(优先30~49岁) | (1)HPV检测(首选); (2)细胞学检查; (3)VIA检查(≤50岁) | (1)HPV检测:≥5年/次; (2)细胞学检查或VIA检查:3~5年/次 | 推荐“即筛即治”策略(首选) (1)HPV阳性者(或VIA分流阳性),立即治疗(HPV+治疗); (2)VIA异常者,立即治疗(VIA+治疗) 优于传统:HPV/细胞学阳性者,阴道镜转诊(或伴有活检),异常者治疗 |
| 欧洲EFC和ESGO. 2020[2] | COVID-19疫情期间参加筛查女性 | (1)HPV检测(可自采);(2)细胞学检查 | (1)无病例/散在病例国家,可继续宫颈癌筛查; (2)群体发病/社区传播病例国家,筛查应被推迟 | (1)HPV阳性且细胞学正常,细胞学ASCUS或LSIL:无症状且风险评估后,阴道镜检查可推迟6~12个月; (2)细胞学HSIL/ASC-H:1~3个月内行阴道镜检查; (3)细胞学AGC/SCC/ADC/AIS:4周内尽快行阴道镜检查 |
| 欧洲共同体. 2008[3] | 起始年龄:20~30岁;终止年龄:60~65岁 | 细胞学检查(可将经过验证的HPV检测用于≥30女性筛查) | 3~5年/次 | (1)细胞学ASCUS:HPV检测分流,阳性转诊阴道镜,阴性1年后随访;或6~12月内重复细胞学检查,结果正常则恢复常规筛查,连续两次结果ASCUS+,转诊阴道镜;或直接转诊阴道镜; (2)细胞学LSIL:阴道镜转诊(首选)或6月/次重复细胞学检查至连续两次结果呈阴性,如结果ASCUS+,转诊阴道镜;(3)细胞学ASC-H/HSIL/AGC/AIS:阴道镜转诊 |
| 美国ACS.2020[4] | 25~65岁(有宫颈) | (1)HPV检测(首选); (2)HPV和细胞学联合筛查; (3)细胞学检查 | (1)HPV检测/HPV和细胞学联合筛查:5年/次; (2)细胞学检查:3年/次 | 遵循ASCCP.2020风险管理共识指南 |
| 美国ASCCP.2020[5] | 25~65岁(有宫颈) | (1)HPV检测; (2)HPV与细胞学联合筛查 | (1)当前CIN3+风险≥60%:快速治疗(≥25岁非妊娠患者);(2)当前CIN3+风险25%~59%之间:快速治疗或阴道镜转诊(≥25岁非妊娠患者);(3)当前CIN3+风险4%~24%之间:阴道镜转诊;(4)当前CIN3+风险<4.0%,5年内CIN3+风险≥0.55%:推荐1年后复查; (5)5年内CIN3+风险0.15%~0.54%之间:3年后复查; (6)5年内CIN3+风险<0.15%:5年后复查 | 参考筛查间隔(筛查正常)推荐内容 |
| 美国USPSTF.2018[6] | 21~65岁(有宫颈) | (1)细胞学筛查:21~65岁;(2)HPV检测/HPV与细胞学联合筛查:30~65岁 | (1)细胞学检查:3年/次;(2)HPV检测/HPV和细胞学联合筛查:5年/次 | 遵循2012年ACS/ASCCP/ASCP指南[7]和2015年ASCCP指南[8] |
| 美国ASCO.2017[9] | (1)最大资源地区:25~64岁;(2)充裕资源地区:30,34,44,54,64岁;(3)有限资源地区:30~49岁;(4)基本资源地区:30~49岁 | HPV检测(基本医疗资源地区,可先采用VIA检测直到HPV检测可行) | (1)最大:5年/次;(2)充裕:一生5次;(3)有限:一生2~3次;(4)基本:一生1~3次 | (1)最大/充裕:HPV型别(HPV16/18或HPV16/18/45)和/或细胞学分流,阳性转诊阴道镜,阴性1年后随访 ;(2)有限:HPV型别(HPV16/18或者HPV16/18/45)、VIA和/或细胞学分流,阳性转诊阴道镜或进行合适治疗,阴性1年后随访; (3)基本:VIA分流,阳性进行合适治疗,阴性1年后随访 |
| 美国ACOG.2016[10] | 21~65岁(有宫颈) | (1)细胞学检查:21~65岁; (2)HPV检测:25~65岁;(3)细胞学和HPV联合筛查:30~65岁 | (1)细胞学检查:3年/次;(2)HPV检测/HPV和细胞学联合筛查:5年/次 | (1)细胞学ASCUS,HPV阴性:3年内重复HPV和细胞学检查; (2)细胞学正常,HPV阳性(>30岁):HPV16/18型别分流,阳性转诊阴道镜,阴性1年后重复细胞学检查和HPV检测;或12个月内重复HPV检测和细胞学检查,异常者转诊阴道镜,正常3年内重复HPV检测和细胞学检查; (3)其他结果遵循2012年ASCCP指南[7] |
| 美国CHCUW.2015[11] | NA | (1)HPV初筛(首选);(2)VIA(HPV检测不可行) | NA | (1)HPV阳性(或进行VIA分流阳性),立即治疗;(2)VIA异常,立即治疗 |
| 加拿大CTFPHC.2013[12] | 25~69岁女性 | 细胞学 | 3年/次 | NA |
| 加拿大ECSCC.2012[13] | ≥21岁女性 | (1)细胞学检查;(2)HPV和细胞学联合筛查 | NA | (1)细胞学结果呈持续性ASCUS/持续性或偶发性LSIL/ASC-H/HSIL/AGC,或提示鳞癌/腺癌:建议立即阴道镜检查; (2)细胞学ASCUS,HPV阳性:建议进行阴道镜检查; (3)细胞学正常,HPV阳性:<30岁,应按照省/地区指导方针执行,无需阴道镜检查;≥30岁,12个月后重复HPV和细胞学检查,异常者转诊阴道镜 |
| 加拿大(安大略省)宫颈癌筛查工作组. 2012[14] | ≤65岁女性 | (1)HPV检测:30-65岁; (2)待定:< 30岁 | 5年/次 | HPV阳性者:细胞学分流,ASCUS+转诊阴道镜;正常者1年后重复HPV检测,根据复查结果决定是否进行阴道镜转诊 |
| 澳大利亚.2017[15] | 25~74岁女性 | HPV检测(分型,可自检) (≥30岁,从未接受过筛查且超过2年拒绝医生取样,可自采) | 5年/次 | HPV阳性者,HPV16/18型别分流,其他型别阳性细胞学分流:(1)HPV16/18分流阳性:阴道镜转诊;(2)HPV16/18分流阴性,细胞学正常/ASCUS/LSIL:12月后重复HPV检测,阴性恢复常规筛查,阳性者阴道镜转诊;(3)HPV16/18分流阴性,细胞学HSIL+:阴道镜转诊; (4)HPV/细胞学不满意:6~12周后重新取样 |
| 英国.2015[16] | 25~64岁女性(有宫颈) | HPV检测(可自检) | 25~49岁: 3年/次50~64岁: 5年/次 | HPV阳性者:细胞学或HPV16/18分流,异常者转诊阴道镜;正常者一年后随访 |
| 爱尔兰.2020[17] | 25~65岁女性(有宫颈) | HPV检测 | 25~29岁:3年/次30~65岁: 5年/次 | HPV阳性者:细胞学分流,异常者阴道镜转诊,正常者一年后随访 |
| 新西兰.2019[18] | 25~69岁(有宫颈) | 细胞学检查 | 3年/次 | (1)细胞学ASCUS/LSIL:≥30岁,HPV分流,阳性阴道镜转诊,阴性一年后随访;<30岁,1年后复查细胞学;(2)细胞学HSIL/AIS:阴道镜转诊; (3)不满意:3月内重新检测 |
| 意大利GISCi.2017[19] | 25~64岁女性 | (1)细胞学检查(25~30/35岁);(2)HPV筛查(30/35~64岁) | (1)细胞学检查:3年/次; (2)HPV检测:≥5年/次 | (1)HPV阳性者:细胞学分流,分流异常阴道镜转诊,分流正常一年后随访; (2)细胞学异常者:转诊阴道镜 |
| 意大利GISCi.2015 [20] | NA | 细胞学检查 | NA | (1)细胞学ASCUS:HPV分流,阴性恢复常规筛查,阳性转诊阴道镜;(2)细胞学LSIL(≥35岁):HPV分流,阴性恢复常规筛查,阳性或未检测HPV转诊阴道镜;(3)细胞学AGC/ASC-H/HSIL:阴道镜转诊 |
| 德国.2017[21] | ≥20岁女性 | (1)细胞学检查:20~34岁;(2)HPV检测或HPV与细胞学联合筛查:35~64岁 | (1)细胞学检查:2年/次;(2)HPV检测或HPV与细胞学联合筛查:≥3年/次 | 1.细胞学筛查策略:(1)ASCUS/AGUS/LSIL/不明确细胞学结果:6月后HPV检测或p16/Ki67双染色分流,阳性者转诊阴道镜,阴性者1年后随访;(2)中/重度细胞学异常:阴道镜转诊 2.HPV初筛策略:HPV阳性:细胞学或p16/Ki67双染色或HPV16/18分流,阳性转诊阴道镜,阴性1年后随访 3.HPV和细胞学联合筛查策略:HPV阳性且细胞学异常:转诊阴道镜 4.风险管理:CIN3+即时发病风险≥10%,阴道镜转诊 |
| 西班牙.2006[22] | 初次性生活后3年或≥25岁有性生活女性 | (1)细胞学检查(≥25岁);(2)HPV和细胞学联合筛查(≥35岁) | (1)细胞学检查:连续2年正常后,3年/次;(2)HPV和细胞学联合筛查:5年/次 | (1)细胞学正常,HPV阳性:1年后复查HPV和细胞学;(2)细胞学异常:细胞学异常管理原则 |
| 荷兰.2017[23] | 30,35,40,45,50,55或60岁女性 | HPV检测(可自检) | 5年/次 | (1)细胞学分流正常:6月后复查细胞学,正常者恢复常规筛查;异常者阴道镜转诊;(2)细胞学分流结果异常:阴道镜检查 |
| 韩国.2015[24] | 20~73岁女性 | 细胞学(在考虑临床决定和个人风险或偏好后,细胞学和HPV联合筛查也可被考虑) | (1)细胞学筛查:3年/次;(2)HPV和细胞学联合筛查:>3年/次 | 阴道镜转诊 |
| 日本.2010 [25] | ≥20岁女性 | 细胞学检查 | 2年/次 | 阴道镜转诊 |
| 印度.2020[26] | (1)充足:25~65岁;(2)有限:30~65岁 | (1)充足:细胞学检查(25~29岁);HPV检查或HPV与细胞学联合筛查(30~65岁);(2)有限:VIA检查 | (1)充足:细胞学检查,3年/次;HPV检测或HPV与细胞学联合筛查,5年/次;(2)有限:5年/次(一生至少筛查1~3次) | 1.HPV初筛策略:HPV阳性:HPV16/18/细胞学/VIA分流,阳性转诊阴道镜,阴性1年后随访。 2.HPV与细胞学联合筛查:(1)均阳性:阴道镜转诊;(2)HPV阳性,细胞学阴性:HPV型别分流或1年后复查HPV;(3)HPV阴性,细胞学ASC-H/HSIL/AGC/可疑癌:转诊阴道镜。 3.细胞学检查:(1)ASCUS:HPV分流或一年后复查细胞学(30~64岁);年轻女性连续两年进行细胞学检查;(2)LSIL:阴道镜转诊或立即治疗(年轻女性重复细胞学检查,持续LSIL转诊阴道镜);(3)ASC-H/HSIL/AGC:阴道镜转诊。 4.VIA检查:VIA异常者,阴道镜转诊。 |
| 伊朗.2016[27] | 30~69岁女性 | (1)细胞学检查;(2)VIA筛查(低资源地区) | 细胞学检查(5年/次) | NA |
| 沙特阿拉伯.2016[28] | 婚后3年内至65岁 | (1)HPV检测(首选);(2)细胞学检查 | NA | HPV阳性/细胞学异常:阴道镜转诊(阴道镜不可行时,以细胞学分流结果进行管理) |
| 巴西.2018[29] | 25~64岁 | (1)细胞学检查(25~29岁);(2)HPV检测(≥30岁) | (1)细胞学检查:3年/次;(2)HPV检测:5年/次 | (1)HPV阳性人群(≥30岁):HPV16/18分流,阳性者阴道镜转诊,阴性者细胞学分流,结果ASCUS+转诊阴道镜;或细胞学分流,正常者12月后复查HPV,异常者转诊阴道镜; (2)细胞学异常人群:ASCUS/LSIL,6月内HPV分流或重复细胞学检查,异常者转诊阴道镜检查;ASC-H/AGC/HSIL,转诊阴道镜 |
| 中国.2017[30] | 25~30岁至64岁 | (1)细胞学检查(25~29岁);(2)HPV检测或HPV和细胞学联合筛查或VIA/VILI(30~64岁) | (1)细胞学检查:3年/次;(2)HPV检测或HPV和细胞学联合筛查:5年/次; (3)VIA检查:2年/次 | 1.细胞学检查:(1)ASCUS:HPV分流或一年后复查细胞学检查,阳性或异常者转诊阴道镜;或直接转诊阴道镜;(2)>ASCUS:转诊阴道镜 2.HPV检测:HPV阳性者:细胞学分流,异常转诊阴道镜,正常1年后复查;或HPV16/18分流,阳性转诊阴道镜,阴性进行细胞学分流,细胞学异常转诊阴道镜,正常1年后复查;或VIA分流,阳性转诊阴道镜,阴性1年后复查; 3.HPV和细胞学联合筛查:(1)HPV阳性,细胞学正常:1年后复查;或HPV16/18分流,阳性转诊阴道镜,阴性1年后复查; (2)HPV阴性,细胞学ASCUS:3年后复查;(3)HPV阴性,细胞学≥LSIL:阴道镜转诊;(4)均阳性:阴道镜转诊 4.VIA检查:VIA异常,阴道镜转诊 |
注:HPV为人乳头瘤病毒;NA指未报告;ADC为宫颈腺癌;AGC为不典型腺细胞;AGUS为意义不明的不典型腺细胞;AIS为原位腺癌;ASC-H为不除外鳞状上皮内高度病变的非典型鳞状细;ASCUS为未明意义的非典型鳞状细胞;ASCUS+为未明意义的非典型鳞状细胞及以上病变;CIN3为重度宫颈上皮内瘤样病变;HSIL为高度鳞状上皮内病变;LSIL为低度鳞状上皮内病变;SCC为鳞状细胞癌;VIA为醋酸染色肉眼观察;ACS为美国癌症学会;ACOG为美国妇产科学会;ASCCP为美国阴道镜和宫颈病理学会;ASCO为美国临床肿瘤学会;CHCUW为服务不足妇女保健委员会;CTFPHC为加拿大预防保健工作队;ECSCC为加拿大阴道医生协会执行委员会;EFC为欧洲阴道镜检查联合会;ESGO为欧洲妇科肿瘤学会;GISCi为意大利宫颈癌筛查小组;USPSTF为美国预防服务工作组;WHO为世界卫生组织



























