
呼出气中的一氧化氮(NO)水平与气道炎症及气道高反应性密切相关。近年来,包括上下气道、大小气道NO检测技术的发展为支气管哮喘、慢性咳嗽、上气道疾病、慢性阻塞性肺疾病甚至少见气道疾病的诊断和治疗提供了重要参考。中国医药教育协会慢性气道疾病专业委员会和中国哮喘联盟在2015年发表的“无创气道炎症评估哮喘的临床应用中国专家共识”的基础上,参照国际相关指南以及重要文献,撰写本共识,针对气道NO检测的方法学、质量控制、结果判读以及临床应用等方面提出指导意见,以助更好应用该项技术指导临床诊疗。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管哮喘(以下简称哮喘)最重要的病理学改变是气道的慢性炎症,而气道炎症水平与气道高反应性密切相关,是出现临床症状的根本原因[1]。气道炎症的评估,特别是无创气道炎症评估方法的发展和临床应用,对于深入了解哮喘的病理生理改变和特征,指导哮喘的管理,更好地达到哮喘的总体控制有着重要的意义[2]。近年来小气道和上气道炎症测定技术的发展,特别是上下气道、大小气道炎症的联合检测,对于全面评估哮喘,采取更精准的个体化治疗具有重要指导意义。对哮喘之外的其他气道疾病,如慢性阻塞性肺疾病(COPD)治疗策略的选择、不明原因慢性咳嗽的诊断及少见气道疾病的诊断和评估也有参考价值[3, 4, 5]。
中国医药教育协会慢性气道疾病专业委员会和中国哮喘联盟组织有关专家进行了认真的讨论,在2015年发表的“无创气道炎症评估哮喘的临床应用中国专家共识”基础上[6],参照国际相关指南以及近年国内外发表的重要文献[7, 8],撰写了本共识,希望能在气道一氧化氮(NO)检测的方法学、质量控制、结果判读以及临床应用等方面提出指导意见,以达到更好应用该项技术指导临床诊疗的目的。关于气道NO检测的临床意义和应用价值尚有诸多有待探索的地方,本共识也提出了未来研究方向,期待我国呼吸领域的专家和学者予以关注,结合我国实际情况开展相关研究,特别是多中心协作研究,以提高我国在该领域的临床应用和研究水平。
气道NO主要产生于气道上皮细胞,为一氧化氮合成酶(NOS)催化L-精氨酸氧化脱氨基产生[9]。NOS被证明至少有3种不同的形式,分别是内皮型NOS(eNOS)、神经型NOS(nNOS)、诱导型NOS(iNOS)[10]。三种同工酶在呼吸道中均有表达,但nNOS主要位于神经系统,eNOS则主要位于内皮细胞,且主要参与调节机体的生理活动。正常情况下iNOS很少表达,仅产生低水平的NO,气道炎症情况下iNOS表达增加,气道上皮产生的NO也明显增加[7,11]。
NO是一种不稳定的生物自由基,常温下为气体,微溶于水,具有脂溶性。NO作为自由扩散的信号分子,参与多种病理生理过程,介导多种生物学作用。主要包括[12]:(1)是体内重要的舒张血管物质,催化环磷酸鸟苷(cGMP)生成,使血管平滑肌舒张;(2)作为呼吸系统非胆碱能非肾上腺能神经递质,舒张气道平滑肌,扩张气道;(3)在宿主防御方面,当巨噬细胞被内毒素或T细胞激活时,产生大量NO及其他炎症介质,杀伤细菌及肿瘤细胞;(4)抑制血小板聚集,产生抗凝作用;(5)抑制中性粒细胞聚集,减少黏附分子表达,发挥其抗炎作用;(6)介导炎症细胞凋亡及促炎细胞因子的产生,调节炎症反应的方向。
适量的NO对机体具有保护作用,但过量的NO具有细胞毒性,通过形成毒性活性氮促进气道炎症及损伤[13]。活性氮通过增加蛋白质中酪氨酸残基的硝基化或减少硫醇残基的亚硝基化,减少具有支气管扩张作用的S-亚硝基硫醇(SNO),从而损伤肺泡上皮细胞表面磷脂及蛋白,抑制肺泡表面活性物质的生成,促进肺泡损伤及肺部炎性渗出[14]。研究发现,经iNOS催化生成的NO在炎症的调节中起核心作用[15]。
辅助性T淋巴细胞2(Th2)细胞因子驱动的哮喘炎症类型统称为2型(T2)炎症。哮喘患者呼出气NO(FeNO)较健康人增高[16],这主要与2型炎症介质促进气道上皮细胞iNOS上调表达有关(见图1)。2型炎症哮喘的基本特征是体内白细胞介素-4(IL-4)、IL-5和IL-13等细胞因子水平升高。IL-4诱导IgE生成,IL-5促进骨髓嗜酸粒细胞(EOS)生成增多和肺内聚集,IL-13参与气道高反应性和高分泌等病理生理过程。但2型炎症细胞因子在血中的浓度极低,检测困难,难以在临床推广应用。NO在哮喘中具有多种作用,其对气道的作用取决于NO的浓度以及与其他生物分子和蛋白质的结合[17]。一方面,适量NO可舒张支气管平滑肌,抑制平滑肌的增殖和促进炎症信号通路的活化,也可在哮喘发作后期通过亚硝基化反应产生SNO,从而对气道反应性产生拮抗作用[18, 19]。另一方面,过量的NO可增加亚硝酸盐、硝酸盐、SNO和硝基酪氨酸等化学产物形成,进而促进气道炎症并造成相应的损伤[20]。NO还可通过形成过氧亚硝酸盐增强气道反应性[20, 21]。
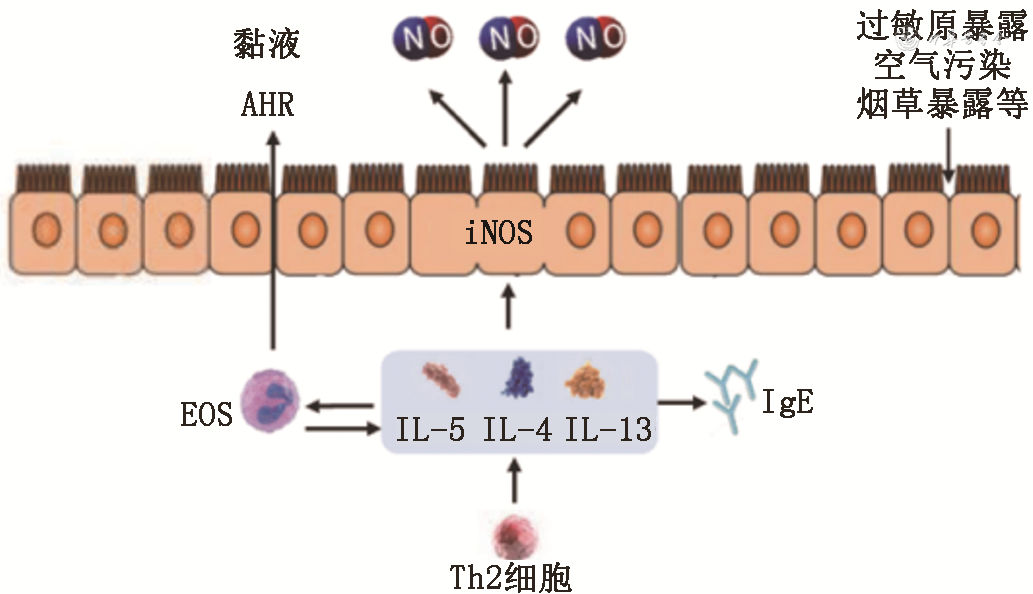

注:NO为一氧化氮;AHR为气道高反应性;iNOS为诱导型一氧化氮合成酶;EOS为嗜酸粒细胞;IL为白介素;IgE为免疫球蛋白E;Th2为辅助性T淋巴细胞2
哮喘是由多种炎症细胞和细胞组分参与的气道慢性炎症性疾病,这种慢性炎症导致气道高反应性(AHR)的发生和发展,引起广泛多变的可逆性气流受限及症状。EOS是哮喘气道慢性炎症主要的效应细胞,气道EOS浸润是哮喘病理学的主要特征。而FeNO作为哮喘气道T2炎症生物标志物之一,其升高与痰EOS增多及哮喘恶化相关[22, 23, 24, 25, 26, 27, 28]。
AHR指气管、支气管对内源性和外源性(包括物理、化学和免疫性)刺激呈现过强或过早的强烈和持久的收缩反应。AHR是哮喘重要的病理生理特征,气道反应性的高低不仅是诊断和排除哮喘的指标,也是评估哮喘病情严重程度和治疗效果的重要依据。有效抑制哮喘患者的慢性气道炎症,才能降低AHR,达到并维持哮喘的临床控制,避免急性发作,改善肺功能。研究显示,FeNO可以反映个体对过敏原或其他激发剂的反应,与气道炎症和AHR之间密切相关[20,29, 30, 31, 32, 33]。美国胸科学会(ATS)指南提出FeNO可作为AHR的替代指标[34]。评估FeNO,对于哮喘的诊断、治疗评估及预后判断均具有重要的意义。气道炎症与AHR及症状的关系如图2所示。

2017年欧洲呼吸协会(ERS)在2005年ATS/ERS 技术标准的基础上,对呼出气中的NO测定技术进行了更新[8]。目前,呼出气中NO测定的三项指标包括FeNO、鼻呼气NO(FnNO)及肺泡NO(CaNO),主要用来表示不同部位的气道炎症。鼻与口呼出气NO测定可以分别反映上气道与下气道炎症,低流速与高流速的口呼出气NO测定则可以分别检测大气道(气管、支气管)炎症与小气道(肺泡或腺泡区)炎症(表1)。

呼出气中的NO测定的三项检测指标
呼出气中的NO测定的三项检测指标
| 检测指标 | 简介 | 临床意义 |
|---|---|---|
| FeNO | Fractional concentration of exhaled NO,口呼出气NO的浓度(十亿分之一,即ppb)。呼出气流速单位是ml/s,在50 ml/s流速下的检测结果写为FeNO50,临床常以FeNO特指FeNO50 | 气管、支气管为主的大气道炎症 |
| CaNO | Concentration of alveolar NO,通过模型公式计算出的口呼出气NO的浓度(ppb) | 肺泡或腺泡区的小气道炎症 |
| FnNO | Fractional concentration of nasally aspirated/exhaled NO,鼻呼气NO的浓度(ppb)。呼出气流速单位是ml/s,流速通常用5 ml/s或10 ml/s,描述为FnNO5或FnNO10,临床简写为FnNO | 鼻腔及鼻窦为主的上气道炎症 |
注:NO为一氧化氮;FeNO为呼出气一氧化氮;CaNO为肺泡一氧化氮;FnNO为鼻呼气一氧化氮
呼出气中的NO测定包括呼气采样与呼气分析两个过程。呼气采样需要对呼气流速、压力与时间三项因素进行规范与监控;呼气分析主要包括准确性、稳定性与一致性三项质控指标[5]。呼出气中的NO测定分为在线、离线及潮气3种方式,适用于不同类型人群:(1)在线:一口气测定,采样过程对压力、流速、时间进行规范和监控,适用于≥6岁人群;(2)离线:多口气测定,采样过程可实现与在线相同的呼气规范和监控,适用于在线测定困难人群(如4~6岁儿童、老人等);(3)潮气:自由呼气,可在线与离线,采样过程中实现对呼吸频率、压力、流速、时间与CO2实时监控,适用于在线、离线测试均困难者(如婴幼儿及危重症患者)。
呼出气中的NO测定技术主要包括化学发光法和电化学法(也称为离子电量法,或电量法)。(1)化学发光法分析仪是通过NO与臭氧产生的化学反应来间接测量呼出气NO浓度,其灵敏度高[检测下限为0.1~0.5 ppb(ppb为十亿分之一)]、响应时间快(0.5~0.7 s)、可直接进行重复测量操作,被认为是 NO 呼气检测的标准方法。一般建议每日对仪器校零,每月使用高达2 000 ppb的校准气体进行流速校准,每年对化学反应转换器和臭氧发生器及外围部件进行检查。由于化学发光法分析仪器体积较大、价格昂贵且需频繁校准检查,限制了常规临床应用及家庭监测使用,主要用于临床研究。国内常见的化学发光分析仪有 NOA280i®(Sievers GE,美国)和 CLD 88sp®(ECO PHYSICS,瑞士)。(2)电化学分析仪则是通过将呼出气NO浓度转换为其他可测量的电信号,其检测下限为5 ppb,响应时间<10 s,整体重量<1 kg,具有便携且操作简单的优势,目前被广泛应用于临床常规检测。但该检测方法并不适用于多流速分析。电化学分析仪主要有Sunvou-CA2122®(尚沃医疗,中国)和 NIOX VERO®(原瑞典 Aerocrine公司,现被英国 Circassia公司收购)。
随着技术发展,一些小型传感器检测技术面世,如基于激光的光学传感器法、基于智能固态微传感器技术的智能呼吸健康诊断系统等[8,35]。基于激光的光学传感器法通过检测光源发出的光经过NO吸收而产生的强度变化检测低浓度NO,由于NO只对特定波长的光产生吸收,所以具有良好的选择性。但是,此检测器需在极低温度下才能正常工作,并不适合在实验室以外的地方使用。
1.下气道NO测定:FeNO测定时要求呼气压力至少达到5 cmH2O(1 cmH2O=0.098 kPa),从而确保软腭关闭,避免上气道NO的影响。口呼气流速一般为50 ml/s或200 ml/s,保持在±10%的流速范围内。呼气时间和呼气流速相关,流速越大,达到平台期的时间越短。在50 ml/s呼气流速下,5 s内可达到平台期;在200 ml/s流速下,达到平台期仅需要1~2 s[36]。为确保吸气时吸入的气体中NO浓度低于5 ppb,可以采用吸气过滤器[5]。具体测试步骤为:(1)受试者取坐位,平静呼吸;(2)操作者向受试者讲解呼气要求,为受试者更换新的有效期内的滤嘴。注意各接口紧密相连,防止漏气;(3)在静息状态下,受试者手持吸气过滤器,用滤嘴罩住口部,口部吸气2~3 s,立即以50 ml/s±10 %(或200 ml/s±10 %)恒定流速缓慢呼气;(4)当呼气流速低于或超过50 ml/s±10 %(或200 ml/s±10 %),引导受试者调整呼气力度;受试者呼气期间不可漏气、换气、憋气或喷出口水。如出现上述情况立即终止测试,待受试者恢复静息状态后,重复上述步骤;(5)采样成功后仪器自动分析,分析完成后自动生成测试报告。
传统的CaNO的计算根据线性模型和非线性模型两种计算模型的不同,有不同的测定计算方法。非线性模型需要采用一个低流速(≤20 ml/s)、一个中等流速(100 ml/s)和一个高流速(350 ml/s或400 ml/s)进行FeNO测定,每个流速测定两次取平均值,用平均值进行CaNO等参数的计算。线性模型需要先测定FeNO50,然后在最低流速(100 ml/s)和最高流速(350 ml/s或400 ml/s)中选择三个流速进行测定,每个流速测定两次取平均值[8]。以上传统方法在实际临床操作时存在一定难度,因此可以根据50 ml/s和200 ml/s流速下的FeNO50和FeNO200测定结果,通过简化版的线性模型公式计算得到CaNO,用于评估小气道炎症。
2.上气道NO测定:FnNO测定时,为了确保软腭关闭,需要保持口呼气压力≥10 cmH2O。推荐采样流速为0.25~3 L/min(4.2~50 ml/s)流速,可以确保在30 s内达到平台期[5,37]。在高流速下(例如50 ml/s)进行鼻抽气,受试者舒适度感受较差,且测试值较低,不利于临床诊断。目前临床常用的抽气流速为5 ml/s和10 ml/s。流速越小,达到平台期的时间越长。例如,在0.7 L/min流速下,可在第7秒达到平台期,在第7~10秒进行采样分析[38]。而在5 ml/s流速下,测定需要20~30 s[39, 40]。抽气时间较长,配合口呼气压力≥10 cmH2O,在临床实际操作时存在难度。根据2019年鼻科共识推荐0.7 L/min流速下抽气10 s的重复性更好[41]。因此国内鼻呼气测定多采用10 ml/s流速抽气,同时在抽气过程中受试者需吹响口哨以确保口呼气压力≥10 cmH2O。
具体测试步骤为:(1)受试者取坐位,平静呼吸;(2)操作者向受试者讲解呼气要求,为受试者更换新的鼻呼头。注意各接口紧密相连,防止漏气;(3)受试者鼻塞时,需清洁鼻孔或洗鼻,鼻部畅通后测试;(4)在静息状态下,受试者将鼻呼头堵紧一侧鼻孔,另一鼻孔保持畅通;口含口哨,口部深吸气后将口哨吹响从而保持软腭关闭,并保持不要换气,由仪器恒速(10 ml/s)抽气10 s;(5)当受试者测试过程中间换气即口哨声音中断,立即终止测试,待受试者恢复静息状态后,重复上述步骤;(6)采样完成后仪器开始分析,分析过程中保持呼气管连接鼻呼过滤器;分析完成后,仪器自动生成测试报告。
目前常用的是2011年ATS推荐的FeNO“正常参考值”:健康儿童 5~20 ppb,成人 5~25 ppb[7]。2017年ERS推荐成人FeNO值在25~50 ppb(儿童FeNO值在20~35 ppb)时需结合其具体临床背景进行判断[8]。中国人FeNO正常值全国多中心研究提出中国健康儿童及成人的FeNO正常参考值:健康儿童(6-14岁)5~24 ppb,成人5~30 ppb[42],较欧美推荐的正常参考值均偏高,考虑可能与种族有关。FeNO测定结果受多种因素的影响,不同研究显示的敏感度和特异度差别较大。关于CaNO、FnNO的“正常参考值”目前研究较少,临床实用性尚未得到印证。
1.影响因素:年龄等生理因素:(1)FeNO:儿童FeNO值与年龄正相关[43, 44],成人FeNO值与年龄的关系仍有争议。中国多中心研究提示,FeNO值与年龄、性别及地区差异均存在相关性[42,44]。男性FeNO值高于女性,可能是由于生理差异、男性与吸烟者接触较多、自身环境暴露、生活习惯差异等原因。关于生理因素对FeNO值的影响,技术标准与指南并未达成一致意见,因此进行FeNO测试时,可以不考虑生理因素的影响。(2)CaNO:性别和身高对CaNO值影响不大,但成人的CaNO值和年龄正相关[37,45]。可能是由于随着年龄的增加,肺远端气体扩散能力逐渐降低[37]。(3)FnNO:儿童FnNO值与年龄正相关[38]。但目前尚无研究报道性别、年龄、身高与成人FnNO值存在相关性。
饮食:NO除了通过一氧化氮合酶催化L-精氨酸产生,还可以通过口腔和胃中的细菌还原亚硝酸盐产生。摄入富含硝酸盐的食物,如菠菜、莴苣、西蓝花、萝卜等会升高FeNO值[5,46],对CaNO值和FnNO值影响较小[45,47]。因此欧美及日本指南推荐测试前1 h禁食[5,7,48]。但是,中国饮食包括米面、蔬菜、肉类,还有一些腌制烧烤食品,硝酸盐/亚硝酸盐含量更高,分解产生的NO与FeNO更高,降到饮食前浓度水平所需时间更长。多项研究发现,FeNO值在高硝酸盐含量的饮食后2 h达到高峰,升高约60%(25~50 ppb),之后逐渐下降[46]。因此,中国饮食的禁食要求应比欧美日本更加严格,推荐测试前3 h禁食。酒精、咖啡、糖(果糖)和脂类食物可能会降低FeNO值[48]。因此,测试前1 h禁止喝酒、咖啡等饮品。
烟草暴露:长期吸烟或被动吸烟使FeNO值降低,可能原因是烟草抑制了NO合酶活性或者组织缺氧。2014欧洲共识指出主动或被动吸烟使FeNO值降低30%~60%[49],日本呼吸学会(JRS)指南指出主动或被动吸烟使FeNO值降低约30%[48]。但短期主动或被动吸烟对FeNO影响的研究结果并不一致,一项研究认为香烟中含有大量NO,使得FeNO值瞬间升高[50]。另外两项研究则认为烟草烟雾中含有高浓度的超氧化物,会与NO迅速反应生成活性氮,反而使FeNO值降低[16,51]。此外,吸烟对FnNO值影响较小[52],对CaNO值的影响仍有争议[45]。因此,测试前1 h禁止主动和被动吸烟,并记录长期主动或被动吸烟史。
感染:呼吸道感染可使得FeNO值急剧性升高[5],感染恢复期下降[7,48]。但感染对FeNO值升高的影响程度通常低于2型炎症,多在25~50 ppb。研究发现肺结核患者的FeNO200值显著高于对照组且治疗后下降到正常水平,比FeNO50指导诊疗的临床价值更大[53]。鼻病毒感染可使FnNO值升高[52]。故建议避免感染急性期进行呼出气的NO检测。
药物:糖皮质激素、奥马珠单抗、NO合酶抑制剂、白三烯受体拮抗剂等药物通过抑制2型炎症通路使FeNO值降低[7,49],改变气道内径的药物也可影响FeNO值,当吸入组胺和高渗盐水引起气道收缩,气道扩散面积减少、气道壁增厚,导致NO的弥散速率降低,可使FeNO值降低。使用支气管舒张剂时FeNO值会升高[48]。此外抗组胺药、减充血剂、生理盐水冲洗等也会降低FnNO值[52]。因此,测试前应记录受试者的用药情况。
运动:关于运动对FeNO值影响的研究报道尚有争议,有研究表明健康人和哮喘患者有氧运动可使FeNO值降低约10%[54, 55],也有相关研究表明运动对FeNO值无明显影响[56, 57]。一项研究表明在运动过程中FeNO值及FnNO值有所下降,且该影响持续约1 h[58]。因而为保证检测结果的准确性,测试前1 h应避免剧烈运动[5]。
相关呼吸诊疗操作:(1)肺功能:肺量计检查已被证明可瞬间降低FeNO值,大约在1 h内可恢复[5,48]。但FeNO值降低的原因尚不明确,考虑可能原因是气道关闭抑制了NO气体的输出[59]。因此FeNO测试应在肺功能检查前进行。(2)支气管激发试验:支气管激发试验通过化学、物理、生物等人工刺激诱发气道平滑肌收缩,改变气道内径,可使得FeNO值下降[48,60]。(3)雾化吸入治疗:多项研究表明雾化吸入治疗扩张支气管内径可使得FeNO值升高[5,48,60]。因此,建议测试前1 h避免进行相关呼吸诊疗操作。
昼夜节律:昼夜节律对FeNO值产生影响的研究报道较少。两项研究表明FeNO水平昼夜无明显变化[61, 62]。另两项研究表明相比健康人及哮喘控制好的患者,哮喘控制较差的患者FeNO值的昼夜波动更大[63, 64]。
月经与妊娠:月经周期对FeNO值影响的研究报道尚存在一定争议,有研究表明控制良好的哮喘患者月经期间FeNO值无明显变化[65]。亦有研究表明FeNO值在月经周期中随着雌激素及孕酮水平的变化而变化,雌激素水平升高与FeNO值降低有所关联,孕酮水平升高与FeNO值升高有关[66, 67]。妊娠及妊娠周期对FeNO水平无明显影响[68, 69]。
2.质量控制
(1)测试前准备的质量控制:测试环境:呼出气NO分析仪应在生产厂家建议的工作环境中使用,避免高温、闷热、拥挤的环境,避免阳光直射以及紫外线灯照射;测试时分析仪工作温度与环境温度相差<3 ℃。分析仪要远离各类污染源(或交通要道),尤其是汽车尾气、废气等重污染环境。鉴于医院的特殊应用环境,在电化学分析仪的日常使用过程中应避免使用酒精类消毒剂、洗手液等化学品,否则长期使用可能会使电化学传感器受损,NO测试结果偏低。可选择使用非酒精类消毒剂,如医院常用的84消毒液等。
受试者准备:在测试前应排除饮食、饮酒、吸烟、运动等影响因素。采样前1 h内避免饮食、烟酒、剧烈运动、肺功能或其他测试,3 h内避免食用西兰花、芥蓝、生菜、莴苣、芹菜、萝卜以及熏腌制或烧烤类等富含硝酸盐或亚硝酸盐食品。同时询问并记录测试时间、用药等情况[5,7, 8,49]。
(2)采样过程的质量控制:下气道采样过程:下气道采样分为口部呼气-口部吸气-口部呼气三个步骤[5]。①口部呼气(口呼尽肺内余气):呼尽肺内余气是为了避免死腔环境NO气体的影响,但根据2017年技术标准,此步骤不影响结果,所以该步骤也可不采用。②口部吸气(口吸入不含NO或NO<5 ppb的气体):测定时需避免环境NO可能对测试结果的影响,可采用吸入不含NO(或NO<5 ppb)的钢瓶气或通过高锰酸钾过滤器的环境气两种方式实现。③口部呼气:合格的呼出气NO采样器或分析仪应该具有对呼气压力、呼气流速、时间三项指标进行质控的功能。对于不符合要求的呼气不采样不分析,并且应具有可外接模拟呼出气对这三项指标进行外部质检的功能。呼气过程最常见的问题是呼气时漏气。漏气时受试者部分呼气样本未进入分析仪内部,使得受试者呼气流速实际大于分析仪设定的质控指标,从而造成分析仪呼出气NO测试结果偏低。下气道测定用的滤嘴或咬嘴分为口含式和口罩式。口含式咬嘴容易让受试者部分呼气从咬嘴外呼出造成漏气,而采用口罩式滤嘴可以防止漏气,而且无需口含更加安全。
上气道采样过程:合格的呼出气NO采样器或分析仪应该内设恒定的采样流速,采样时间应根据流速设定并保证,同时采样过程需保证口部呼气压力>5 cmH2O,避免下气道气体混入。推荐采取阻力法测试,例如采用口含口哨保持吹气的方式配合[5]。另外,上气道测定应用鼻塞堵住一侧鼻孔,避免漏气。如出现漏气,会混入环境气,影响测试的样本质量。
(3)分析过程的质量控制:分析过程的质量控制包括准确性、稳定性与一致性。合格的呼出气NO分析仪应该具有对这三项指标进行质控的功能,并具有可外接模拟呼出气组成和至少三个已知NO浓度的标准气,对这三项质控指标进行外部质检的功能[5]。
根据2005年与2017年欧美呼出气NO技术标准,化学发光分析仪的定标频率是每周一次,而对出厂标定的电化学分析仪,对定标及其频率并无要求。电化学分析仪因传感器内含次数较少,短时间内会进行传感器更换,所以生产厂家保证出厂进行预校准后,在其产品说明书规定的运输、存储及使用条件下,能够在规定次数或有效期内保证其准确性和重复性,无需校准[5,8]。但因客户应用环境可能超出产品说明书规定的运输、存储及使用条件,或用户提出质控要求时,分析仪应具备客户现场可以检验校准的方法,供客户选择使用。
FeNO作为一种反映气道炎症的生物学指标,具有测定简便、重复性好、非侵入性等优点,临床应用越来越广泛。过去主要用于哮喘炎症的评估,近年在哮喘的诊断和管理等诸多方面都获得了显著的进展。
1.哮喘的诊断:目前临床诊断哮喘最常用的辅助检查均是对呼吸生理功能的测定,包括支气管激发试验、支气管舒张试验及呼气流量峰值(PEF)监测。但即使上述检查是阳性结果,也不是哮喘所独有的病理生理改变。所以,这些检查都不是哮喘诊断“金标准”,还需结合患者的临床表现综合判断和诊断。
虽然哮喘是一种慢性气道炎症性疾病,但全球哮喘防治创议(GINA)和中国哮喘指南均未推荐FeNO用于辅助哮喘诊断。一方面是由于FeNO水平升高并不一定是哮喘,例如嗜酸粒细胞性支气管炎、过敏性鼻炎、鼻息肉、EOS增多症都可导致FeNO水平升高。另一方面,非EOS性炎症的哮喘FeNO水平不会升高。此外,许多因素都可能影响FeNO的测定值(参见本共识相关内容)。
近年来国内外进行了大量关于FeNO诊断价值的临床研究。研究显示,如果FeNO的诊断截点设为9~15 ppb,灵敏度可以达到85%~96%,但是特异度仅为13%~48%。如果诊断截点提高到47~76 ppb,则诊断的特异度可以提高到88%~100%,但灵敏度则显著降低至13%~56%[70, 71, 72, 73]。可以看出,FeNO值越高诊断准确性越高。如果FeNO诊断截点设为≥40 ppb,诊断哮喘的准确性超过90%,这样的准确性不亚于支气管激发试验。只是诊断的灵敏度太差,会漏诊大量的患者,不宜单独用于诊断。
虽然支气管激发和舒张试验在诊断哮喘的特异度和灵敏度上均优于FeNO检测,但在我国有不少地区未开展支气管激发试验,而舒张试验对肺功能正常的患者诊断价值有限。相比之下,FeNO检测简便易行,技术要求低,基层医疗机构容易开展,可以作为哮喘诊断的补充工具。英国国家卫生与临床优化研究所(NICE)指南推荐,FeNO结合其他哮喘辅助检查可以作为哮喘诊断的参考指标。诊断截点为:成人≥40 ppb,儿童≥35 ppb[74]。
由于影响FeNO水平因素较多,在用于哮喘诊断时,需要尽量避免干扰因素,结合患者的病史、临床表现、治疗反应等因素综合判断。
2.哮喘的炎症分型:根据哮喘发病的免疫学机制不同及体内Th2细胞因子水平的高低,哮喘可被分为2型炎症和非2型炎症。2型炎症常用的生物标志物有诱导痰和外周血EOS数、FeNO、血清IgE和骨膜素水平等[75]。研究显示,诱导痰EOS检测识别2型炎症的准确性最高,其次为FeNO和外周血EOS,最差为血清IgE和骨膜素水平[76]。虽然诱导痰识别2型炎症的特异性最好,但是技术难度较大,推广困难。外周血EOS计数最为简便,但是与诱导痰EOS相关性差,不能很好地反映气道嗜酸粒细胞性炎症。研究显示,对于未使用吸入糖皮质激素(ICS)的成人或儿童哮喘,FeNO与痰液、支气管肺泡灌洗液、肺组织中的EOS有中-低度的显著相关性,可以反映哮喘气道的EOS性炎症[33,77]。
2011年ATS指南将FeNO列为气道EOS性炎症标志物,其FeNO水平判断标准为:成人<25 ppb,儿童<20 ppb,可初步排除EOS性炎症;成人>50 ppb,儿童>35 ppb,提示EOS性炎症的可能较大;成人25~50 ppb,儿童20~35 ppb,考虑可能为EOS性炎症[7]。2016年欧美过敏性疾病的精准医疗共识推荐FeNO作为哮喘2型炎症的生物标志物,除了ICS,还可以指导抗IL-5、抗IL-13、抗IgE等单抗药物的治疗[75]。
虽然目前尚无指南推荐CaNO在哮喘的应用,但越来越多研究开始关注小气道NO的临床应用。研究发现,重症哮喘患者(包括夜间发作型哮喘)CaNO升高[78, 79, 80]。对有症状的哮喘患者,CaNO与血EOS正相关,且与小气道肺功能参数(FEF50%和FEF75%)负相关,CaNO升高可提示小气道障碍[80]。存在小气道炎症的哮喘患者,在使用口服激素或超微颗粒ICS后,CaNO值降低,进一步证明了CaNO作为评价小气道炎症指标的价值。常规ICS虽然对大气道NO有改善,但是对CaNO改善并不明显。加入口服孟鲁司特治疗对CaNO改善有帮助,但是单独使用孟鲁司特则疗效不佳[81]。由此可见,CaNO有助于指导常规ICS、超微颗粒ICS、口服糖皮质激素(OCS)及其他抗炎治疗措施的使用。
3.哮喘的长期治疗和管理
(1)预测ICS治疗的反应性:通常,EOS性炎症对ICS治疗反应良好。由于FeNO间接反映了气道EOS性炎症水平,推测高FeNO可预示对ICS治疗反应良好。研究证实,基线高FeNO水平可以预测ICS治疗后症状和肺功能改善[82, 83]。荟萃分析亦显示,没有使用过激素治疗的哮喘患者中,基础FeNO水平高的患者通常具有对ICS更好的治疗反应[84]。对于没有确诊为哮喘,但有持续呼吸道症状的患者,测定FeNO水平也有助于预测ICS治疗的反应性[85]。FeNO>47 ppb的患者对ICS的治疗反应性良好,症状、PEF和气道高反应性等指标的改善更优,而且治疗反应性与诊断无关[86]。但不同研究中预测ICS治疗反应性的FeNO截点值并不统一。
(2)预测哮喘急性发作:对无症状哮喘儿童停用ICS后连续监测FeNO水平,观察与哮喘急性发作的关系。结果显示,ICS停药后第四周,哮喘发作与未发作患儿的FeNO水平表现出显著差异,分别为40.8 ppb和15.9 ppb。如果以FeNO为49 ppb作为截点,其预测哮喘发作的灵敏度为71%、特异度为93%。高水平的FeNO可以作为预测哮喘发作风险的指标,而症状评分、PEF、PEF变异率等临床指标却不能预测哮喘发作风险[87]。联合FeNO与肺功能检测来预测哮喘的急性发作风险的研究显示,FeNO≥28 ppb且第1秒用力呼气容积(FEV1)≤76%的患者,虽然当前临床稳定,但之后有85%的患者出现哮喘急性发作。而FeNO<28 ppb并且FEV1≥76%的哮喘患者则没有出现哮喘急性发作[88]。综上所述,高FeNO水平是预测哮喘发作风险升高的重要指标之一。但是影响哮喘发作的因素较多,临床上结合肺功能、症状等多项指标来预测哮喘急性发作可能会更为理想。
(3)评估哮喘控制水平:气道慢性炎症是哮喘的本质及哮喘症状反复发生的病理生理基础,但目前哮喘控制水平评估依据的是GINA推荐的标准,即症状、缓解药物使用及活动受限情况,并没有炎症指标。研究报道,未控制和部分控制的成人和儿童哮喘有更高的FeNO水平。肺功能更好、哮喘控制水平高的哮喘儿童,FeNO水平更低[89]。荟萃分析也显示,哮喘控制状态与FeNO水平有低度的显著相关性。但也有研究提示,使用ICS治疗后,FeNO水平与哮喘控制的相关性较差。还有研究报道,哮喘症状的变化与肺功能和FeNO的改变并不完全一致[90]。结合前述的无症状患者使用PEF、症状评分不能很好地预测哮喘急性发作[87],所以按照GINA推荐的临床指标,即便患者达到哮喘控制标准,并不意味气道炎症也得到完全控制,仅用症状和肺功能来评估哮喘的控制状态可能并不全面。FeNO检测可能有助于更加全面地评估哮喘控制水平,但是还不能确定不同哮喘控制水平的FeNO截点值,目前国内外也没有相关指南推荐其用于哮喘控制的评估。
(4)指导治疗方案调整:目前指导哮喘控制治疗方案调整依据的是 GINA推荐的临床症状、急性发作和肺功能等指标,不包括气道炎症指标。Powell等[91]以妊娠期哮喘患者为研究对象,根据哮喘控制问卷(ACQ)或ACQ联合FeNO水平(以29 ppb为截点)的方法指导升降级治疗。结果发现,ACQ联合FeNO组急性加重率为25%,而ACQ组急性加重率为41%,且ACQ联合FeNO组ICS用量更低。该研究表明对妊娠期哮喘这种特殊情况患者的治疗,采用FeNO检测指导治疗,患者可以有更好的获益。近年来,有数项研究探讨以诱导痰EOS或FeNO水平作为调整ICS剂量的依据,以指导哮喘治疗[92, 93]。依据FeNO水平与依据常规临床指标调整哮喘治疗的策略相比较,基于FeNO的治疗策略能够在相同或更低的ICS剂量下维持更好的哮喘控制,并减少50%的哮喘急性加重。也有荟萃分析显示,使用FeNO水平指导治疗可以显著降低哮喘急性发作率,但是对症状评分、ICS使用剂量等无显著改变。
(5)判断ICS治疗的依从性:对ICS治疗的依从性差是部分哮喘控制不佳的重要原因,而对ICS治疗的患者监测FeNO水平可以帮助判断治疗依从性。通过连续监测ICS治疗的哮喘儿童FeNO水平发现,FeNO值的升高与依从性降低显著正相关,而肺功能则不能反映出这种变化。为更准确反映ICS治疗的依从性,McNicholl对难治性哮喘患者(FeNO>45ppb)给予直接观察下的高剂量ICS治疗,并每天检测FeNO水平。结果显示,试验前依从性差的患者经直接观察下的高剂量ICS治疗后FeNO水平会显著地降低,而试验前依从性好的患者FeNO则无明显变化[94]。这种判断ICS治疗依从性的方法称为FeNO抑制试验(FeNO suppression test)。因此,在哮喘长期管理中对高水平FeNO值应考虑是否存在治疗依从性差的问题,监测FeNO水平有助于判断患者对ICS治疗的依从性。
(6)重症哮喘的管理:2019GINA发布的《成人和青少年难治性哮喘和重症哮喘的诊断和管理》中,将过去的重症哮喘重新分类为“难治性哮喘(difficulty-to-treat asthma)”和“重症哮喘(severe asthma)”两种类型。前者指那些因为依从性差、吸入装置使用不当、合并症等原因导致的哮喘治疗困难。后者指排除了以上原因的影响,是“真正”难治的患者。前面已经介绍测定FeNO水平可以作为发现依从性差的工具[94]。对真正难治的重症哮喘,重症哮喘指南推荐的处理流程首先需要区别是否为2型炎症哮喘,其标准为经过高剂量ICS或全身激素治疗后,FeNO≥20 ppb或外周血EOS≥150个/μl或诱导痰EOS≥2%。对2型炎症重症哮喘的治疗,目前国内外有数种生物靶向治疗药物,如抗IgE、抗IL-5/IL-5R和抗IL-4R单抗可以选择,大多以血清IgE水平和外周血EOS作为使用药物的参考指标。但有研究显示,FeNO水平高的患者同样可以在抗IgE单抗等治疗中获得比低FeNO水平患者更好的治疗反应性[95]。在使用抗IL-4R单抗dupilumab治疗中-重度未控制哮喘的临床研究中,FeNO≥25 ppb的患者获益显著大于安慰剂治疗,而且FeNO水平越高疗效越好。所以,FeNO检测既可以作为判断2型炎症重症哮喘的指标,也可以作为选择靶向治疗的参考。
综上所述,FeNO作为一项简便的2型炎症评价指标,在哮喘诊断和治疗管理等方面显示出独特的优势,其对于激素治疗期间哮喘管理的意义如表2所示。

FeNO检测对于激素治疗期间哮喘管理的意义
FeNO检测对于激素治疗期间哮喘管理的意义
| FeNO水平 | 成人<25 ppb(儿童<20 ppb) | 成人25~50 ppb(儿童20~35 ppb) | 成人>50 ppb(儿童>35 ppb) |
|---|---|---|---|
| 炎症已控制 | 炎症未控制 | ||
| 有症状 | •对增加ICS反应性差 •其他诊断/合并诊断 | •依从性差/吸入技术差 •ICS剂量不足 •未经治疗的小气道疾病 •持续过敏原暴露 •罕见:激素抵抗 | •依从性差/吸入技术差 •ICS剂量不足 •未经治疗的小气道疾病 •持续过敏原暴露 •罕见:激素抵抗 |
| 无症状 | •足够的ICS剂量 •依从性好 •可以减少ICS剂量 | •潜在未控制的气道炎症 •监测FeNO和症状水平的变化 •不要减低激素剂量,除非患者无症状且FeNO水平持续稳定 •已控制的炎症 | •依从性差/吸入技术差 •表明有未控制的气道炎症,接下来可能导致症状和急性加重的风险 •不能减少/停止ICS,否则会引起复发,需评估FeNO趋势 •持续过敏原暴露 |
注:FeNO为呼出气一氧化氮;ICS为吸入糖皮质激素;ppb为十亿分之一
慢性咳嗽是指以咳嗽为主要或唯一症状,病程≥8周,胸部影像学无明显异常者。常见病因包括咳嗽变异性哮喘(CVA)、上气道咳嗽综合征/鼻后滴流综合征(UACS/PNDs)、EOS性支气管炎(EB)、胃食管反流性咳嗽(GERC)和变应性咳嗽(AC)等。各种病因导致的慢性咳嗽均存在气道炎症,其中CVA、EB和部分过敏性鼻炎导致的UACS表现为EOS性气道炎症[96]。FeNO作为反映下气道炎症的一种新型生物标志物,与诱导痰中EOS比例呈中度正相关,近年来已逐渐应用于CVA、EB等慢性咳嗽的病因辅助诊断和治疗指导。
1.慢性咳嗽患者的FeNO水平:慢性咳嗽患者FeNO水平因病因不同而有所差异。慢性咳嗽的气道炎症可分为EOS性气道炎症和非EOS性炎症(中性粒细胞、肥大细胞、淋巴细胞等),前者见于CVA和EB等,后者包括GERC和UACS等。目前比较一致的认识为CVA和EB的FeNO水平明显高于其他慢性咳嗽患者[97, 98],而GERC和非过敏性鼻炎导致的UACS的FeNO则多正常,但也有不一致的例外情况发生。多数研究显示,CVA患者FeNO水平(41~61ppb)高于EB患者(31~35ppb),提示两者气道炎症程度有一定差异,可能与下气道上皮受累的范围有关[99, 100]。当CVA合并过敏性鼻炎或伴有过敏性疾病家族史和过敏原接触史时,FeNO水平将会更高[101]。
2.FeNO对慢性咳嗽病因的鉴别诊断价值:FeNO增高有助于辅助诊断CVA和EB,可用于慢性咳嗽病因的鉴别诊断,得到了新版中国、美国、韩国、欧洲咳嗽诊治指南的推荐[96,99,102, 103]。临床研究显示,慢性咳嗽患者FeNO值分别>33~40 ppb或>22~31ppb时,CVA和EB的可能性大[98]。荟萃分析显示,FeNO诊断CVA的准确性为中等,但能否用于EB诊断尚待进一步研究[104, 105]。欧洲咳嗽指南也认为FeNO对CVA和EB等有一定预测价值,但还需要高质量的临床研究证实。中-高水平的FeNO适用于诊断CVA,但FeNO正常也不能完全排除CVA,且FeNO间接反映EOS性气道炎症,并不能确定患者是否有气道高反应性。此外,虽然慢性咳嗽患者明显增高的FeNO以CVA多见,但由于CVA和EB的FeNO值相互重叠,仅通过FeNO无法鉴别CVA和EB,两者鉴别有赖于气道反应性或可逆性气流受限的测定。
鉴于CVA患者肺通气功能大多正常,而小气道功能常异常,国内开展支气管激发试验又不普遍,FeNO联合小气道功能测定诊断CVA有了一些临床探索。FeNO升高伴有最大呼气中期流量(MMEF)降低,对支气管激发试验阳性有很好的预测价值,便于CVA与慢性咳嗽其他病因相鉴别[106, 107]。对某些特殊类型患者,如儿童或者合并过敏性鼻炎的慢性咳嗽患者,FeNO联合MMEF检测比单纯FeNO诊断CVA的敏感性和特异性更高[108, 109]。因此,FeNO结合小气道功能检测可以作为鉴别CVA和EB的指标,但其临床价值和意义不如支气管激发试验。
基于FeNO检测的慢性咳嗽诊治流程见图3。
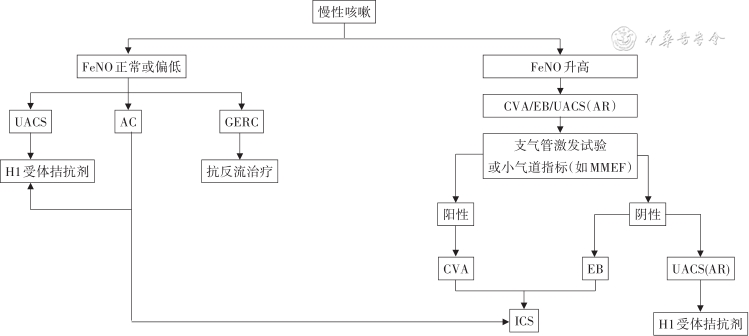

注:FeNO为呼出气一氧化氮;UACS为上气道咳嗽综合征;AC为变应性咳嗽;GERC为胃食管反流性咳嗽;CVA为咳嗽变异性哮喘;EB为嗜酸粒细胞性支气管炎;AR为过敏性鼻炎;MMEF为最大呼气中期流量;ICS为吸入糖皮质激素
3.FeNO在预测激素敏感性慢性咳嗽和随访管理中的价值:慢性咳嗽常见病因中CVA、EB和AC对ICS治疗反应好,称为激素敏感性咳嗽(CRC)。除AC外,CRC患者FeNO水平显著高于对激素不敏感的慢性咳嗽[97, 98,110]。FeNO>31.5 ppb,判断CRC(不包括AC)特异性较高而敏感性中等。当患者具有高FeNO水平、诱导痰EOS比例增高(>2.5%)或特应质的三者之一,则预测CRC的敏感性高,但特异性低[98]。不同研究中FeNO用于诊断CRC的临界值差异很大,从22~58 ppb[111],FeNO值正常也不能完全排除患者对ICS或白三烯受体拮抗剂治疗有效[112]。由于AC不存在EOS性气道炎症,不适合用FeNO来预测AC患者对激素的治疗反应。
FeNO在哮喘的治疗随访中可指导ICS的剂量调整,效果优于传统根据症状评估的管理策略。FeNO在慢性咳嗽中的应用可参照哮喘管理方法进行,但尚缺乏研究数据支持。
4.FeNO用于慢性咳嗽诊治的优缺点:FeNO检测无创、简便,可部分替代诱导痰细胞分析,辅助诊断CVA和EB,有助于与慢性咳嗽其他病因相鉴别,并预测慢性咳嗽患者对激素治疗的反应。但缺点在于不能单独依靠FeNO诊断CVA或EB,也无法鉴别两者。FeNO与诱导痰EOS比例相关性不是很高,无法完全取代诱导痰细胞分析。CVA也并非均存在EOS性气道炎症,而AC的发生也与EOS性气道炎症无关,因此,FeNO正常并不能完全排除上述病因激素治疗的有效性。
健康人呼气中的NO多数来源于上气道,仅少部分由下气道产生,上气道NO水平可达下气道100倍以上。因此,NO在上气道疾病的研究亦备受关注,尤其是FnNO与部分上气道疾病密切相关。
1.过敏性鼻炎(AR):AR是IgE介导的最常见的非感染性慢性鼻炎,全球患病率10%~25%,我国的发病率不同地域差异较大,达4%~38%[113]。大量研究证实AR患者过敏原刺激鼻黏膜产生大量炎症因子,使局部iNOS活性增加,合成大量NO,使得AR患者的FnNO水平显著高于健康人。但也有研究发现AR患者的FnNO浓度与健康人相比无显著差异,原因可能为鼻腔黏膜水肿,造成鼻窦窦口堵塞,导致NO从鼻窦到鼻腔流通受阻所致。
FeNO在AR患者中亦较健康人群显著升高,且与鼻炎严重程度呈正相关,经过鼻激素或联合白三烯受体拮抗剂治疗后FeNO可有一定程度降低[114]。AR患者FeNO水平越高,合并气道高反应性和发展成哮喘的可能性也越大[115]。哮喘合并AR时,FeNO值比一般的哮喘更高,因此疑诊伴AR的患者为哮喘时,要考虑FeNO增高的因素部分可能来源于鼻部[107]。
因此,FnNO有助于对鼻部炎性疾病的诊断和评估,FeNO对下气道炎症水平评估和AR患者预后判断也有一定价值[116]。
2.非过敏性鼻炎(NAR):NAR患病率为9.6%~19%,约占鼻炎总数的1/3。与健康人相比,AR组的FnNO升高,而NAR组的FnNO水平无明显变化[117]。但代表下气道炎症的FeNO水平在NAR患者可高于健康人而低于AR患者[118, 119]。NAR患者FeNO值与病情严重程度相关,中重度NAR患者FeNO水平高于轻度NAR者[120]。
3.慢性鼻窦炎(CRS):CRS患者的平均FnNO水平低于正常人[121],合并鼻息肉者FnNO水平更低,局部炎症水平与FnNO水平负相关[122]。原因可能为鼻窦炎黏膜水肿导致窦口阻塞、鼻腔充血及鼻窦腔内黏液积聚使患者FnNO降低。降低的FnNO可随鼻窦感染的控制而恢复正常,因此检测FnNO可作为一项CRS治疗效果的辅助判断指标[123]。
CRS患者的FeNO水平比慢性鼻炎更低[124],EOS性CRS的FeNO水平高于非EOS性CRS[125],而合并鼻息肉CRS的FeNO水平高于正常人[126]。可见,CRS患者FeNO水平差异较大,对CRS的临床应用价值有限。
4.鼻息肉:鼻息肉是鼻部慢性炎症所致,合并鼻息肉的CRS患者FnNO值低于无鼻息肉的CRS患者,因此FnNO可用作区分CRS是否伴鼻息肉[127]。同样,伴有鼻息肉的AR患者FnNO水平也明显低于单纯AR患者,可能与鼻窦口阻塞使鼻窦内NO未能到达鼻腔有关[128]。鼻窦CT扫描显示鼻息肉阻塞鼻窦窦口越严重,FnNO值也越低。因此,FnNO水平可作为评估鼻息肉是否缩小的辅助手段。
5.原发性纤毛不动综合征(primary ciliary dyskinesia,PCD):PCD属常染色体隐性遗传的纤毛运动障碍,临床特征为上呼吸道症状(嗅觉丧失、鼻窦炎、慢性扁桃体炎)及男性不育等,有支气管扩张、慢性鼻窦炎和内脏转位三联征者又称为Kartagener综合征,为PCD的一个亚型。临床诊断比较困难。确诊需要电镜证实鼻黏膜纤毛外动力蛋白臂缺失和缩短等超微结构缺陷或检测到DNAH11等基因突变。PCD患者的FnNO值极低,<77 ppb为重要的临床筛查指标[129]。
综上所述,上气道疾病中过敏性鼻炎FnNO升高,但当鼻窦口被肿胀的黏膜或其他因素阻塞时FnNO值下降,而PCD的FnNO明显低于正常水平。上气道疾病亦会影响FeNO水平,当哮喘患者经规范ICS治疗后FeNO仍偏高,需要鉴别是疾病未控制,还是AR等其他因素造成。不同上气道疾病的FnNO和FeNO水平比较见表3。

不同上气道疾病的FnNO和FeNO水平比较
不同上气道疾病的FnNO和FeNO水平比较
| 气道NO | 过敏性鼻炎 | 非过敏性鼻炎 | 慢性鼻窦炎 | 原发性纤毛不动综合征 |
|---|---|---|---|---|
| FnNO | ++ | - | -- | --- |
| 可能影响因素 | 黏膜肿胀,鼻窦口阻塞 | 局部炎症越明显FnNO越低 | ||
| FeNO | ++ | + | - | |
| 可能影响因素 | 鼻炎严重程度 | 鼻炎严重程度 | 合并鼻息肉或嗜酸粒细胞性CRS可升高 |
注:NO为一氧化氮;FnNO为鼻呼气一氧化氮;FeNO为呼出气一氧化氮;CRS为慢性鼻窦炎;++为显著升高;+为升高;-为无明显升高;--为低于正常;---为显著低于正常
COPD简称慢阻肺,以持续性呼吸道炎症和气流受限为主要特征[130],由于COPD患者急性期、稳定期、并发症有无等不同病理状态会影响FeNO水平而限制了FeNO检测技术在COPD的临床应用[131]。近年来,随着模拟肺内NO气体交换动力学模型的构建,肺泡或腺泡区NO浓度(CaNO)、气道壁组织NO浓度(CawNO)、NO弥散速率(DawNO)以及气道室NO总通量(JawNO)等更多信息的获取及研究的深入[132, 133, 134, 135],FeNO检测技术在COPD的临床应用也日渐受到重视[48,136, 137, 138]。
1.气道炎症判断及哮喘-慢阻肺重叠(ACO)鉴别:多中心研究显示我国健康成人FeNO界值为5~30 ppb[42]。非吸烟COPD患者平均FeNO和平均CaNO显著高于健康人,提示FeNO检测有助于COPD患者气道炎症的判断[137,139, 140],特别是CaNO不受吸烟影响,在COPD中较FeNO具有更好的应用性,可能是COPD患者小气道功能障碍的良好标志物[141]。
研究发现,痰或血EOS增多的COPD患者其FeNO水平显著高于痰或血EOS少的患者,且两者之间显著相关,提示FeNO可作为判别COPD EOS性气道炎症的良好指标[142, 143, 144, 145, 146, 147]。
ACO患者FeNO水平较单纯COPD、COPD合并慢性支气管炎、COPD合并肺气肿患者更高,FeNO可作为辅助方法用于ACO与其他 COPD表型的鉴别诊断[48,136,148, 149, 150, 151, 152, 153, 154, 155]。
2.预测ICS治疗的反应及疗效:预测COPD个体对ICS的治疗反应以决定是否使用ICS尤显重要。研究发现,FeNO>25 ppb的不吸烟或已戒烟的COPD患者对ICS治疗反应好,患者基线FeNO浓度与ICS治疗后FEV1的增加显著正相关,提示FeNO可作为非吸烟COPD患者ICS治疗反应的生物标志物及预测因子[138,156, 157, 158, 159, 160, 161]。ACO患者ICS治疗后,FeNO水平和诱导痰EOS数均显著降低,FEV1/FVC显著增加,显示FeNO亦可预测ICS在ACO患者中的疗效[48,136,162]。
3.预测COPD急性加重:COPD急性加重期患者FeNO和JawNO水平明显高于COPD稳定期患者[134,163]。当COPD稳定期患者持久性FeNO水平≥20 ppb,患者急性加重发生的频率增加,发作间隙变短,表明FeNO有助于预测COPD的急性加重[164]。
综上所述,FeNO作为重复性好、便于检测的生物指标,可较好反映Th2介导的慢性气道炎症程度,有助于预测COPD急性加重及ICS疗效,在ACO的鉴别诊断及COPD表型的区分方面具有重要意义。若将FeNO检测技术与肺功能、临床评估、生化指标及胸部CT等辅助技术结合起来,将进一步提升临床医生对COPD的认识和诊治水平。
ABPA是烟曲霉致敏引起的一种变态反应性肺部疾病,表现为慢性哮喘和反复出现的肺部阴影,可伴有支气管扩张[165],较常发生于哮喘[166, 167]、肺囊性纤维化(cystic fibrosis,CF)[168]、支气管扩张及COPD等疾病。环境暴露及遗传易感性导致了ABPA的发生,最主要的病理生理机制为Th2介导的免疫反应包括细胞因子IL-4、IL-5、IL-13的大量合成分泌,继而导致血清总IgE和烟曲霉特异性IgE的升高、支气管肺EOS炎症及主要由EOS介导的组织损伤[169]。
FeNO可反映气道EOS性炎症,但在ABPA应用的研究仍甚少。有研究显示,CF患者的FeNO水平低于哮喘患者[170],而儿童CF合并ABPA患者的FeNO水平则显著高于仅烟曲霉致敏或非ABPA非烟曲霉致敏的CF患者,提示FeNO或许可以成为CF合并ABPA的诊断工具[171]。但ABPA高风险成人CF患者的FeNO水平却显著低于ABPA低风险成人CF患者[172]。研究结论的不一致可能是由于ABPA患者与仅为ABPA危险个体的FeNO存在差异所致。国内回顾性分析显示,ABPA患者的FeNO水平显著高于哮喘患者,FeNO与ABPA的诊断具有一定的相关性[173]。ABPA加重期的FeNO水平高于非加重期,FeNO可作为判断ABPA患者是否处于加重期的预测因素之一[174]。ABPA激素治疗后FeNO水平较治疗前显著降低,且基线FeNO值越高,激素疗效越好,提示FeNO可指导APBA患者ICS的治疗[175]。此外,FeNO在评估ABPA生物靶向药物疗效上也有一定作用,ABPA患者接受Omalizumab、Mepolizumab或Dupilumab等生物靶向药物治疗后,临床症状及肺功能改善,口服激素剂量减少,FeNO水平亦较治疗前显著降低[176, 177, 178]。
受限于目前非常有限的研究数据,FeNO在ABPA诊断、治疗反应预测、疗效评价及治疗方案调整中的作用尽管与支气管哮喘有相似之处,但仍需更多研究数据支持。
EGPA是一种可累及全身多个系统的、少见的自身免疫性疾病,主要表现为外周血及组织中EOS增多、浸润及中小血管的坏死性肉芽肿性炎症,属于抗中性粒细胞胞质抗体(ANCA)相关性系统性血管炎[179]。与其他血管炎不同,EGPA最早且最易累及呼吸道和肺脏,绝大多数首发症状为喘息样发作和鼻-鼻窦炎症状。目前 EGPA的诊断标准主要参考1990年美国风湿病学会提出的分类标准[180]。
FeNO在EGPA患者中的应用尚未被广泛研究,仅有病例报道提示EGPA患者FeNO升高[181]。FeNO升高的原因考虑可能与以下2个因素相关:(1)EGPA绝大多数患者存在哮喘和(或)AR[182],另外大部分患者有多组鼻窦受累。既往研究已表明AR、慢性EOS性鼻窦炎会导致FeNO升高[183, 184]。(2)EGPA患者外周血EOS的比例常高于10%,而诱导痰或支气管肺泡灌洗液(BALF)中EOS明显增高是EGPA重要特征,BALF中EOS的比例可高达25%以上[185]。对哮喘患者的研究已经显示,FeNO与痰液、BALF、肺组织以及外周血中EOS显著正相关[32, 33,77,186, 187, 188, 189, 190]。
在EGPA患者中FeNO推荐用于以下三方面:(1)评估上下气道炎症水平、协助EGPA的诊断:因大部分EGPA患者合并AR、CRS、哮喘样症状及气道EOS性炎症,这些因素均可导致FeNO的升高,有助于EGPA的诊断,但目前尚未有进一步研究提示FeNO在EGPA诊断中的最佳界值。(2)协助EGPA患者治疗方案的调整:活动期局限型 EGPA 表现为喘息、咳嗽、胸闷等症状加重,并伴有PEF下降和(或)外周血EOS升高;在哮喘中的研究已表明ICS治疗后FeNO可下降,基于FeNO调整治疗的策略较单纯依据临床症状的策略能够在相同或更低的ICS剂量下维持更好的哮喘控制[191]。此外,鼻炎及鼻窦炎的控制在EGPA治疗中亦占有重要地位,包括洗鼻及鼻吸入糖皮质激素(INCS)治疗等。因此推荐使用FeNO的动态监测,有助于临床了解上下气道炎症控制情况,为临床调整治疗策略提供依据。(3)协助鉴别EGPA患者复发的原因是原发病加重还是合并感染:EGPA患者的主要治疗为ICS及免疫抑制剂,存在合并感染的风险。在EGPA患者治疗过程中出现呼吸道症状加重时,需对病情复发原因进行鉴别诊断。如为原发病加重,常与EOS局部浸润加重相关,因此FeNO值的动态变化较大。
FeNO在EGPA中的具体应用价值,仍需进一步扩大样本研究证实。随着临床应用经验的丰富和认识的深入,期待FeNO技术未来在EGPA的管理中发挥更大的作用。
EP分急性和慢性,其发病原因尚不清楚。急性EOS性肺炎(acute eosinophilic pneumonia,AEP)临床上有急性发热和呼吸道症状,影像学表现为弥漫性肺部渗出影,肺内大量EOS浸润,常发展为呼吸衰竭,有时与社区获得性肺炎很难区别。研究显示,FeNO测定有助于AEP与其他肺部疾病相鉴别[192]。与非AEP患者相比,AEP患者FeNO水平明显升高,若FeNO以23.5 ppb为截点,预测AEP的敏感性为87%,特异性为83%。AEP治疗后FeNO水平明显降低。慢性EOS性肺炎(chronic eosinophilic pneumonia,CEP)常有慢性呼吸系统症状,反复出现肺外周渗出影,对ICS反应良好,但减量不当或停药后常有复发。临床研究发现,控制不良的CEP患者FeNO水平明显高于控制良好者。以FeNO值66.0 ppb预测CEP恶化的敏感性和特异性分别为80%和84%,提示FeNO可用于监测EOS性肺实质炎症,有助于确定适当的ICS剂量[193]。
研究显示,有症状的放射性肺炎患者放疗后与放疗前FeNO的比值明显高于无症状者。FeNO的升高早于症状高峰时间30余天,出现症状高峰的时间间隔与FeNO升高呈负相关,连续FeNO监测可以鉴别出发展为症状性放射性肺炎的高风险患者[194, 195, 196]。闭塞性细支气管炎综合征(bronchiolitis obliterans syndrome,BOS)是器官移植术后远期死亡的主要原因。有研究发现,BOS患者CaNO明显高于非BOS患者,以7.9 ppb为截点,对BOS诊断的敏感性和特异性分别为83%和80%,阳性预测值和阴性预测值分别为77%和86%[197]。若FeNO持续低水平对未来BOS有极好的阴性预测价值[198]。此外,FeNO的变化还可以作为肺移植术后急性并发症(急性排异、淋巴细胞性细支气管炎、急性感染)诊断的一种辅助方法[199]。间质性肺病(ILD)患者FeNO(150~350 ml/s)和CaNO均明显升高,且与预后相关[200, 201]。而结缔组织病相关性间质性肺病(CTD-ILD)较其他ILD的FeNO(350 ml/s)和CaNO 更高,尤其是CaNO,在鉴别CTD-ILD和特发性ILD中具有较高的诊断准确性[200]。特发性肺纤维化(IPF)患者CaNO明显高于健康者,且与许多肺功能指标相关。生存分析显示,CaNO≥6 ppb的患者将会出现病情恶化,死亡风险增加,提示CaNO有助于预测IPF患者的疾病进展和生存概率[202]。另有研究显示,系统性硬化(SSc)患者合并ILD时CaNO明显高于单纯SSc患者,CaNO可作为SSc患者合并ILD的非侵入性生物标志物之一,具有一定的临床应用价值[203]。
无论是FeNO、FnNO还是CaNO,都只是反映了特定范围局部气道的炎症水平。对于慢性炎症气道疾病,往往同时累及上下气道或大小气道,导致气流受限发生,病情相互关联影响。对上下气道、大小气道炎症及气流受限进行全面评估,有助于对疾病进行充分鉴别诊断,实现对疾病的全面认识和系统管理。呼出气中NO联合检测主要包括以下三个方面:(1)上气道NO(FnNO)与下气道NO(FeNO)联合检测;(2)大气道NO(FeNO)与小气道NO(CaNO)联合检测;(3)气道炎症(FeNO)与气流受限(FEV1)联合检测。
FnNO主要来源于鼻腔及鼻窦黏膜,其中副鼻窦上皮细胞是iNOS表达的基础环境,使得鼻窦输出的NO远高于鼻腔。鼻腔和鼻窦存在炎症时,还会影响FeNO水平[204]。2017年《肺部疾病呼气标志物技术标准》推荐上下气道NO呼气联合检测(FnNO+FeNO),用于鼻炎、哮喘、鼻炎合并哮喘的综合评估及联合管理,解决FeNO单检产生的误诊等问题[8]。目前临床应用主要包括哮喘管理及慢性咳嗽病因诊断。
AR是哮喘发病及难以控制的部分原因[114]。合并AR患儿FnNO与FeNO均高于未合并AR者,且FnNO与FeNO密切相关[205, 206]。哮喘控制水平越差,FnNO和FeNO越高,高水平的FnNO提示哮喘控制不佳[205]。FnNO和FeNO联合检测可更好地反映影响哮喘控制的AR的存在,预测哮喘控制不佳风险,指导综合治疗[207]。此外,临床在使用ICS治疗后FeNO高值,需要考虑FnNO影响FeNO的可能,联合FnNO检测,避免FeNO单检导致ICS错误加量。
鼻窦病变产生的NO水平远高于AR,但鼻窦口的开放或堵塞会影响NO气体传输,不同范围的FnNO水平具有不同临床意义:目前认为FnNO正常值为250~500 ppb;FnNO>500 ppb提示鼻窦口开放的AR或鼻窦炎;FnNO<250 ppb提示鼻窦口堵塞的鼻炎或鼻窦炎。当鼻窦黏膜炎症水肿、鼻窦口堵塞时,FnNO显著降低,FnNO水平与哮喘控制的相关性和前述AR患者有所不同。研究显示,哮喘控制不佳的患者FnNO水平更低且慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)更多见,低水平FnNO提示哮喘控制不佳[208, 209]。总之,过高或过低的FnNO均与哮喘控制不佳相关,提示上气道病变可以显著影响哮喘控制,对哮喘患者进行FnNO与FeNO联合检测,才能更好评估上气道合并症及上下气道炎症程度,以指导鼻与口吸入激素的联合诊疗[210]。
FnNO与FeNO联合检测也有助于慢性咳嗽病因诊断。FnNO正常,FeNO升高提示下气道EOS性炎症的存在,常见病因为CVA或EB[211]。FnNO升高,FeNO正常,更多提示AR导致的UACS可能。低水平的FnNO和FeNO,则对于鼻窦炎导致的UACS具有诊断价值[212]。
FnNO与FeNO联合检测可组合成4种类型(图4):Ⅰ型:FnNO、FeNO均正常,提示上下气道均无EOS性炎症,给予抗炎外其他治疗;Ⅱ型:FnNO正常、FeNO高,提示下气道EOS性炎症,建议ICS治疗;Ⅲ型:FnNO低或高、FeNO高,提示上下气道炎症,建议ICS联合INCS治疗;Ⅳ型:FnNO低或高、FeNO正常,提示上气道炎症,建议INCS治疗。
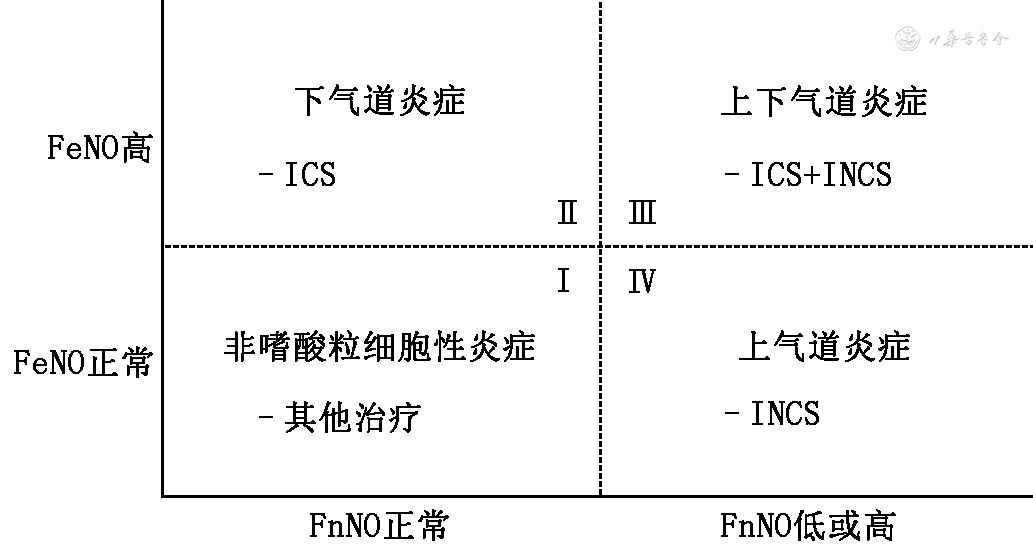

注:FnNO为鼻呼气一氧化氮;FeNO为呼出气一氧化氮;ICS为吸入糖皮质激素;INCS为鼻用糖皮质激素
小气道炎症与哮喘和COPD的严重程度、未来加重风险、气道反应性增高均有关[213, 214, 215]。FeNO低值并不能排除小气道炎症、哮喘及激素治疗有效可能,对大小气道炎症进行联合评估,有助于诊断不同类型与不同部位气道炎症,指导不同给药方式的抗炎治疗。
研究显示,CaNO与哮喘严重程度及外周气道功能障碍密切相关,激素依赖型哮喘患者的CaNO显著高于重症哮喘及轻中度哮喘[216]。高CaNO型哮喘具有更高的发病率和更差的哮喘控制[217]。轻度哮喘患者同样存在小气道异常,经过超微颗粒ICS治疗后哮喘控制的改善程度与基线CaNO正相关[218]。由此可见,哮喘管理中仅单独测定FeNO是不够的,特别是激素依赖型哮喘患者存在更广泛的气道受累,应该加入CaNO测定评估小气道炎症水平,以指导常规ICS、超微颗粒ICS或OCS的使用及针对不同气道的抗炎治疗。
FeNO有助于区分COPD表型,预测ICS疗效,而小气道和肺实质是COPD主要的炎症部位,CaNO还与COPD严重程度、小气道功能障碍及较差的体能和运动后低氧饱和度相关[219, 220, 221],对COPD患者进行FeNO与CaNO联合检测,可以更好地反映COPD气管和肺泡炎症水平及疾病进展,预测及评估抗炎治疗反应。
FeNO与CaNO联合检测可组合成4种类型(图5):Ⅰ型:CaNO、FeNO均正常,提示大小气道均无EOS性炎症,给予抗炎外其他治疗;Ⅱ型:CaNO正常、FeNO高,提示大气道EOS性炎症,建议常规ICS治疗;Ⅲ型:CaNO、FeNO均高,提示大小气道均存在EOS性炎症,建议超微颗粒ICS或OCS治疗;Ⅳ型:CaNO高,FeNO正常,提示小气道EOS性炎症,亦建议超微颗粒ICS或OCS治疗。
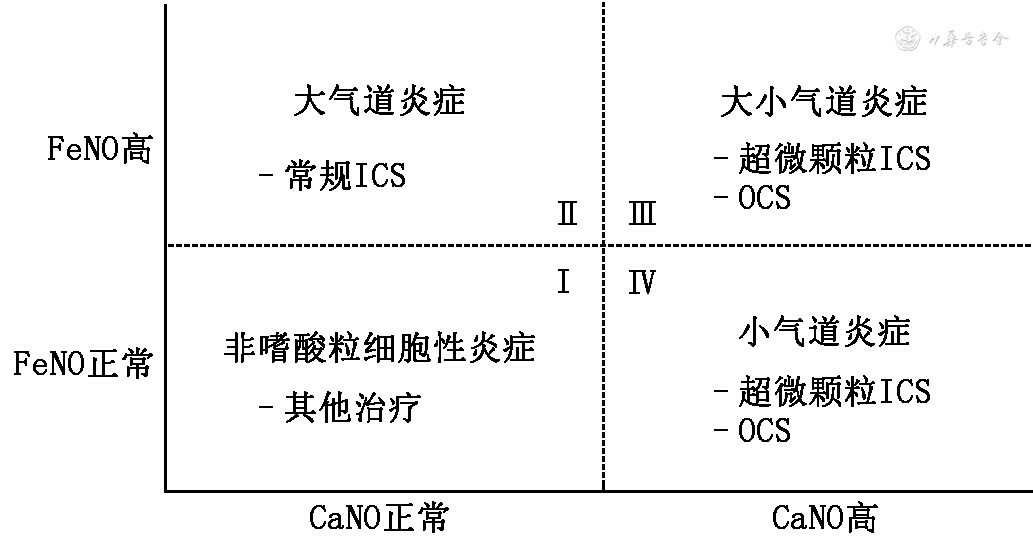

注:FeNO为呼出气一氧化氮;CaNO为肺泡一氧化氮;ICS为吸入糖皮质激素;OCS为口服糖皮质激素
慢性气道炎症长期存在,导致气流受限的发生。FeNO监测可评估气道炎症、发作风险及吸入激素治疗反应性,而FEV1监测则可评估气流受限、病情严重程度与控制水平。FeNO与FEV1联合检测,可克服仅依靠肺功能结合症状诊断方法的不足,对于慢性气道疾病的诊断、炎症分型、评估控制水平及严重程度、预测治疗反应和指导治疗方案调整具有重要作用,有助于更全面系统地评估疾病、指导疾病的管理和治疗[3]。
慢性气道疾病的FeNO与FEV1联合检测可组合成4种类型(图6):Ⅰ型:FEV1、FeNO均正常,提示经过治疗疾病稳定或轻度哮喘,可维持原治疗方案或轻度哮喘按需治疗;Ⅱ型:FEV1正常、FeNO高,提示气道EOS性炎症未控制,建议给予ICS治疗,如已规律高剂量ICS治疗,可考虑OCS或生物靶向药物加强抗炎治疗;Ⅲ型:FEV1低、FeNO高,提示存在气道EOS性炎症及气流受限,往往见于重症哮喘患者,建议ICS联合长效β2受体激动剂(LABA)及长效抗胆碱能药物(LAMA)加强抗炎及舒张支气管治疗,必要时可考虑OCS或生物靶向药物治疗;Ⅳ型:FEV1低,FeNO正常,提示存在气流受限,如已规律使用支气管舒张剂,建议LABA联合LAMA加强舒张支气管治疗。
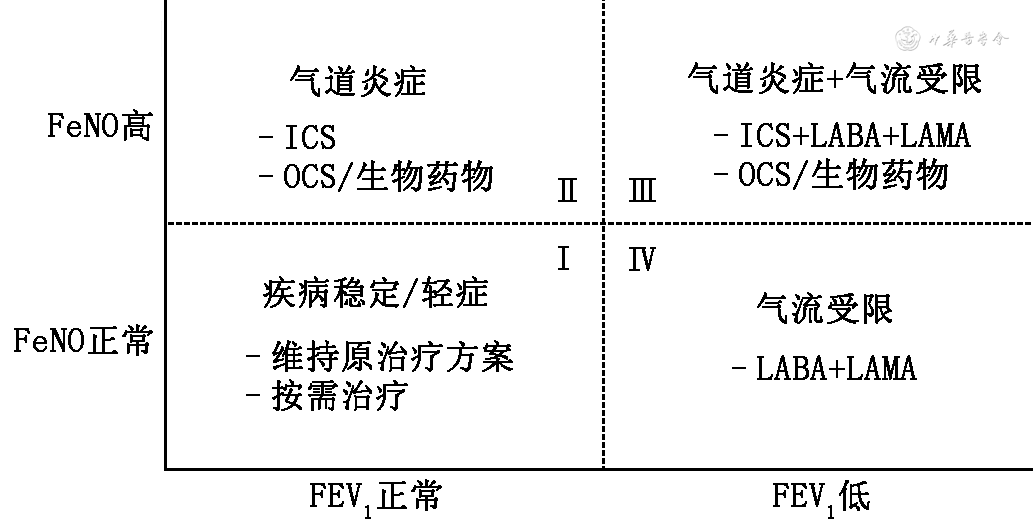

注:FeNO为呼出气一氧化氮;FEV1为第1秒用力呼气容积;ICS为吸入糖皮质激素;OCS为口服糖皮质激素;LABA为长效β2受体激动剂;LAMA为长效抗胆碱能药物
目前NO联合检测技术在慢性气道疾病中的具体应用还有一些争议与矛盾,但毫无疑问,NO联合检测技术独立互补的优势使其在哮喘、COPD等气道疾病管理中的作用越来越突显。随着研究的深入及临床应用经验的丰富,该技术会在慢性气道疾病的精准医疗与防治管理中发挥更显著的作用。
应获得我国健康正常人FeNO、FnNO、CaNO的正常值和预计值;确定诊断哮喘,包括CVA的最佳界值;开展单独应用,或是联合使用峰流速仪预测哮喘急性发作风险的研究;在常规评估哮喘控制的基础上,联合应用FeNO指导药物升降级治疗与传统策略比较降低哮喘急性发作的对比研究;上下气道以及大小气道NO联合检测对气道不同部位炎症的分布特点以及对上下气道同时治疗和药物剂型选择的研究;小型化特别是家庭化检测仪器的研发,真正实现应用于患者的日常管理;ACO的诊断以及预测吸入激素反应性的研究;慢性咳嗽病因诊断流程中作为激素敏感性咳嗽的重要参考指标的研究;开展少见气道疾病如EGPA、ABPA以及EOS相关的其他气道和肺疾病的诊断、病情评估和疗效评价参考指标的研究;应用于移动终端远程管理系统的开发研究;开展各种形式的临床医生培训活动,使其在结合临床资料的基础上对检测结果作出合理的判读,更好地指导临床实践。
起草专家(按章节先后顺序排序):林江涛(中日友好医院);蔡绍曦(南方医科大学南方医院);黄茂(南京医科大学第一附属医院);王长征(重庆医科大学附属第三医院);邱忠民(同济大学附属同济医院);余莉(同济大学附属同济医院);邱晨(深圳市人民医院);农英(中日友好医院);张清玲(广州医科大学附属第一医院广州呼吸健康研究院);吴昌归(西安国际医学中心胸科医院)
主审专家(按姓氏拼音排序):蔡柏蔷(北京协和医院);陈萍(北部战区总医院);何权瀛(北京大学人民医院);万欢英(上海交通大学医学院附属瑞金医院);姚婉贞(北京大学第三医院);殷凯生(南京医科大学附属第一医院);周新(上海交通大学附属第一人民医院)
讨论专家(按姓氏拼音排序):鲍文华(佳木斯大学附属第一医院);陈愉生(福建省立医院);董亮(山东大学齐鲁医院);杜鹃(贵州医科大学附属医院);顾玉海(青海省人民医院);贺蓓(北京大学第三医院);黄奕江(海南省肿瘤医院);姜淑娟(山东省立医院);孔灵菲(中国医科大学附属第一医院);李满祥(西安交通大学第一附属医院);刘辉国(华中科技大学同济医学院附属同济医院);刘荣玉(安徽医科大学第一附属医院);刘晓民(哈尔滨医科大学第一附属医院);彭丽萍(吉林大学第一医院);史利卿(北京中医药大学东方医院);孙增涛(天津中医药大学);唐华平(青岛市市立医院);文富强(四川大学华西医院);谢华(北部战区总医院);于文成(青岛大学附属医院);袁雅冬(河北医科大学第二医院);云春梅(内蒙古自治区人民医院);张筱娴(广州医科大学附属第一医院广州呼吸健康研究院);赵海金(南方医科大学南方医院);周玮(宁夏医科大学总医院)
文字整理:农英(中日友好医院)
所有作者均声明不存在利益冲突
·消息·
《中华医学杂志》2021年起全面启动“开放阅读”
从2021年1月1日起,《中华医学杂志》全面启动“开放阅读”,读者可通过登录《中华医学杂志》官方网站(http://nmjc.net.cn)免费阅读和下载从1915年创刊至今已经发表的所有文章。
作为中华医学会的会刊,创刊100多年来,《中华医学杂志》始终坚持以服务医药卫生科技人员、促进国内医学事业发展为宗旨,全面反映中国医学最新的科研成果,紧密跟踪世界医学科技进步的潮流,理论与实践结合,提高与普及并重,积极推广医药卫生领域的新技术、新成果,及时交流防病治病的新经验,大力普及医学科技新知识,为提高中国广大医药卫生人员的思想和职业道德修养、医学科学理论和业务技术水平,推动中国医学科技进步和知识创新,以及繁荣中国医学科技出版事业,发挥了重要作用。
历经数代人的努力,《中华医学杂志》形成了科学性强、权威度高、影响力大、覆盖面广的刊物特色,树立了良好的社会形象,在中国医学界享有很高的声誉。《中华医学杂志》被国内权威期刊评价机构列为核心期刊,如中国科技核心期刊目录、北京大学图书馆中文核心期刊要目总览、中国科学引文数据库(CSCD)等,被Medline、Embase、Scopus、万方数据库、CNKI等国内外30多个数据库和检索系统收录;荣获首届和第二届全国优秀科技期刊一等奖、多届国家期刊奖,连续多年荣获中国百种杰出学术期刊称号。
当今世界已进入知识经济飞速发展时期。掌握和利用信息成为世界综合国力竞争的重要方向。实施精品期刊工程,打造国际一流科技期刊,已成为我国“科教兴国”战略的重要举措。为了提高《中华医学杂志》发表文章的显示度,让读者更方便地阅读,充分实现已发表论文的学术价值,从2021年1月1日起,《中华医学杂志》全面启动“开放阅读”。“开放阅读”后,文章版权仍属于中华医学会,文章电子文件只供学习交流之用,不可结集或摘抄用于商业用途,亦不可以全文形式上传至任何公开网络,否则中华医学会杂志社将依法追究相关人员法律责任。
欢迎各位作者把高水平的医学论文发表在《中华医学杂志》上,更有效地分享和传播自己的学术研究成果。


























