
探讨倒"L"形切口在颈胸交界处肿瘤切除术中的临床应用。
回顾性研究。纳入2015年8月—2019年8月上海交通大学医学院附属新华医院心胸外科21例颈胸交界处肿瘤患者的临床资料,其中男12例、女9例,年龄13~76岁。11例患者术前穿刺病理检查:神经来源6例,甲状腺组织来源3例,淋巴组织来源2例。均采用倒"L"形切口行肿瘤切除术,观察手术时间、术中出血量、患者住院时间以及术后乳糜漏、膈肌麻痹、喉返神经损伤、肺部感染等并发症发生情况。
本组21例患者,单纯应用倒"L"形切口切除肿瘤共16例,中转全胸骨劈开1例,应用胸腔镜辅助4例。手术时间130~350 min,平均214 min;术中出血量100~500 mL,平均236 mL;患者住院时间为3.5~10.0 d,平均7.5d。术后1例患者因单侧喉返神经损伤出现声音嘶哑,1例患者出现乳糜胸,1例患者出现单侧膈肌麻痹。所有患者术后肩部及上胸部形态满意,无肢体功能障碍,无切口感染,无再次手术。术后病理提示神经源性肿瘤7例,甲状腺来源肿瘤3例,畸胎瘤3例,淋巴瘤3例,支气管源性肿瘤2例,血管瘤2例,脂肪瘤1例。21例患者随访时间3.0~40.0个月,平均20.3个月。在随访期间,15例患者存活且无肿瘤复发及转移,6例患者死亡。
在颈胸交界处肿瘤的切除术中,倒"L"形切口能安全、完整地切除肿瘤。此切口特别适用于瘤体大部分位于颈根部的肿瘤。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
颈胸交界处肿瘤指原发于颈部的肿瘤扩展至胸腔内,或起源于胸部的肿瘤越过胸廓入口到达颈部[1]。颈胸交界处有重要的血管、神经及胸导管穿行其中,若此处发生肿瘤,血管及神经很容易受侵犯,所以外科手术切除肿瘤是首选的治疗方式。手术中充分暴露瘤体及受侵的血管、神经是手术成功的第一步[2]。但在颈胸交界处进行手术时,单纯的颈部或胸部切口无法充分暴露肿瘤[3,4,5,6]。前人在不断实践的基础上开创性的应用了Clamshell切口、Paulson切口及Grunenwald切口等。Clamshell切口暴露广,适用于累及双侧胸腔的病变;但此类切口创伤大,对累及椎体的病变暴露不充分[7]。Paulson切口能充分暴露后侧胸壁、横突、神经根以及肺门,尤其适用于胸壁致密粘连、肿块侵犯胸椎椎体和瘤体较大者;但此类切口难以充分暴露锁骨下血管,对胸顶的暴露很差,也不利于臂丛神经的松解[8]。Grunenwald切口有利于处理受累的锁骨下血管及重要神经,保持肩带及胸锁关节的完整,维持上胸部的美观;但此类切口对于肺门血管的处理、淋巴结的清扫和第2肋骨以下的胸壁切除有困难,对椎体的显露也不令人满意[9]。虽然颈胸交界处切口多种多样,但目前已知的切口都不适用于瘤体大部分位于颈根部的肿瘤。为了能更充分地暴露肿瘤的颈根部部分,同时保证胸锁关节的完整,2015年8月—2019年8月上海交通大学医学院附属新华医院心胸外科在颈胸交界处肿瘤切除术中采用倒"L"形切口,取得较好的临床效果。现对其临床资料进行回顾性分析,探讨该手术切口方式的可行性、安全性。
纳入标准:(1)颈胸交界处原发或者复发的良恶性肿瘤,局部进展期没有远处转移者;(2)同意接受倒"L"形切口手术并接受术后随访患者;(3)随访资料完整。排除标准:(1)肿瘤远处转移;(2)有严重合并症难以耐受手术患者。
回顾性研究。纳入符合要求的颈胸交界处肿瘤患者21例,其中男12例、女9例,年龄13.0~76.0岁(平均39.8岁)。患者首发病程3~90 d,平均16 d。21例患者中,颈肩部疼痛6例,锁骨上窝可触及肿物4例,胸闷症状明显3例,持续咳嗽3例,声音嘶哑2例,上肢水肿2例,患侧上肢麻木2例,出现上腔静脉综合征1例。
本研究符合《赫尔辛基宣言》的要求。所有患者均签署手术知情同意书。
患者术前均行胸部增强CT扫描及三维重建,检查结果提示:颈胸交界处占位性病变。怀疑恶性肿瘤患者行腹部超声、头颅CT扫描及放射性核素骨扫描,或者行PET-CT检查,排除恶性肿瘤的转移可能。11例患者术前行穿刺病理检查:神经来源6例,甲状腺组织来源3例,淋巴组织来源2例。
全身麻醉。患者取平卧位,上胸部垫高,头向肿瘤对侧偏斜30°~45°。从锁骨远端的上缘开始,平行于锁骨做一横向切口,绕过胸锁关节到达胸骨上切迹,然后继续沿胸骨正中向下切至第3肋间水平。游离皮下组织后,自胸骨上切迹开始自上而下劈开胸骨上段至第3肋间水平,然后横向锯开胸骨至肋间隙,用小号胸骨撑开器撑开胸骨。仔细分离肿瘤组织,分别游离出无名动静脉、锁骨下动脉、上腔静脉等重要血管。其中2例患者发现肿瘤侵犯的左侧无名静脉管壁超过了周径的一半,行无名静脉置换;1例因肿瘤侵犯胸导管,行胸导管结扎;1例患者因肿瘤侵犯上腔静脉,转为全胸骨劈开同期行上腔静脉人工血管置换;4例因术前发现患侧上肺占位性病变,先切除颈胸交界处肿瘤,再应用胸腔镜辅助行患侧上肺叶切除术。患者完成肿瘤切除后,用胸骨钢丝或蝶形钢板固定胸骨上段,逐层关闭切口,经胸腔或者颈部放置引流管。
术后密切监测患者生命体征。术后24 h内摄床旁胸X线片,拔除气管插管;对出现肺部不张或低氧血症的患者给予持续呼吸机辅助通气。人工血管置换患者术后24 h后皮下注射低分子肝素0.4 mL,每天2次,共用5 d,之后改为阿司匹林100 mg/d,1~3个月[10]。经胸腔引流管连续3 d的引流量<200 mL/d可拔除引流管,经颈部引流管连续3 d的引流量<50 mL/d可拔除。对于肿瘤恶性度高,术后肿瘤复发和远处器官转移的高危患者推荐术后化疗;根据切缘状况及切口情况决定是否放疗。
观察手术时间、术中并发症情况、术中出血量、患者住院时间,以及术后乳糜漏、膈肌麻痹、喉返神经损伤、肺部感染等并发症发生情况。术后1、3、6个月及1年随访,此后每年随访1次,复查心彩超、胸部CT,观察心功能变化、肺部复张情况及肿瘤有无复发。
本组21例,患者均安全、完整切除肿瘤,1例在术中清除肿瘤组织时,不慎将锁骨下动脉离断,术中立即行右侧锁骨下动脉结扎。左、右侧倒"L"形切口分别为14例和7例。手术时间130~350 min,平均214 min。术中出血量100~500 mL,平均236 mL。单纯应用倒"L"形切口切除肿瘤共16例,转为全胸骨劈开1例,应用胸腔镜辅助4例。术后1例患者因单侧喉返神经损伤出现声音嘶哑,术后6个月恢复正常;1例患者出现乳糜胸,给予禁食、静脉营养及胸腔闭式引流,在术后第10天胸腔积液乳糜检测为阴性;1例患者因左侧膈神经过度牵拉出现单侧膈肌麻痹,术后4个月复查胸部X线片,膈肌恢复正常位置。患者术后住院时间为3.5~10.0 d,平均7.5 d。所有患者术后肩部及上胸部形态满意,无肢体功能障碍,无切口感染,无因手术止血不佳,再次手术。术后病理提示:肿瘤均切除,切缘安全,病理诊断为神经源性肿瘤7例(恶性神经鞘瘤3例、神经纤维瘤3例、神经鞘瘤1例),甲状腺来源肿瘤3例(多结节性甲状腺肿2例、异位甲状腺组织1例),畸胎瘤3例(恶性畸胎瘤2例、良性畸胎瘤1例),淋巴瘤3例(1例霍奇金淋巴瘤淋巴细胞耗竭型、1例霍奇金淋巴瘤淋巴细胞为主型、1例非霍奇金淋巴瘤淋巴母细胞型),支气管源性肿瘤2例(支气管腺癌1例、支气管鳞状细胞癌1例),血管瘤2例,脂肪瘤1例。
21例患者随访时间3~40个月,平均20.3个月。在随访期间有6例患者死亡:1例恶性神经鞘瘤患者在术后12个月原位复发,于术后15个月死亡;1例恶性畸胎瘤患者术后未行化疗,于术后13个月因复发死亡;1例霍奇金淋巴瘤(淋巴细胞耗竭型)患者和1例非霍奇金淋巴瘤(淋巴母细胞型)患者分别于术后20个月和28个月因肠梗阻、大量腹水及肾功能不全死亡;1例支气管腺癌患者于术后35个月因胸腔广泛转移死亡;1例患者在术后11个月发生脑血管意外死亡。其余15例患者在随访时间内无肿瘤复发及转移,心功能较术前无改变,无肺不张情况发生。
典型病例见图1。
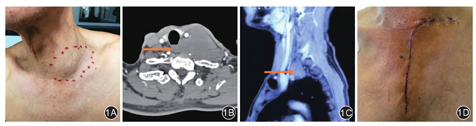

颈胸交界处解剖结构复杂,生长在此处的肿瘤也具有复杂性。颈胸交界处肿瘤的手术治疗原则是最大范围地切除肿瘤,并尽可能地保存手术部位的功能[11],其中手术切口的选择至关重要,应达到以下指标:(1)胸廓入口充分暴露;(2)能够对臂丛神经、锁骨下动脉、腋动脉和无名动脉等重要血管神经解剖性分离;(3)对胸锁乳突肌尽可能保留,防止斜颈发生;(4)维持胸锁关节的完整性及胸壁的稳定性。
1997年Grunenwald等[12]报道通过劈开胸骨柄绕胸锁关节径路切除颈胸交界处肿瘤的方法:切口从胸锁乳突肌前缘向下沿胸骨柄正中至第1或第2肋间时,垂直向外斜向三角肌-胸大肌间沟至锁骨中线附近,离断第1、2肋软骨和锁骨与第1肋骨之间的斜角肌和韧带,向上和头端抬起锁骨。此类切口在众多颈胸交界处肿瘤手术切口中较为经典,能保持骨和关节的稳定,保持肩带及胸锁关节的完整,保留上肢的重要功能,维持上胸部的美观[13];但该术式对于侵犯到第2肋以下的大肿瘤暴露不充分,肺门处的结构不能充分显露,淋巴结清扫困难。有研究者在Grunenwald的基础上对其切口进行了改良:将切口从胸骨上切迹开始,沿着前正中线往下延伸到了第2肋间,再往外延伸至腋前线,取名"L"形切口[14,15]。此切口扩大了手术视野,但同时也增加了手术创伤。除上述经典的手术切口外,临床医生根据个人经验及习惯还有应用后径路Paulson切口、颈部低位领式切口等[16]。这些切口方式可以暴露颈根部及上纵隔的肿瘤,但同样存在手术视野不佳及创伤大的不足之处。
本中心经过多年的手术探索,在前人研究的基础上设计了倒"L"形切口。笔者总结,采用倒"L"形切口行颈胸交界处肿瘤切除术,术中需注意以下几个方面:(1)应用胸骨锯从胸骨上切迹向下沿胸骨正中将胸骨劈至第3肋间水平,已能处理肺门部的血管并进行肺门部淋巴结清扫,可避免肿瘤组织残余和阳性淋巴结的残留。(2)对于老年患者,胸骨的骨质脆易骨折,需将胸骨从第3肋间水平向患侧锯开至肋间隙,以防撑开时胸骨意外劈裂。横向锯开胸骨至肋间隙时,要注意保持肋软骨与胸骨的连接,维持术后胸廓的稳定性。(3)颈胸交界处空间小,瘤体毗邻结构复杂,视野有限,肿瘤整块切除困难。建议显露部分毗邻结构后,分块切除瘤体,待视野扩大后再切除剩余部分。
在本研究中,我们对21例颈胸交界处肿瘤患者成功应用了倒"L"形切口实施肿瘤切除术。笔者认为,由于颈胸交界处空间狭小及周围血管神经丰富,需根据患者具体情况采用不同的处理方式。在本研究中,2例患者的术前胸部CT示肿瘤位于前上纵隔且累及左侧颈根部,肿瘤边界不清,内部未见明显的静脉石或钙化,增强CT也无引流静脉显影。我们根据患者影像学表现,决定手术切除肿瘤,手术中先取胸骨上段小切口,后因胸廓入口处暴露不充分,切口向左侧颈部延伸成倒"L"形切口,顺利完成手术,术后病理诊断为海绵状血管瘤。2例患者术中发现肿瘤侵犯的左侧无名静脉管壁超过了周径的一半,遂考虑行无名静脉置换。无名静脉置换避免了因无名静脉成形术或切除术术后可能发生的梗阻症状,更好地保证术后的远期血管通畅率。3例患者术后诊断为淋巴瘤,其中1例术前考虑为神经源性肿瘤,予以手术切除,术后病理证实为淋巴瘤,提示术前CT有时难以区分神经源性肿瘤与淋巴瘤;另外2例术前胸部CT已提示是淋巴瘤,但这2例患者有上肢水肿、胸闷气促症状,综合考虑后决定手术切除肿瘤,解除气管压迫及上腔静脉梗阻。笔者认为,颈胸交界处肿瘤的手术适应证应适当放宽:对于部分特殊的肿瘤如淋巴瘤,患者的主要症状因肿瘤压迫或侵犯周围器官引起,手术的目的为切除肿瘤,改善患者的症状。因此,只要肿瘤相对局限,没有远处转移,根据术前检查评估为可切除的肿瘤,都可进行手术;患者的病情严重程度在很大程度上决定了治疗方案的选择,部分患者入院时病情危重,需要尽快进行手术治疗以缓解症状,为以后的治疗争取时间[1]。
综上所述,颈胸交界处肿瘤的外科治疗重视手术入路的选择,但目前颈胸交界处肿瘤的切除没有标准术式。虽然倒"L"形切口创伤小且能较充分地显露瘤体及周围组织,但在应用的过程中我们也认识到了其局限性:在切除受累的肺组织时,单纯应用该切口暴露有限,还需借助胸腔镜切除病肺;侵犯椎体的颈胸交界处肿瘤,倒"L"形切口不如后径路切口暴露充分。因此,我们认为倒"L"形切口是安全的、可行的,特别适用于瘤体大部分位于颈根部的肿瘤,给颈胸交界处肿瘤的切除提供一个不错的选择。本研究也存在不足之处:样本量少,未设立对照组,无法与其他切口进行比较研究;倒"L"形切口应用不久,缺少长期随访资料。在今后的研究中,我们将增加样本量,对患者进行长期跟踪随访,并与其他切口进行比较研究,进一步探讨倒"L"形切口在颈胸交界处肿瘤切除术中的应用价值。
所有作者均声明不存在利益冲突



























