
免疫治疗与传统的肿瘤治疗方式相比具有更大的优势,在一些难治的癌症以及晚期癌症患者中取得了令人鼓舞的效果和良好预后,但在患者中的响应率不高。在肿瘤发展过程中,免疫系统与肿瘤相互作用过程称为肿瘤免疫编辑,并进一步细分为免疫清除、免疫平衡、免疫逃逸3个阶段。本文概述了肿瘤免疫编辑3个阶段中肿瘤微环境的变化,研究这些变化,对解决免疫治疗抗性,针对性用药设计以及联合用药方案都具有重要意义。

经全国继续医学教育委员会批准,本刊开设继教专栏,2021年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
与传统的肿瘤治疗方式(手术切除、放化疗、靶向治疗等)相比,免疫治疗具有很大的优势。肿瘤免疫治疗通过激发机体的免疫系统来控制和杀伤肿瘤细胞,因为它针对的目标是免疫细胞,因此个体化程度更高,疗效更为持久。近年来免疫治疗中免疫检查点抑制剂的研究较为深入,主要针对的靶点是细胞毒性T淋巴细胞抗原4(CTLA-4)和程序性死亡受体-1及其配体(PD-1/PD-L1)通路,利用免疫检查点抑制剂治疗肿瘤的单抗药物已被美国食品药品监督管理局(FDA)批准用于多种癌症,包括晚期黑色素瘤、非小细胞肺癌、头颈部鳞状细胞癌、肝癌、肾癌、高频微卫星不稳定性(MSI-H)的结直肠癌等[1]。
虽然免疫治疗在一些难治的癌症以及晚期癌症患者中取得了良好效果,但是这只局限在小部分患者群体中,很多患者并不能从中受益,而且有些应答患者会发生复发。在与肿瘤战斗的过程中,医学家们发现免疫系统表现出矛盾的两面性,一方面在肿瘤初始阶段,免疫系统杀伤肿瘤细胞,表现出抗肿瘤功能,另一方面又对肿瘤细胞进行着重塑,使得肿瘤对免疫系统产生抗性并加速肿瘤的生长。2002年,Duun等[2]率先提出了肿瘤免疫编辑的假说。假说指出,免疫系统和肿瘤相互作用,不断地发生着变化与选择,这一过程大致概括为3个阶段:免疫消除、免疫平衡、免疫逃逸。免疫消除时期,癌变的细胞会受到免疫系统的监视,并通过固有免疫和适应性免疫消除病变细胞;经过这一阶段后幸存下来的肿瘤细胞免疫原性很低,与免疫系统处于一个相对平衡的状态,于是进入了较为漫长的免疫平衡阶段,这一阶段可能会持续数十年或更久,在这阶段中免疫系统的清除压力一直存在,肿瘤细胞的突变也在发生;当突变积累到一定程度后,肿瘤细胞在与免疫系统的博弈中占了上风,产生了一系列恶性表型,进入了免疫逃逸阶段,此时肿瘤对免疫系统的攻击产生了抵抗性,甚至可以反过来摧毁免疫系统。20年来,许多研究结果不断证实肿瘤免疫编辑理论的存在并将其逐渐完善。
肿瘤免疫编辑的3个阶段中,肿瘤微环境的各种成分之间都在发生着交互作用。肿瘤微环境是一个复杂的生态系统,除肿瘤细胞外,还包括免疫细胞、成纤维细胞、血管内皮细胞、平滑肌细胞等基质细胞,以及非细胞成分,如细胞基质和多种分泌到细胞外的因子。其中,免疫相关的细胞又具体包括了:调节T细胞(Tregs)、细胞毒性T细胞(CTLs)、辅助T细胞(Th细胞)、调节B细胞、自然杀伤细胞(NK细胞)、肿瘤相关巨噬细胞、肿瘤相关树突状细胞、肿瘤相关肥大细胞、髓源性抑制细胞、中性粒细胞等。这些细胞不断互相影响,不断发生变化,分泌到微环境中细胞因子,趋化因子的种类和数量也随之变化。研究肿瘤微环境的这一动态过程对了解免疫抵抗的具体原因以及更加针对性地利用免疫治疗具有重要意义。
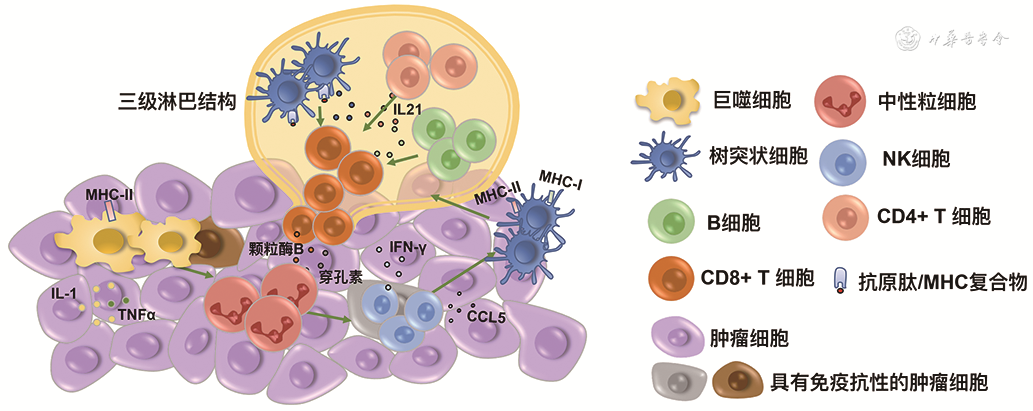


当机体内部分细胞产生病变转化为肿瘤细胞后,固有免疫系统首先发挥识别和杀伤新生肿瘤细胞的作用。病变部位的巨噬细胞被激活,吞噬作用加强,表面表达的主要组织相容性复合物(MHC)Ⅱ类分子上调,并且分泌多种细胞因子如白细胞介素1(IL-1)和肿瘤坏死因子(TNF)α,招募更多的巨噬细胞和其他的免疫细胞。中性粒细胞在趋化物质如CXCR1/CXCR2的吸引下穿越血管到达病变部位,发挥吞噬作用和细胞毒作用,使得巨噬细胞进一步募集和极化,NK细胞和NK/T细胞也被激活,并且和巨噬细胞相互促进,产生大量的穿孔素、颗粒酶以及IFN-γ等细胞因子[3],发挥抗肿瘤作用。巨噬细胞吞噬病变细胞也可以发挥抗原提呈作用,此外树突状细胞作为专职抗原提呈细胞可以被多种细胞因子激活,如经典的粒细胞-巨噬细胞集落刺激因子(GM-CSF),NK细胞分泌的树突状细胞趋化因子CCL5和XCL1[4]等。肿瘤内传统树突状细胞捕获肿瘤抗原并进行加工,在表面表达抗原肽-MHC分子复合物,并将其转运递呈给三级淋巴结构中的T细胞,在CD4+T细胞的辅助下使CD8+T细胞活化[5],激活适应性免疫。淋巴细胞是机体免疫应答功能的主要细胞群体,在肿瘤局部存在着淋巴聚集群体,称为三级淋巴结构。与次级淋巴结构类似,三级淋巴结构包含了B淋巴细胞、T淋巴细胞、树状突细胞等。三级淋巴结构中的B淋巴细胞与树状突细胞等免疫细胞,可以改变T细胞的活性和功能,因此其中的T淋巴细胞,相比于其他部位的T细胞,具有更强的活性。
经过免疫清除时期的存活下来的肿瘤细胞免疫原性很低,与免疫系统处于动态平衡的状态。淋巴细胞分泌干扰素(IFN)-γ、IL-12等细胞因子,一旦有免疫原性强的肿瘤细胞产生就会被免疫系统识别并杀伤。组织驻留记忆CD8+T细胞可以有效抑制肿瘤的发展,促进免疫平衡时期延长[6]。Tregs在体内免疫反应中主要起抑制作用,Tregs数量的增加,会导致适应性免疫反应受损。树突状细胞表达的肝激酶B1(LKB1)能够有效抑制Treg细胞的增殖,控制Tregs比例以维持体内的免疫平衡[7]。
免疫平衡时期患者处于一种荷瘤生存状态,肿瘤组织与免疫系统相对平衡,肿瘤虽不会被免疫系统彻底清除,但处于控制之下,患者的生活不会受到很大影响。有关免疫平衡时期的详细研究目前还比较少,但是针对免疫平衡期,例如延长这一时期的持续时间,或者使晚期癌症恢复到免疫平衡的状态,也是免疫治疗的一个方向。经过前2个阶段而存活下来的肿瘤突变对免疫系统抗性极高,最终发生了免疫逃逸。
当肿瘤与免疫系统的相互作用到达免疫编辑的最后阶段——免疫逃逸阶段时,肿瘤细胞甚至宿主细胞本身通过多种机制使肿瘤逃避了免疫系统的杀伤。
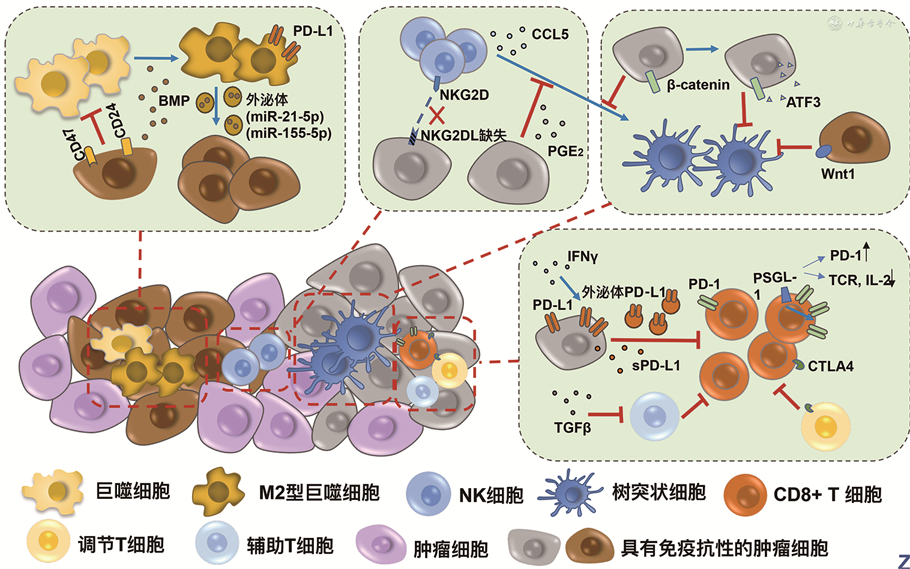
1.肿瘤细胞逃避巨噬细胞的清除:肿瘤细胞可以通过表达多种抗吞噬信号蛋白来逃避巨噬细胞的清除。信号调节蛋白α(SIRPα)是巨噬细胞上的抑制受体,肿瘤细胞表面蛋白CD47可以与SIRPα结合而促进免疫逃逸[8],而CD47在人小细胞肺癌细胞、非小细胞肺癌、乳腺癌、上皮性卵巢癌等许多癌症中都有过度表达。许多肿瘤过表达CD24,包括卵巢癌、三阴性乳腺癌、膀胱尿路上皮癌等,而与肿瘤相关的巨噬细胞表达高水平的抑制性受体唾液酸结合Ig样凝集素10(Siglec-10)。两者相互作用,使得肿瘤细胞表现出强烈的抗吞噬信号,通过单克隆抗体阻断这一信号通路,巨噬细胞对表达CD24的肿瘤细胞吞噬作用得到加强[9]。还有研究表示,肿瘤发生复发后,MHCⅠ分子在肿瘤细胞上的表达丢失,同时这些细胞的β2-微球蛋白基因的表达也丢失了。这些表达缺失的肿瘤细胞不会被巨噬细胞、CTLs等肿瘤浸润性淋巴细胞杀死。将正常的β2-微球蛋白基因转导到表达缺失的细胞中后,MHCⅠ类分子在其表面的表达得到了恢复[10]。此外,当巨噬细胞发生M2极化后,可以促进癌细胞的生长。Martínez等[11]的研究显示,膀胱癌细胞分泌骨形态发生蛋白(BMP)促进了Ⅱ型巨噬细胞分化;在结直肠癌中,M2型巨噬细胞分泌miR-21-5p和miR-155-5p的高表达的外泌体,转移至结直肠癌细胞后诱导其侵袭和迁移[12]。
2.肿瘤细胞逃避NK细胞的杀伤:Freeman等[3]使用全基因组CRISPR/Cas9技术筛查抵抗NK细胞抗肿瘤活性的基因,发现与抗原呈递和/或IFN-γ信号传导相关的基因可以保护肿瘤细胞免受NK细胞的杀伤。而与IFN-γ信号传导和抗原呈递相关的基因的缺失使肿瘤细胞对活化的CD8+T细胞的杀伤具有了抵抗力,但同时变得对NK细胞的杀伤灵敏度上升。这两个矛盾的现象给免疫治疗指出了一个新方向——当发生CD8+T细胞轴的免疫逃逸时,可以考虑NK细胞过继性治疗。NK细胞表达的NKG2D可以识别MHCⅠ类分子,参与NK细胞对肿瘤细胞的杀伤。Paczulla等[13]的研究显示,表达NKG2D配体的急性髓细胞性白血病细胞可以被NK细胞清除,但之后发生化疗耐药性白血病干细胞则表现出NKG2D配体阴性的表型,逃避了NK细胞的杀伤。聚ADP核糖聚合酶1(PARP1)可以抑制NKG2D配体的表达,治疗时可以考虑在靶向抑制PARP1的同时移植多克隆NK细胞对肿瘤细胞加以控制。NK细胞可以产生CCL5和XCL1,募集Ⅰ型树状突细胞聚集到肿瘤微环境中进行免疫控制。Böttcher等[4]在黑色素瘤、头颈部鳞状细胞癌、乳腺癌等癌症中做了一系列试验,结果表明肿瘤细胞来源的前列腺素E2(PGE2)破坏了这个反应链,不仅降低了NK细胞的活力,也抑制了趋化因子CCL5和XCL1的产生,而且降低了树状突细胞对趋化因子的反应性。
3.肿瘤细胞对树状突细胞的抑制:树状突细胞专职抗原提呈,在激活CD8+T细胞中起至关重要的作用,上文中有提到肿瘤产生的PGE2会抑制树状突细胞的募集,导致免疫逃逸。肿瘤细胞还通过许多其他的途径抑制树状突细胞的功能。β-catenin在多种肿瘤中表达发生了上调,介导了细胞黏附和基因表达,在细胞的增殖、分化和凋亡等方面都具有重要作用。Ruiz de Galarreta等[14]发现,β-catenin还参与了肝癌的免疫逃逸。在β-catenin信号激活的肝癌中,趋化因子CCL5、CCL17、CCL20、CCL28、CXCL1、CXCL10等都发生了下调,其中CCL5参与了树状突细胞的募集,β-catenin的过度表达导致树状突细胞的募集缺陷,从而引发了免疫逃逸。在β-catenin激活的同时,将CCL5过表达,可以观察到免疫监视得到了回复。而且β-catenin激活的肿瘤对抗PD-1治疗也具有耐药性。在黑色素瘤细胞中,β-catenin激活后上调ATF3,抑制趋化因子CCL4的产生,也阻止了树状突细胞向肿瘤微环境的迁移[15]。Wnt/β-catenin是经典的调节基因转录的信号通路,Wnt蛋白在适应性免疫耐受中也起着重要作用。Kerdidani等[16]研究指出,Wnt1在人肺腺癌中过表达,在肿瘤微环境中,Wnt1通过肿瘤浸润树状突细胞的信号间接作用于CD8+T细胞,抑制T细胞毒性。针对Wnt1的siRNA可以挽救β-catenin激活的树状突细胞,在个体化治疗和联合免疫疗法中具有借鉴意义。
4.肿瘤细胞逃避T细胞的杀伤:(1)PD-1/PD-L1:PD-1/PD-L1信号轴是研究非常热门的一个免疫逃逸的信号通路。在活化的T细胞表面,PD-1表达发生上调(B细胞、巨噬细胞、树突状细胞和单核细胞的PD-1表达也有上调的现象),同时肿瘤细胞表面的PD-L1也发生了上调,两者相互结合,产生抑制性信号,使CD8+T细胞的增殖以及细胞毒性受到抑制。肿瘤细胞发生的突变通过多种机制促进了PD-L1的表达。例如在非小细胞肺癌中,肿瘤细胞通过miR-200/ZEB1轴上调PD-L1的表达,进而促进癌细胞的转移及免疫抑制[17];在肾透明细胞癌中,VHL基因的缺失导致HIF-2α增多,使PD-L1表达也增多[18]。膜蛋白PD-L1的可变剪接在跨膜结构域之前产生新的终止密码子,导致可溶性PD-L1(sPD-L1)的分泌,IFNα、IFNγ和TNFα之类的细胞因子会增加PD-L1的剪接活性,从而导致肿瘤细胞直接分泌sPD-L1[19]。近期研究表明,肿瘤细胞也可以分泌携带PD-L1的外泌体,发挥全身性的免疫抑制功能,IFN-γ同样可以促进外泌体PD-L1的分泌,并且在治疗阶段,外泌体PD-L1的变化幅度比其他指标(如活检PD-L1,血液中可溶性PD-L1等形式)更具有参考意义[20]。除了肿瘤细胞表面,免疫细胞自身也有表达PD-L1,非肿瘤细胞上的PD-L1对于抗肿瘤免疫同样至关重要。在原发性皮肤弥漫性大B细胞淋巴瘤中,肿瘤区域内PD-L1高表达集中体现在肿瘤浸润性的免疫细胞上,特别是肿瘤浸润性巨噬细胞表达高水平的PD-L1,且与总体存活率(OS)有更好的相关性[21]。(2)CTLA4:CTLA4也是T淋巴细胞表达的免疫抑制信号受体,CTLs及Tregs表达大量的CTLA4,并通过抗体依赖性细胞毒性的方式使T细胞耗竭。也有报道,CTLA4在某些肿瘤细胞(如黑色素瘤细胞)上也有表达,参与肿瘤的免疫逃逸[22]。(3)其他信号途径:除了上述两种经典导致T细胞耗竭的通路之外,还有研究报道了许多其他的途径可以抑制T细胞最终发生免疫逃逸。如肿瘤微环境中TGFβ增加,抑制Th1效应器,是免疫逃逸的主要机制之一,抑制TGFβ可以引发较为持久和有效的T细胞毒性杀伤作用[23]。黏附分子P-选择素糖蛋白配体-1(PSGL-1)分子在效应T细胞上上调,抑制T细胞受体(TCR)和IL-2信号,同时也可以上调PD-1的表达,导致T细胞发生衰竭[24]。在晚期结直肠癌中,抑制PD-1/PD-L1免疫检查点的治疗效果不佳。研究发现,结直肠癌对PD-1/PD-L1免疫检查点治疗的响应如何,与微卫星稳定性具有很大的关系。在MSI-H的结直肠癌患者中,PD-1抗体药的治疗效果明显;而在微卫星稳定(MSS)的患者中,对PD-1阻断的治疗几乎没有响应。研究者检测到,在MSS结直肠癌和胰腺癌患者中,癌细胞表面包被着大量趋化因子CXCL12,CXCL12与其受体CXCR4结合会抑制其他趋化因子对免疫细胞的趋化作用[25],导致淋巴细胞无法在肿瘤组织中积累和活化,因此使用PD-1或者PD-L1抗体药物无法达到预期的效果。此外,CD4+T细胞产生的IL-21在促进细胞毒性T细胞的生成中也起着关键作用,若是CD4+T细胞耗竭,CD8+T细胞也会因此发生功能障碍,并且这种情况下对PD-L1/PD-L1的阻断也无法挽救失活的CD8+T细胞[5]。有报道显示,当采用新辅助化疗之后,非小细胞肺癌患者的免疫应答机制被激活,肿瘤基质中炎性细胞发生募集,Th细胞、NK细胞的增加十分明显,并且表达PD-L1的恶性细胞的密度显著上调[26],这些改变都有利于后续免疫检查点抑制剂的治疗,为多种治疗方案的结合创造可能。
肿瘤在不同患者中的表现形式不同,并且由于肿瘤细胞自身的差异以及周围微环境的差异,特定患者的肿瘤组织也不同,因此免疫治疗虽有很好的效果和预后,但在患者中的响应率很低。过去免疫治疗针对的重心基本都在T细胞上,通过以上的概述,可以了解到在肿瘤发生发展的过程中,肿瘤微环境涉及的多种成分都产生了至关重要的影响。在对T细胞的两个免疫检查点阻断治疗效果不理想时,靶向巨噬细胞、NK细胞、B细胞等是免疫治疗新的方向。对免疫编辑3个阶段中肿瘤微环境的变化更加深入的研究,有助于寻找新的诊断和治疗靶点,更加针对性地对患者进行个体化的治疗,并对治疗方案及时更新,以及对联合用药或者不同疗法的结合起到指导作用。
所有作者均声明不存在利益冲突
1.肿瘤免疫编辑的最后阶段是()
A.免疫消除
B.免疫平衡
C.免疫逃逸
2.可以发挥抗原提呈作用的免疫细胞有()
A.中性粒细胞和嗜酸性粒细胞
B.巨噬细胞和树突状细胞
C.中性粒细胞和巨噬细胞
3.可以促进癌细胞生长的巨噬细胞极化方向是()
A.M1
B.M2
C.M3
4.参与树突状细胞在肿瘤微环境中募集的趋化因子有()
A.CCL5
B.CCL10
C.CCL28
5.对结直肠癌患者使用PD1/PD-L1免疫检查点治疗的检测最佳指标是()
A.癌组织PD-L1高表达
B.癌组织PD-L1高表达+MSS
C.癌组织PD-L1高表达+MSI-H



























