
了解瞬时弹性成像(TE)在评估慢性肝病儿童肝纤维化程度中的应用。
纳入2017年1月至9月在复旦大学附属儿科医院同时进行TE和经皮肝穿刺以进行Scheuer评分的慢性肝病患儿。采用有序Logistic回归分析肝纤维化分级的影响因素,采用受试者工作特征曲线(ROC)分析TE对肝纤维化分级的最佳截断值及曲线下面积(AUC)。
共纳入38例患儿,男28例,女10例,平均年龄7.4岁(1.1~16.0岁),检测成功率为85%。有序Logistic回归显示,仅肝硬度值与肝纤维化分级相关(β=0.055,P<0.001)。TE能有效区分肝纤维化[<S2比≥S2(6.6±4.0) kPa比(21.2±18.6) kPa,P=0.001]、显著肝纤维化[<S3比≥S3(7.4±4.0) kPa比(34.8±19.0) kPa,P=0.000 1]及肝硬化[<S4比S4(10.6±12.3) kPa比(35.8±15.1) kPa,P=0.002]。肝硬度截断值6.89 kPa、14.39 kPa分别预测肝纤维化分级≥S2及≥S3的AUC分别为0.81(P=0.001)、0.94(P<0.001)。
TE是评估慢性肝病儿童肝纤维化程度的无创、有效及可靠的方法。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝穿刺活检被认为是诊断肝纤维化的金标准,然而,肝穿刺是一种有创的操作,存在镇静、出血甚至危及生命的危险[1]。因此肝穿刺不利于肝纤维化的长期随访,也无法满足安全性的需要。近年来无创、方便快速且兼顾准确的肝纤维化检测方法研究成为研究热点。瞬时弹性成像(TE)是2003年法国Sandrin等[2]研制的一种基于超声检测肝纤维的无创方法。目前,TE已被报道能有效地应用于评估乙型肝炎/丙型肝炎、Fontan术后肝纤维化、门脉高压、肝移植术后、囊性纤维化等疾病的肝纤维化程度[3,4,5,6,7,8,9,10]。除TE外,一些生化指标,包括天冬氨酸转氨酶(AST)与血小板比值(APRI)、γ-谷氨酰转肽酶与血小板比值(GPRI)、基于4因子的纤维化指数(FIB-4)等也被广泛用于评估特定疾病的肝纤维化程度[11,12,13]。尽管TE已被广泛报道能用于评价成人肝纤维化,但其在儿童慢性肝病中应用的报道少见。本研究对间隔6个月内进行肝活检的慢性肝病患儿进行TE检测,并与APRI及GPRI比较,评估TE反应慢性肝病患儿肝纤维化程度的可靠性,以供临床医师参考。
纳入2017年1月至9月在复旦大学附属儿科医院住院期间进行了肝脏TE检测,并在间隔6个月内行经皮肝穿刺的慢性肝病患儿。纳入对象的疾病类型包括病毒性肝炎(乙型肝炎/丙型肝炎)、胆汁淤积、Wilson病、自身免疫性肝炎、糖原贮积病、代谢性肝病(1例疑似病例,具体病因不明)及其他病因未明的慢性肝病。排除标准:(1)胸围≤ 45 cm者;(2)体质量指数(BMI)大于人群95%百分位数者;(3)合并腹水者;(4)急性肝功能不全者;(5)肝移植术后1年以内者;(6)合并严重心脏疾病者。
探查病因的患儿在入院期间除进行肝穿刺外,还使用常规的商业试剂检测肝炎病毒抗体及DNA拷贝数、铜蓝蛋白、肝功能[包括总胆红素、结合胆红素、丙氨酸转氨酶(ALT)、AST、γ-谷氨酰转肽酶、碱性磷酸酶、白蛋白]、凝血功能、血脂、自身免疫性肝炎抗体、血糖,腹部B超及基因检测(若家属同意)等病因检查。收集所有患儿住院期间的一般资料、实验室及影像学资料。APRI=AST(/正常上限)/血小板计数(109 /L)×100;GPRI=γ-谷氨酰转肽酶(/正常上限)/血小板计数(109 /L)×100。本研究通过复旦大学附属儿科医院医学伦理委员会批准[批准文号:复儿伦审(178号)],患儿监护人均知情同意并签署知情同意书。
1名接受过培训的医师应用FibroTouch®影像引导无创诊断仪(iLivTouch,海斯凯尔医学科技有限公司,无锡),采用M探头检测肝脏硬度值(LSM)。少数年幼不能配合的患儿需镇静。患儿取仰卧位,右手置于头后,尽量伸展胸廓。首先使用B超探头进行定位,保证探头中心线下5 cm范围内为均匀肝实质,无囊肿、大血管。用探头在定位点对同一测量点进行至少10次有效测量得到肝脏的平均硬度值(kPa),要求检测成功率≥60%,相对偏差<30%。
经局部麻醉或镇静后,由技术熟练的临床医师在穿刺点进行B超引导下的肝穿刺活检。标本经甲醛固定,石蜡包埋切片和常规染色处理。肝穿刺标本由2位经验丰富的病理科医师同时阅片,且病理医师均不知道LSM检测值。肝脏的炎症及纤维化级别根据Scheuer评分系统进行评级[14],肝炎症活动度分5级,分别为G0(Grade 0):汇管区无或轻微病变,小叶无炎症或坏死;G1(Grade 1):汇管区炎症,小叶有炎症无坏死;G2(Grade 2):轻度或局限的界面性肝炎,小叶炎症伴局灶性嗜酸性小体;G3(Grade 3):中度或广泛的界面性肝炎,严重局灶性小叶损伤;G4(Grade 4):重度和更广泛的界面性肝炎,弥漫性小叶损伤或桥接性坏死。肝纤维化程度分为S0(无肝纤维化);S1(汇管区扩大);S2(汇管区纤维化±短纤维间隔,但血管之间关系完整);S3(纤维化伴肝结构扭曲但无明显肝硬化);S4(可能或明确的肝硬化)。本研究定义S0~S2为无/轻度肝纤维化,S3~S4为显著肝纤维化。
采用SPSS 19.0统计软件进行统计分析。使用方差分析比较符合正态性和方差齐性的临床指标[包括年龄、BMI、白蛋白、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、国际标准化比值(INR)、凝血酶原活动度(PTA)、白细胞计数、血红蛋白、血小板计数]在不同肝纤维化分组中的分布差异;采用Kruskal-Wallis检验比较其他非正态分布、方差不齐的临床指标在肝纤维化分组中的差异。采用Kendall′s tau-b相关分析比较肝纤维化与临床指标的相关性。采用有序Logistic回归分析肝纤维化分级的影响因素。采用受试者工作特征曲线(ROC)分析LSM、GPRI及APRI对肝纤维化分级的最佳截断值及曲线下面积(AUC),并获得敏感度及特异度。P<0.05为差异有统计学意义。
共38例纳入本研究。其中男28例,女10例;平均年龄7.4岁(1.1~16.0岁)。38例慢性肝病患儿中,慢性乙型肝炎4例、慢性丙型肝炎2例、肝豆状核变性2例、糖原累积病5例、自身免疫性肝炎4例、非酒精性脂肪性肝病1例、胆汁淤积症5例、代谢性肝病1例及其他病因未明的慢性肝病14例。TE检测的成功率为85%(51/60例),9例检测失败患儿中,4例患儿<2岁,7例患儿<6岁。患儿肝纤维化分级情况:5例为S0、14例为S1、10例为S2、4例为S3、5例为S4。患儿各级肝纤维化的临床指标情况见表1。
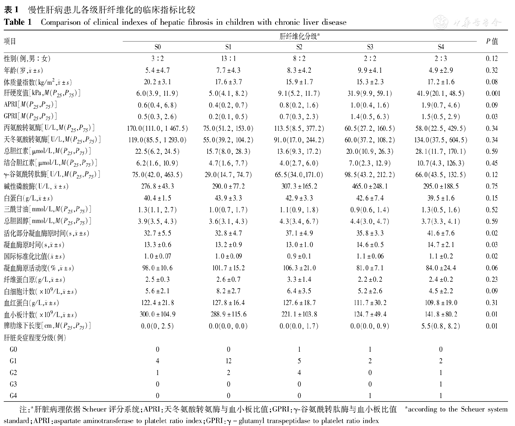
慢性肝病患儿各级肝纤维化的临床指标比较
Comparison of clinical indexes of hepatic fibrosis in children with chronic liver disease
慢性肝病患儿各级肝纤维化的临床指标比较
Comparison of clinical indexes of hepatic fibrosis in children with chronic liver disease
| 项目 | 肝纤维化分级a | P值 | |||||
|---|---|---|---|---|---|---|---|
| S0 | S1 | S2 | S3 | S4 | |||
| 性别(例,男∶女) | 3:2 | 13:1 | 8:2 | 2:2 | 2:3 | 0.12 | |
年龄(岁, ±s) ±s) | 5.4±4.7 | 7.7±4.3 | 8.3±4.2 | 9.9±4.1 | 4.9±2.9 | 0.32 | |
体质量指数(kg/m2, ±s) ±s) | 20.2±3.1 | 17.6±3.7 | 15.9±1.7 | 15.3±2.3 | 17.2±1.6 | 0.08 | |
| 肝硬度值[kPa,M(P25,P75)] | 6.0(3.9,11.9) | 5.0(4.1,8.2) | 9.1(5.2,11.7) | 31.9(9.9, 59.1) | 41.9(20.1, 48.5) | 0.001 | |
| APRI[M(P25,P75)] | 0.6(0.4,6.8) | 0.4(0.2,0.7) | 0.8(0.2,1.6) | 1.0(0.4,1.6) | 1.9(0.7,4.6) | 0.09 | |
| GPRI[M(P25,P75)] | 0.5(0.3,2.6) | 0.2(0.1,0.5) | 0.7(0.3,2.3) | 1.4(0.5,6.3) | 1.5(0.5,2.9) | 0.03 | |
| 丙氨酸转氨酶[U/L,M(P25,P75)] | 170.0(111.0,1 467.5) | 75.0(51.2,153.0) | 113.5(8.5,377.2) | 60.5(27.2,160.5) | 58.0(22.5,429.5) | 0.34 | |
| 天冬氨酸转氨酶[U/L,M(P25,P75)] | 119.0(85.5,1 293.0) | 55.0(39.2,104.2) | 91.0(17.0,244.2) | 60.0(37.2,108.2) | 134.0(37.5,604.5) | 0.34 | |
| 总胆红素[μmol/L,M(P25,P75)] | 22.5(6.2,24.5) | 15.7(8.0,28.3) | 13.6(9.3,17.2) | 20.0(10.9,26.3) | 28.1(11.7,170.1) | 0.59 | |
| 结合胆红素[μmol/L,M(P25,P75)] | 6.2(1.6,10.9) | 4.7(1.6,7.7) | 4.0(2.7,6.0) | 7.0(2.3,12.9) | 10.7(4.3,126.3) | 0.45 | |
| γ-谷氨酰转肽酶[U/L,M(P25,P75)] | 75.0(42.0,463.5) | 29.0(14.7,74.7) | 65.5(34.0,171.0) | 98.5(43.2,212.2) | 66.0(43.5,132.5) | 0.12 | |
碱性磷酸酶(U/L,  ±s) ±s) | 276.8±43.3 | 290.0±77.2 | 307.3±165.2 | 465.0±248.1 | 295.0±188.5 | 0.75 | |
白蛋白(g/L, ±s) ±s) | 40.4±1.5 | 43.9±3.3 | 42.9±3.3 | 42.6±7.4 | 39.5±1.6 | 0.15 | |
| 三酰甘油[mmol/L,M(P25,P75)] | 1.3(1.1,2.7) | 1.0(0.7,1.7) | 1.1(0.9,1.8) | 0.9(0.6,1.4) | 1.3(0.5,1.6) | 0.52 | |
| 总胆固醇[mmol/L,M(P25,P75)] | 3.9(3.5,4.3) | 3.6(3.1,4.3) | 4.3(3.4,6.7) | 4.4(3.0,4.7) | 3.7(3.3,4.1) | 0.59 | |
活化部分凝血酶原时间(s, ±s) ±s) | 32.7±5.5 | 32.8±4.7 | 37.1±4.9 | 35.8±3.3 | 41.6±7.6 | 0.02 | |
凝血酶原时间(s, ±s) ±s) | 13.3±0.6 | 13.2±0.9 | 13.0±1.0 | 14.6±0.5 | 14.7±2.1 | 0.03 | |
国际标准化比值( ±s) ±s) | 1.0±0.07 | 1.0±0.09 | 0.9±0.1 | 1.1±0.06 | 1.1±0.2 | 0.02 | |
凝血酶原活动度(%, ±s) ±s) | 98.0±10.6 | 101.7±15.2 | 106.3±21.0 | 81.0±7.1 | 84.0±24.4 | 0.06 | |
纤维蛋白原(g/L, ±s) ±s) | 2.5±0.3 | 2.6±0.7 | 3.3±1.4 | 2.2±0.2 | 2.4±0.2 | 0.23 | |
白细胞计数(×109/L, ±s) ±s) | 5.6±2.1 | 8.2±2.7 | 6.4±3.5 | 5.2±2.6 | 4.5±2.2 | 0.09 | |
血红蛋白(g/L, ±s) ±s) | 122.4±21.8 | 127.8±16.4 | 127.6±18.7 | 111.7±30.2 | 109.8±19.0 | 0.31 | |
血小板计数(×109/L, ±s) ±s) | 300.0±104.9 | 288.9±115.6 | 221.1±103.8 | 124.7±49.4 | 141.8±80.2 | 0.01 | |
| 脾肋缘下长度[cm,M(P25,P75)] | 0.0(0,2.5) | 0.0(0.0,0.0) | 0.0(0.0,1.7) | 0.0(0.0,0.9) | 5.5(0.8,8.2) | 0.01 | |
| 肝脏炎症程度分级(例) | |||||||
| G0 | 0 | 0 | 1 | 1 | 0 | ||
| G1 | 4 | 12 | 5 | 2 | 2 | ||
| G2 | 1 | 2 | 4 | 0 | 1 | ||
| G3 | 0 | 0 | 0 | 0 | 1 | ||
| G4 | 0 | 0 | 0 | 1 | 1 | ||
注:a肝脏病理依据Scheuer评分系统;APRI:天冬氨酸转氨酶与血小板比值;GPRI:γ-谷氨酰转肽酶与血小板比值
aaccording to the Scheuer system standard;APRI:aspartate aminotransferase to platelet ratio index;GPRI:γ-glutamyl transpeptidase to platelet ratio index
在Kendall′s tau-b相关分析中,APTT(ρ=0.370,P=0.003)、白细胞计数(ρ=-0.250,P=0.044)、血小板计数(ρ=-0.430,P=0.001)、脾肋下长度(ρ=0.349,P=0.013)、GPRI(ρ=0.255,P=0.040)以及LSM(ρ=0.462,P<0.001)与肝纤维化分级均相关。再对这6项指标进行有序多分类Logistic分析显示,仅LSM与肝纤维化分级相关(β=0.055,P<0.001,95%CI:0.035~0.075)。
肝纤维化S0~S4级的LSM值分别为(7.5±5.7) kPa、(6.3±3.4) kPa、(9.0±3.9) kPa、(33.6±25.7) kPa、(35.8±15.1) kPa。TE能有效区分肝纤维化[< S2比≥S2(6.6±4.0) kPa比(21.2±18.6) kPa,P=0.001],显著肝纤维化[<S3比≥S3(7.4±4.0) kPa比(34.8±19.0) kPa,P=0.000 1]及肝硬化[<S4比S4(10.6±12.3) kPa比(35.8±15.1) kPa,P=0.002]。TE是评估有无显著肝纤维化的有效指标,但不能有效区分S0~S2及S3~S4之间的区别(图1)。
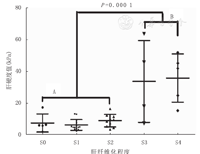

注:A:无/轻微肝纤维化;B:显著肝纤维化
A:non/mild liver fibrosis;B:significant liver fibrosis
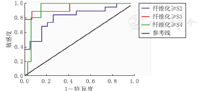
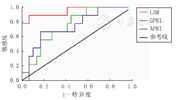
ROC分析提示,纤维化≥S2的LSM截断值为6.89 kPa;显著肝纤维化(≥S3)的LSM截断值为14.39 kPa;肝纤维化达S4的LSM截断值为14.39 kPa(表2、图2)。TE较GPRI(AUC=0.74)、APRI(AUC=0.73)更适合用于区别显著肝纤维化(图3)。


注:LSM:肝硬度值;GPRI:γ-谷氨酰转肽酶与血小板比值;APRI:天冬氨酸转氨酶与血小板比值
LSM:liver stiffness measurement;GPRI:γ-glutamyl transpeptidase to platelet ratio index;APRI:aspartate aminotransferase-to platelet ratio index
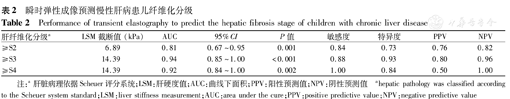
瞬时弹性成像预测慢性肝病患儿纤维化分级
Performance of transient elastography to predict the hepatic fibrosis stage of children with chronic liver disease
瞬时弹性成像预测慢性肝病患儿纤维化分级
Performance of transient elastography to predict the hepatic fibrosis stage of children with chronic liver disease
| 肝纤维化分级a | LSM截断值(kPa) | AUC | 95%CI | P值 | 敏感度 | 特异度 | PPV | NPV |
|---|---|---|---|---|---|---|---|---|
| ≥S2 | 6.89 | 0.81 | 0.67~0.95 | 0.001 | 0.84 | 0.73 | 0.76 | 0.82 |
| ≥S3 | 14.39 | 0.94 | 0.85~1.00 | <0.001 | 0.88 | 0.93 | 0.80 | 0.96 |
| ≥S4 | 14.39 | 0.92 | 0.84~1.00 | 0.002 | 1.00 | 0.84 | 0.50 | 1.00 |
注:a肝脏病理依据Scheuer评分系统;LSM:肝硬度值;AUC:曲线下面积;PPV:阳性预测值;NPV:阴性预测值
ahepatic pathology was classified according to the Scheuer system standard;LSM:liver stiffness measurement;AUC:area under the cure;PPV:positive predictive value;NPV:negative predictive value
TE是一种基于超声的无创检测技术,通过超声换能器将振动器发出的低幅低频振动传向组织,并利用接收器采集组织中弹性剪切波的传播速度,计算得到LSM。LSM值与肝组织硬度相关,组织质地越硬,检测到的硬度值越大。LSM已被报道受许多因素的影响,包括进餐、镇静、肥胖、门脉血流及肝脏炎症[15,16,17,18]。此外,也有报道LSM因地域而异[19]。TE的使用说明中明确指出BMI>人群95%百分位数和/或合并腹水的对象均不适合进行TE检测。并严重心脏疾病可导致肝淤血而显著升高LSM;肝移植术后1年内肝脏病理反映的是炎症情况而非肝纤维化,故将这2种情况设为排除标准。儿童针对不同胸围推荐应用相应的探头型号(S1型用于胸围≤ 45 cm;S2型用于胸围45~75 cm;M型用于胸围>75 cm),本研究未区分胸围,是本研究的不足之一。但昂贵的探头费用会限制TE在儿童中的应用,且文献报道在胸围>45 cm或年龄>1岁的儿童中,用M探头检测的结果是可行的[20,21]。故本研究中设置了6项排除标准以保证研究结果的可靠性。
TE在成人无创肝纤维化的检测中已有广泛应用,甚至被乙型肝炎和丙型肝炎的指南所推荐[22,23]。与成人不同,幼儿因不能配合而影响了TE在部分儿童中的应用。本研究中TE检测的成功率为85%,其中检测失败儿童年龄多<6岁。这与其他文献中TE在1岁以上儿童中的成功率可达至88.5%~97.0%[20,21,24,25],平均检测时间为3~5 min的结果相似[20]。在<1岁的婴儿中,S探头的成功率可达93.6%~99.3%[21,26]。这均支持TE可在儿童中应用,且通过细致的检查前准备来消除紧张情绪可进一步提高检查的成功率。
尽管APTT、白细胞计数、血小板计数、脾肋下长度、GPRI及LSM与肝纤维化分级有相关性,但经有序Logistic分析显示,仅LSM与肝纤维化分级相关,强有力地支持TE是反应肝纤维化更好的工具。经分析可见LSM的阴性预测值高于阳性预测值,表示TE更适合用于阴性预测。本研究中TE能很好地区别肝纤维化分级是否达到显著肝纤维化(≥S3)。LSM截断值为14.39 kPa时,肝脏显著纤维化的敏感度为0.88,特异度为0.93,AUC为0.94(95%CI:0.85~1.00)。最近1篇儿童TE的meta分析中表示,TE分辨显著肝纤维化的灵敏度为95%(95%CI:74%~99%),特异度为90%(95%CI:81%~95%),AUC为0.96(95%CI:0.94~0.98)[27],进一步支持TE是评估儿童肝纤维化的有力检测工具。与GPRI及APRI相比,LSM与肝脏病理分级有更佳的相关性,GPRI次之。故本研究推荐用于反映儿童慢性肝病的无创评价指标的顺序为LSM>GPRI>APRI。
文献报道中用于区别儿童显著肝纤维化的截断值也不统一,取值范围在7.5~14.6 kPa,但多数<10 kPa[28,29,30,31,32]。虽然本研究得出的截断值较高,但其敏感度、特异度及AUC均较高,至于是否有更优的截断值尚有待临床更大样本量的研究,本研究的人数较少,是本研究的另一不足。此外,本研究中TE不能有效区分S0~S2及S3~S4之间的区别,故在应用LSM值进行肝纤维化分级解读时仍需慎重。TE用于肝纤维化的评估还需注意调控与规范TE检测的影响因素,增加TE临床应用经验,以期更好的应用于临床工作中。
所有作者均声明不存在利益冲突



























