
肝脏血供丰富,质地软脆,其切除手术需要确切且安全的出血控制技术。全入肝血流阻断法控血确切但是副损害大,阻断时间有限,解剖性入肝血流阻断副损伤较小,但是在实践过程中存在保留侧肝断面出血较多现象。基于肝血流流域学说,肝段/叶切除界面间存在交通血流即血流交汇带,此为解剖性入肝血流阻断效果不佳原因。实时分合控血技术,针对不同术式,单用或联用多种控血手段,核心特色是控制肝切除界面的血流交汇带处血流,更符合肝脏术中会出现交通血流的特点,因此较解剖性入肝血流阻断能够很好的控制出血,同时减轻全入肝血流阻断的多种副损伤。

肝脏拥有双入肝血流系统,血供丰富,质地软脆,在不阻断肝脏血流的情况下,术中出血量大,长时间手术增加患者全身系统性风险,同时出血占据术野,干扰肝内管道的解剖辨识和保护,影响肝内切线的准确走行,使得肝脏切除手术过程紧张而危险。因此肝脏切除术中需要安全且确切的控血技术,用以减少出血,延长安全手术时间,优化术野暴露,做到安全准确肝脏切除。
现有肝脏控血技术简单分为入肝血流控制和出肝血流控制两种,以前者为主,方法众多,后者为辅,方法相对单一。入肝血流控制技术可分为全肝入肝血流阻断和解剖性入肝血流阻断(即半肝血流阻断和选择性肝段血流阻断)。
Pringle法是全肝入肝血流阻断的代表,1908年提出以来发展至今,通过手法、血管夹或者阻断带完全压迫阻断入肝的肝动脉和门静脉血流[1],还可一定程度上减少肝静脉回流血液,控血效果确切。但该法为非选择性阻断,保留区肝脏会受到热缺血损伤和缺血再灌注损伤,随着阻断时间的延长会带来肝功能不全,门脉血栓形成,胃肠道淤血损伤等问题。对于合并肝脏基础疾病的患者,术后可能出现肝功能衰竭。因此单次Pringle法阻断时长不建议超过15 min,阻断放开5 min后可再次阻断,虽然可多次循环,但是总缺血时间仍然有限。
为了安全地延长入肝血流阻断时间,保护剩余肝脏功能,解剖性入肝血流阻断技术应运而生[2]。解剖性入肝血流阻断只阻断需要切除的肝叶或肝段的入肝血管,再行肝实质离断,一般不会对剩余肝脏造成缺血相关损伤,因此阻断时间没有严格限制,手术可以更加精细和从容,此方法多用于半肝或肝段的切除。
出肝血流控制以降低中心静脉压和肝静脉阻断为主要方法,常规建议采用降低中心静脉压的方法控制出肝血流,而非肝静脉阻断。肝脏回流静脉主干阻断或离断后,将引发肝实质淤血,肝实质离断过程中可能造成更多出血。Chen等[3]提出Pringle法联合肝下下腔静脉主干的阻断,用来减少回心血流,更好地降低中心静脉压,较单用Pringle法控血效果更确切。对于少数围第二肝门或者涉及下腔静脉主干的肝脏手术,甚至提出了更彻底的全肝血流阻断技术,即肝脏入肝血流和肝下、肝上下腔静脉均阻断[4]。
综上所述,现有肝脏控血技术以入肝血流控制之Pringle法和解剖性入肝血流阻断为主,以出肝血流控制之低中心静脉压技术为辅。其中Pringle法阻断效果好,但是肝损伤较大,阻断时间有限;解剖性入肝血流阻断法肝脏损伤较小,安全阻断时间长,但是血流阻断效果不理想;全肝血流阻断效果最确切,但操作复杂,全身血流动力学影响大,应用范围局限。现有肝脏外科手术控血方案并非完美。
现有肝脏控血技术尤其是解剖性入肝血流阻断技术的建立基于肝脏分段理论。研究肝脏动脉、门静脉、胆管、静脉管道系统的走行特点,形成了各有侧重、逐步迭代的多种肝脏分段理论,例如基于肝内静脉走行截面和解剖裂隙的Goldsmith&Woodburne分段[5]和吴孟超的“五叶四段”理论[6],侧重于肝内动脉、胆管走行特点的Healey 分段法[7],基于肝内门静脉-肝静脉双系统的Bismuth 七段法[8]和Couinaud 五叶八段法[9],基于肝内Glisson系统走行特点的Takasaki的肝蒂分段法[10],以及借助前裂静脉,将肝脏看成肝静脉、门静脉系统对称分布的竜崇正分段法[11],随着影像三维重建技术的应用,肝脏右侧管道复杂的变异为人们重视,提出了更个体化的肝脏分段方案[12]。
以上肝脏分段理论均认为肝脏内存在相对独立的解剖和功能单元,即肝脏内各脉管系统呈“树干型”分布,拥有较为完整分支管路的肝脏区域独立成段[12]。借助肝脏分段理论,规划肝脏的切除线位于肝段/肝叶的交界面,解剖性阻断肝段或肝叶的入肝血流后,配合降低中心静脉压技术,控制手术出血,同时保证剩余肝脏的功能完整性[13, 14]。
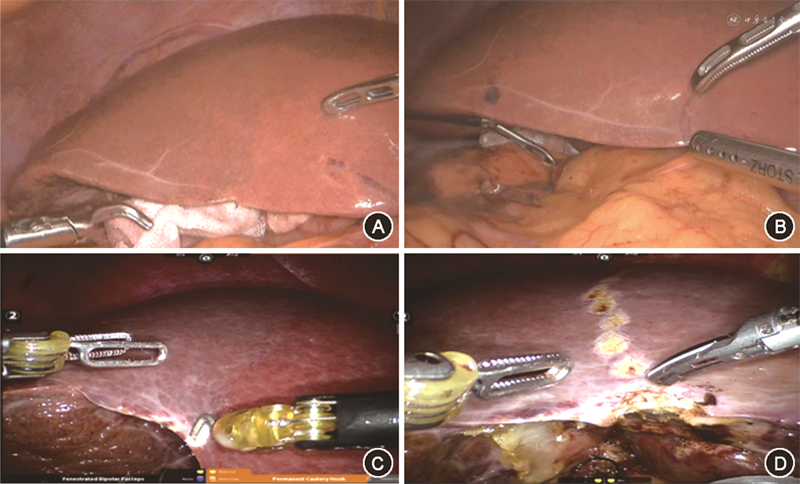
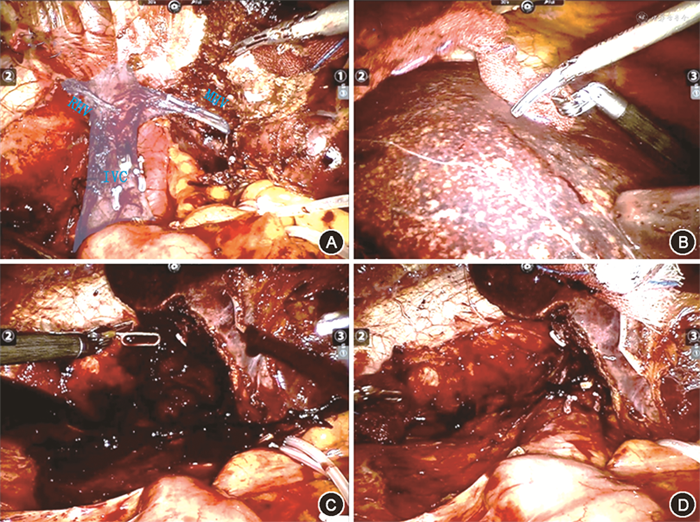
然而,肝脏切除术中,肝脏原有血管解剖结构被破坏,肝脏血流流动方式与自然状态的肝脏“树干型”血流不同。笔者也在大量的机器人和腹腔镜手术放大视野和精细手术的助益下发现基于既有的肝脏管道“树干型”理论不能合理解释的现象:(1)解剖性入肝血流阻断后,随着时间的延长,保留侧肝脏内的血液会流向切除侧肝脏。半肝阻断后,延迟缺血线会向肝脏保留区域扩延并且逐渐模糊甚至消失(图1);(2)解剖性入肝血流阻断下,早期断肝界面上出血较少,阻断晚期肝界面出血不易控制;(3)目标肝段的回流静脉提前阻断时断肝过程中创面出血要比肝静脉未阻断时多,即便是中心静脉压严格控制情况下;(4)入肝血流恢复后,回流静脉被切除的保留侧肝段因静脉淤滞原因创面渗血明显,止血困难,但短时间后肝创面渗血多会自行停止(图2);(5)联合肝脏离断和门静脉结扎的二步肝切除术(ALPPS手术)的一期手术中必须将肝实质离断,单纯门静脉阻断情况下保留侧肝脏增大不明显,术后CT检查提示结扎处门脉主干存在血液再通现象。


基于诸多现象可推测肝脏切除过程中各肝段区域间存在确定却尚未阐明的交通血流,影响着肝段界面上的肝脏离断。比如解剖性肝段、肝叶切除手术中,借助现在肝脏分段方法,目前强调精准解剖出肝段、肝叶血供,利用解剖性入肝血流阻断实施肝脏切除,此时肝段交界区域离断过程中仍然会有可观的出血。此类现象对现有肝脏分段理论和理论指导下的肝脏控血技术产生挑战。
临床潜能形态学下的肝脏流域学说可以用于丰富和优化现在的尸体静态解剖学下的肝脏树干理论[1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16]。肝脏流域学说认为肝内血液的流入和流出,类似于河流流经区域内河水灌溉和流失,各区域由周围的河流共同灌溉,离的越近,灌溉越多,河流径流量越大,灌溉越广;流入河道和流出河道变化时,区域内灌溉的方式也会随之变化,单支流出道受阻时,区域内水流将优先通过毗邻流出道流出。肝脏流域学说可以解释自然状态下肝脏内血流的流入和回流,也可以解释临床手术实践中肝内血流的实时变化,同样显著影响着现有肝脏分段/分区的理念和方法。流域学说下肝脏并非由多个孤立的解剖单元构成,各肝段区域间无明确的解剖界面(现有的界面均是人为设定和假定出来的),肝段间是由周围肝段支配血流交叉融合而形成的交汇带支配。术中解剖性入肝血流阻断后出现的明确缺血线也仅是短时存在,随着区域间潜在交通支开放和术中实时血流的变化,缺血区域会向阻断侧渐进式回缩。此类肝脏动态血流分布现象是肝脏外科医生都经历和察觉过的,但鲜有医生总结成新的肝脏解剖分区理论,并改进控血方法。流域学说理论下现有肝癌根治性切除规划方案也值得探讨。肝癌不仅会沿着血管走行进行解剖区域的播散还可能通过肝段之间交通支向毗邻组织播散。无论是现有肝段分型下单一追求肝脏解剖性区域切除还是强调以肿瘤位置为中心切缘优先的局部切除,两者的根治方式均值得商榷[17],存在肿瘤微卫星灶或微脉管癌栓残留隐患[18]。因此肝癌的切除应该联合荷瘤门脉流域和临近交汇带的切除,按照现有理论即兼顾切缘与解剖性肝切除,以确保肝癌的根治性。
基于肝脏流域学说的适时分合控血技术,其核心是强调控制各肝段区域间交汇带内的血流。“适时”即个体化选择各种控血手段,如前所述,随着外科技术的发展,出现了全入肝血流阻断、解剖性肝段/肝叶血流阻断、出肝血流控制/阻断等基本手段,针对不同患者病情、不同术式,单独“分”或联合“合”上述控血手段,在控制切除肝脏区域及切除界面交汇带内血流的前提下,尽量避免Pringle法全入肝血流阻断。
此方案较普遍使用的单纯Pringle法全入肝血流阻断,能带来较小血流动力学影响,缓解肠道淤血和血栓形成问题,减轻保留肝脏的热缺血及缺血再灌注损伤,延长肝脏控血安全时间。同时较现有肝脏树干理论指导下强调控制肝脏切除界面单侧血流的解剖性肝脏血流阻断,此方案能够控制肝段交汇带血流,控血更彻底,较少术中出血量,尤其能够为微创手术提供更“干净”的术野。
1. 半肝切除术:半肝入肝血流阻断+选择性Pringle法。首先切除侧半肝入肝管道鞘内解剖、离断,切除过程中,根据断肝路线选择性辅以保留侧半肝阻断(此时,可以直接采用Pringle法),减少左右肝交汇带(Cross Interface)内的出血。
2. 中肝区域肝脏切除术:解剖性肝段入肝血流阻断+交替半肝血流阻断。
S5+8肝脏切除术,肝外鞘内或肝实质内(联合Pringle法)鞘外解剖右前肝蒂、离断,离断左侧肝脏断面时阻断左侧半肝入肝血流,此时肝脏右后区域的血供未阻断,离断右侧肝脏断面时阻断右侧半肝入肝血流,此时肝脏左侧半肝区域的血供未阻断,左右侧交替阻断,交替控制S5+8段两侧交汇带内的血液,整个切肝过程中,肝脏血流并未完全阻断,以减少肝脏缺血性损伤。
S4肝脏切除术,肝实质内鞘外(联合Pringle法)解剖S4肝蒂、离断,离断S4段肝脏左右侧肝脏实质时分别联合左右半肝入肝血流阻断,方法同S5+8肝脏切除,左右侧交替,以控制S4段两侧交汇带内的血液,期间分别保留右侧半肝和肝脏左外叶的血供,减少肝脏缺血性损伤。
S4+5+8中肝切除术,肝外或肝实质内解剖右前肝蒂并离断,左侧沿左侧叶间裂离断肝脏时,阻断左侧半肝入肝血流,此时肝脏右后区域的血供未阻断,右侧肝脏离断时阻断右侧半肝入肝血流,此时肝脏左外叶区域的血供未阻断。左右侧交替,术中注意保护左右侧肝静脉主干及左右保留侧肝蒂。
3. 肝段或联合肝段切除术:解剖性肝段入肝血流阻断+选择性半肝血流阻断。
先肝外(无需Pringle法)或肝实质内(联合Pringle法)解剖肝段/肝叶的肝蒂并离断,完成解剖性入肝血流阻断;其次根据肝段所在位置和断肝界面,选择适宜的半肝血流阻断。例如S6+7(右后区)肝脏切除,可以先解剖和离断右后肝蒂,断肝过程中联合右侧半肝血流阻断,用以控制S6+7左侧离断面处交汇带血流,整个切肝过程,左侧半肝的血流未阻断,用以减少肝脏缺血性损伤。
4. 亚肝段切除术:交替式Pringle法和解剖性肝段入肝血流阻断。
Pringle法下阻断入肝血流,肝内鞘外解剖出肝段支配肝蒂,离断亚肝段肝蒂,Pringle法阻断松开后,即刻标记目标亚肝段区域,其后优先采用Pringle法阻断入肝血流,切除亚肝段。例如S8d或S8v段切除。
5. 特殊肝段切除术:S1肝脏切除术,S1解剖相对特殊,门短静脉及支配动脉位置和数量相对不固定,建议直接行Pringle法。肿瘤与下腔静脉关系紧密时建议Pringle法联合肝上和肝下下腔静脉阻断,即全肝血流阻断方法,采用左右结合足侧入路或正中入路离断肝实质,以提高手术安全性。
S2+3肝脏切除术,切肝过程无需入肝血流阻断。采用模式化肝左外叶切除术[20],超声刀粗分离S2+3肝蒂,沿左侧叶间裂打薄肝脏实质,切割闭合器沿肝脏实质最薄处离断肝脏实质、S2+3肝蒂、肝左静脉。没有切割闭合器的情况下可以采用全肝或左侧半肝血流阻断方法,肝内精细解剖分离S2/3肝蒂和左肝静脉,切除左外叶。
根据病变的位置,选择单一Pringle法或解剖性半肝血流阻断为主,少数应采用交替性半肝血流阻断。
适时分合肝脏控血技术推荐常规辅以低中心静脉压的出肝血流控制技术,尽量不阻断回流静脉,但对于超出某一支肝静脉引流区域的肝脏切除术可以将引流区域的肝静脉阻断,如扩大半肝切除,可以在断肝前直接阻断切除侧肝静脉。
另有几点应注意:(1)术中所有半肝阻断不好实施时都可以改为Pringle法;(2)微创下Pringle和半肝血流全腹腔内阻断方法:微创下2/3长度的8号导尿管双次环绕收紧肝十二指肠韧带,借助Hem-o-lock夹固定,术中短暂放开肝门阻断可以使用超声刀离断Hem-o-lock夹,收紧后再夹闭可以实现再次肝门阻断;(3)保留侧半肝血流阻断时一般无需鞘内解剖,简单分离肝十二指肠韧带浆膜后直接采用血管阻断夹夹闭阻断侧肝门即可,如切除侧肝门已离断,Pringle法等同对侧肝门阻断。
不同于现有肝脏控血技术基于的肝脏“树干型”孤立分段理论,适时分合肝脏控血技术脱胎于肝脏切除术中血流动态分布的肝脏流域学说。该技术适时地单独或组合选用各种肝脏控血手段,核心在于控制肝段/叶间血流交汇带,更符合术中肝脏血流的适时变化规律,较解剖性肝脏血流阻断,控血更彻底,同时尽量减少使用Pringle法的全肝入肝血流阻断,减轻全入肝血流阻断的副损害。适用于开腹、腹腔镜和机器人肝脏切除术,有较好的临床价值,但该技术的解剖学基础仍待相关临床试验和动物实验验证。
所有作者均声明不存在利益冲突



























