
探讨基于10 μm级耳科专用CT评估前庭导水管(VA)峡部形态与梅尼埃病(MD)的发生、病程及听力障碍程度的关系。
前瞻性纳入2020年10月至2021年7月在首都医科大学附属北京友谊医院放射科13例梅尼埃病患者的资料,其中男4例,女9例,年龄16~77(56±16)岁。所有患者均使用10 μm级耳科专用CT检查。纳入病变侧耳为患侧组(14侧),非病变侧耳为健侧组(12侧),按1∶2侧纳入性别、侧别匹配的无外、中耳病变者为对照组16例(28侧),其中男4例,女12例,年龄16~77(56±14)岁。以水平半规管显示最大层面为标准横断面,在此图像上连续观察,根据VA峡部显示情况分为Ⅰ~Ⅳ级。采用Kruskal-Wallis检验比较患侧组、健侧组、对照组间VA峡部形态的差异,以纯音测听(PTA)结果评估听力障碍程度,分为正常/轻度/中度/中重度/重度/极重度听力障碍。采用Spearman相关性分析比较患侧VA峡部形态评级与年龄、病程、听力障碍程度间的相关性。
患侧组中VA峡部形态Ⅰ、Ⅱ、Ⅲ、Ⅳ级占比分别为28.6%(4/14)、42.9%(6/14)、21.4%(3/14)、7.1%(1/14),健侧组中占比分别为0(0/12)、33.3%(4/12)、33.3%(4/12)、33.3%(4/12),对照组中占比分别为0(0/28)、7.1%(2/28)、64.2%(18/28)、28.6%(8/28)。MD患侧组VA峡部评分[M(Q1,Q3)]低于MD健侧组[2(1,3)比3(2,4)]及对照组[2(1,3)比3(3,4)](均P<0.05)。MD患侧VA 峡部形态与年龄呈负相关(r=-0.81,P=0.002),与病程、听力障碍程度间均无相关性(r=-0.40、-0.26;均P>0.05)。
MD的VA峡部狭窄,可能是引发MD的解剖因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
前庭导水管(VA)开口于前庭内侧壁,向后开口于岩部后缘,呈倒“J”型,分为近段、峡部与远段[1]。近段较短,远段较长,两者移行处为峡部。内淋巴管走行于VA中,连通内淋巴囊与膜迷路。梅尼埃病(MD)以膜迷路积水为主要病理改变,内淋巴管阻塞学说是公认的发病机制之一[2]。多排螺旋CT受限于分辨尺度,既往研究集中在远段形态评价[2, 3],对峡部、近段等亚毫米结构研究不足[1,4, 5],而钆造影成像能够评价内淋巴积水的情况,但不能清晰显示VA[6]。基于锥形束CT结构,新研发的10 μm级耳科专用CT最小体素达0.05 mm×0.05 mm ×0.05 mm[7],能够清晰显示镫骨、前庭导水管等微小结构[7, 8]。本研究通过对VA峡部显示情况的定性判定,观察峡部在MD发病中的作用。
本研究为病例对照研究,前瞻性纳入2020年10月至2021年7月于首都医科大学附属北京友谊医院放射科行10 μm级耳科专用CT检查的患者资料。患者纳入标准:(1)临床诊断为MD,诊断标准符合梅尼埃病诊断和治疗指南(2017)[9];(2)因MD在本院耳鼻喉科住院治疗。排除标准:(1)图像不完整或图像质量差,影响观察;(2)合并中耳胆脂瘤、中耳炎、外中内耳畸形、耳硬化症等病变;(3)既往耳部外伤史、手术史。患耳纳入患侧组,对侧耳纳入健侧组。最终共纳入MD患者13例,男4例,女9例,年龄16~77(56±16)岁,患侧组14例,健侧组12例。按1∶2侧纳入性别、侧别匹配的无外、中耳病变者为对照组。对照组纳入标准:(1)无MD病史;(2)耳部听力无异常;(3)影像检查未见异常改变或影像仅表现为轻度中耳炎的患者;(4)无颞骨手术史及外伤史。对照组排除标准与MD患者排除标准相同。最终共纳入对照组16例(28侧),男4例,女12例,年龄16~77(56±14)岁。本研究已获得首都医科大学北京友谊医院伦理委员会的审核(2020-P2-061-02),所有患者均签署知情同意书。
收集住院患者的病程及纯音测听(PTA)结果,其中PTA以500 Hz~1 kHz~2 kHz~4 kHz四个频率的听阈均值计算听力损失程度,以纯音测听结果评价听力下降程度。依据世界卫生组织(WHO 2021)听力障碍分级标准[10],将平均听阈分为正常≤20 dBHL,轻度听力障碍20~35 dBHL,中度听力障碍35~50 dBHL,中重度听力障碍50~65 dBHL,重度听力障碍65~80 dBHL,极重度听力障碍80~95 dBHL。
1. 扫描仪器:采用Ultra3D-SE超高分辨力CT扫描仪(北京朗视仪器股份有限公司)进行扫描。使用小视野高清模式,对双侧颞骨分别扫描成像,患者取仰卧位,扫描范围覆盖岩锥弓上隆起至茎乳孔,扫描参数:管电压100 kV、管电流3.5 mA,最小重建体素大小为0.05 mm×0.05 mm×0.05 mm。本研究观察重建体素为0.1 mm×0.1 mm×0.1 mm,重建视野为65 mm×65 mm。扫描层厚及层间距为0.1 mm,层数370层。
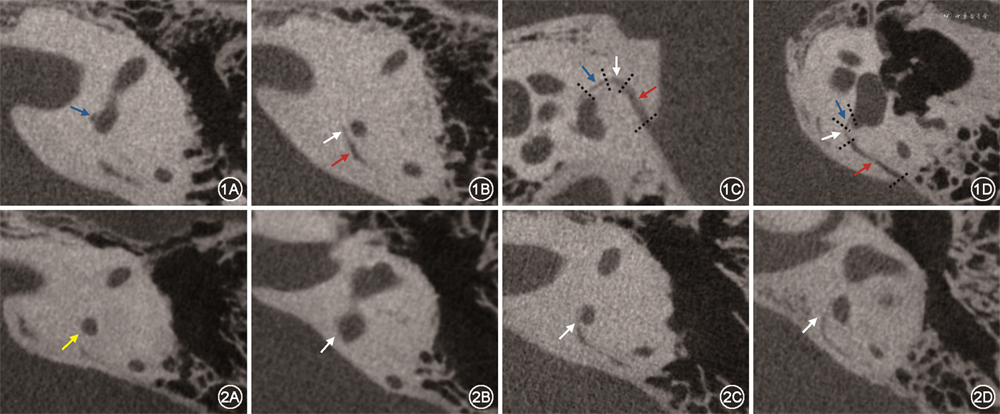
2. 图像分析(扫描本文首页二维码观看图像分析视频):使用Radiant DICOM Viewer(版本2020.2.2)中MPR功能,以水平半规管所在层面为标准横断面,在此层面上对图像进行分析[11]。由2名放射科医师(2年、12年头颈部影像工作经验)双盲、在连续图像中观察VA峡部形态(图1),分歧时协商达成一致。峡部位于内侧段与外侧段移行转折处(图1),根据峡部显示情况分为Ⅰ~Ⅳ级:Ⅰ级为不显示;Ⅱ级为隐约显示;Ⅲ级为显示但边界不清;Ⅳ级为显示且边界清晰(图2)。

应用SPSS 22.0软件对数据进行分析。计量资料符合正态分布,以表示,符合偏态分布,以M(Q1,Q3)表示,采用独立样本t检验比较组间年龄差异;采用频数描述性别、VA显示情况等定性资料,采用Kruskal-Wallis检验(调整后)比较组间VA狭窄程度间差异。采用Spearman相关性分析评估MD患耳VA峡部显示情况与年龄、病程和听力障碍程度间的相关性。双侧检验,检验水准α=0.05。
患侧组与对照组年龄间差异无统计学意义[(56.4±15.2)岁比(54.6±14.3)岁,t=0.38,P=0.720]。
患侧组峡部形态Ⅰ、Ⅱ、Ⅲ、Ⅳ级分别为 28.6%(4/14)、42.9%(6/14)、21.4%(3/14)、7.1%(1/14);健侧组Ⅰ、Ⅱ、Ⅲ、Ⅳ级分别为0(0/12)、33.3%(4/12)、33.3%(4/12)、33.3%(4/12);对照组中Ⅰ、Ⅱ、Ⅲ、Ⅳ级分别为0(0/28)、7.1%(2/28)、64.2%(18/28)、28.6%(8/28)。患侧组峡部显示情况评级低于健侧组[2(1,3)比3(2,4),Z=-2.5,P=0.040]及对照组评级[2(1,3)比3(3,4),Z=-3.8,P<0.001];健侧组与对照组之间差异无统计学意义[3(2,4)比3(3,4),Z=-0.8,P>0.05]。
共12侧PTA结果纳入统计(1例为双侧病变,纳入听力障碍程度较重侧统计,1例PTA结果缺失,未纳入统计)。正常、轻度、中度、中重度、重度、极重度听力障碍分别为0、1、2、6、3、0例,MD病程为3(1,6.5)年。MD患侧VA峡部形态与年龄呈负相关(r=-0.81,P=0.002),与病程、听力障碍程度间均无相关性(r=-0.40、-0.26;均P>0.05)。
VA分为近段、峡部及远段,峡部为近段与远段相移行的转折区,管径细小,传统CT不能很好显示[12]。近年锥形束CT的普及提升了VA的显示率。王争等[1]研究头颅标本VA峡部的显示率为57%(45/79)。Yamane等[13]研究MD患耳VA显示率仅为40%(10/25),健侧耳为68%(17/25)。本研究中MD患者健侧耳VA峡部显示率为100%(28/28)。耳科专用CT通过改进小焦点X线发生器和高分辨率探测器单元,提高图像空间分辨率,进一步提升VA显示率,有助于观察VA峡部在病生理状态下的形态特点,避免解剖测量中标本结构改变及常规CT显示的失真[14]。
本研究前瞻性纳入MD患者,人群筛选更加准确。在连续标准横断面对VA狭窄程度的评估提出新标准。将VA峡部不显影定义为狭窄,是基于新仪器超高分辨力远小于解剖研究中VA的宽度的基础上,观察结果具有说服力。复杂重建方式对VA的显示更佳,但对操作者的要求更高,同时结果差异较大,因此本研究采用横断面观察VA,表现为低密度的管状影,避免复杂的重建方式,便于掌握与应用[15, 16]。
研究结果表明,MD患耳峡部显示率较低,狭窄较重,与解剖学研究中峡部患耳变窄相符[17]。与VA纤细可能是MD特征性影像学改变这一假说相契合[13],结合峡部狭窄程度病程长短并不相关,推测峡部变窄引起内淋巴液循环障碍,从而引发眩晕等一系列症状,狭窄是MD的病因而非结果。患侧组中4耳峡部连续显示,提示除峡部变窄外,存在影响内淋巴液回流的其他因素,现阶段认为内淋巴积水程度还受异常分泌的糖蛋白、VA周围极细的静脉丛回流障碍等多种因素影响[6,18, 19]。同时VA峡部随年龄的增长变窄,提示老年性狭窄可能是MD的发病的解剖因素之一,但正常人VA峡部随年龄变化的趋势尚不清晰,因此未来将继续扩大样本量进一步验证正常人VA峡部的变化特点以及狭窄与内淋巴液循环的关系。
本研究中峡部狭窄与听力障碍程度之间并没有相关性。MD的病理基础是内淋巴积水[20, 21],内淋巴积水引起耳蜗功能障碍,导致听力损失[22]。耳科专用CT反映峡部狭窄而不是直接反映内淋巴积水情况;也不能用VA狭窄压迫内淋巴管导致内淋巴囊的扩张来解释听力的改变。对于听力改变可结合内耳MRI钆造影技术,进一步分析VA峡部狭窄情况造成内淋巴管及内淋巴囊增宽情况及与听力下降间的关系后[23, 24],进一步综合分析。
本研究的局限性在于新设备装机时间较短,MD患者相对较少,本团队将继续扩大样本量进行分析。由于术后时间较短,并未评估术后患者症状改善情况与术前VA通畅程度间的关系,这也是下一步研究的方向。
综上,10 μm级耳科专用CT能够清晰显示VA峡部的形态特点,有利于发现耳部病变的新征象。MD患者峡部较窄,有助于探寻MD发生的机制,并提出峡部形态的评估标准,有利于MD的影像诊断。利益冲突 所有作者均声明不存在利益冲突



























