
探讨中国老年人睡眠时间与日常生活自理能力(ADL)受损的关系。
将2005年3月29日至2019年4月8日中国老年健康影响因素跟踪调查项目随访的11 247名65岁及以上老年人纳入研究。采用自制问卷通过面对面调查收集对象人口社会学特征、健康状况和患病情况等资料。采用基础性日常生活活动能力量表评估对象ADL状况。采用Cox比例风险回归模型评估睡眠时间与ADL受损的关联。采用限制性立方样条函数分析睡眠时间与ADL受损的剂量反应关系。
对象年龄为(79±10)岁,其中女性5 793名(51.5%),ADL受损发病率为33.3%(3 747/11 247),睡眠时间短(<7 h)、中等(7~8 h)和长(>8 h)的人数分别为2 974(26.4%)、4 922(43.8%)和3 351名(29.8%),睡眠时间中等组ADL受损发病密度最低(4.98/100人年)。Cox比例风险回归模型分析显示:以睡眠时间中等为参照,调整性别、年龄、婚姻状况、文化程度、居住地、与家人同住、吸烟、饮酒、锻炼身体、水果摄入频率、蔬菜摄入频率、睡眠质量、高血压、糖尿病、心脏病和脑血管疾病等因素后,睡眠时间长增加ADL受损风险[HR(95%CI):1.148(1.062~1.241)]。亚组分析显示:睡眠时间与年龄存在微弱的正相乘交互作用[HR(95%CI):1.004(1.000~1.009)],与性别不存在相乘模型交互作用[HR(95%CI):0.948(0.870~1.034)]。女性睡眠时间长增加ADL受损发生风险[HR(95%CI):1.195(1.074~1.329)],男性中二者无关联[HR(95%CI):1.084(0.966~1.217)]。80岁及以上人群睡眠时间长增加ADL受损发生风险[HR(95%CI):1.185(1.076~1.305)],80岁以下人群二者无关联[HR(95%CI):1.020(0.890~1.169)]。睡眠时间与ADL受损呈非线性剂量-反应关系(P=0.007),睡眠时间7.5 h时ADL受损风险最低。
睡眠时间与老年人群ADL受损发生风险存在正向关联且呈非线性剂量-反应关系。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前中国处于老龄化加速阶段,平均每年增长620万老年人口,摸清老年人群健康规律、总体健康状况和服务需求尤为重要[1]。睡眠对老年人健康和福祉的影响日益受到关注[2, 3]。美国国家睡眠基金会建议老年人睡眠时间为7~8 h[4]。睡眠时间过短或过长均可增加老年人心血管疾病、骨质疏松和脑卒中等疾病的发病和死亡风险[5, 6, 7, 8, 9, 10],且与老年人认知功能障碍及痴呆相关[11, 12, 13, 14]。日常生活自理能力(ADL)受损同为老年人群重要健康问题[15, 16, 17],而认知功能障碍和心血管危险因素均与老年人ADL受损相关[15,18, 19, 20, 21, 22, 23, 24]。目前,对于睡眠时间与老年人ADL受损关系的研究较少,本研究利用中国老年健康影响因素跟踪调查(CLHLS)资料,探讨65岁及以上老年人睡眠时间与ADL受损的关系。
1.对象:源自CLHLS项目,该项目于1998年采用简单随机抽样在中国23个省份(北京、天津、重庆、上海、广东、广西、湖南、湖北、河南、河北、安徽、福建、海南、黑龙江、辽宁、江西、江苏、吉林、山东、陕西、山西、四川和浙江)抽取1/2的县(区)为现场,将自愿参加调查的老年人纳为对象[15]。选取2005年3月29日至2019年4月8日CLHLS 的调查对象,于2005年开展基线调查,2008—2009、2011—2012、2014和2017—2018年分别进行了4次随访,每次随访均纳入一定数量的新增对象并对其进行基线调查。排除标准为:(1)ADL和睡眠时间基线数据缺失;(2)基线调查时已出现ADL受损;(3)未完成任1次ADL随访。最终将11 247名调查对象纳入分析。本研究通过了北京大学伦理委员会批准(批号:IRB00001052-13074),所有调查对象均由本人或家属签署了知情同意书。
2.方法:采用自制问卷通过面对面调查收集对象的人口社会学特征、健康状况和患病情况(包括高血压、糖尿病等),采用基础性日常生活活动能力量表[25]评估对象ADL状况。
3.相关分类标准:(1)睡眠时间:依据对象自报分为睡眠时间短(<7 h)、中等(7~8 h)和长(>8 h)[4];(2)睡眠质量:依据对象自报分为很好、好、一般、不好、很不好;(3)ADL状况:可独立完成所有基本日常生活活动(包括洗澡、穿衣、进食、室内活动、如厕和控制大小便等)为“ADL正常”,否则为“ADL受损”。
4.质量控制:对调查员进行统一培训;由国家级或省级项目组进行现场督导和质量抽查,抽查问卷份数不低于当地调查总样本数的5%。
5.统计学分析:采用R 4.0.3软件进行统计学描述和分析。年龄符合正态分布,以表示,不同ADL状况对象的组间比较采用独立样本t检验。分类变量以例(%)表示,不同ADL状况对象的组间比较采用χ²检验。以睡眠时间中等为参照[7,23, 24],采用Cox比例风险回归模型分析全部对象和不同性别(年龄)亚组对象睡眠时间与ADL的关系,采用似然比检验分析睡眠时间与年龄的交互作用,采用限制性立方样条函数分析睡眠时间与ADL受损的剂量反应关系,采用敏感性分析检验Cox比例风险回归模型分析结果的稳健性。双侧检验,检验水准α=0.05。
1.基线情况:对象年龄为(79±10)岁,其中女性5 793名(51.5%),ADL受损发病率为33.3%(3 747/11 247),睡眠时间短、中等和长的人数分别为2 974人(26.4%)、4 922人(43.8%)和3 351人(29.8%)。ADL受损组年龄、水果摄入频率、睡眠时间、女性、无配偶、文盲和脑血管疾病占比均高于ADL正常组,吸烟、饮酒比例和蔬菜摄入频率均低于ADL正常组(均P<0.05),两组对象居住地、居住情况、锻炼情况、睡眠质量、高血压、糖尿病和心脏病患病情况的差异无统计学意义(均P>0.05)(表1)。
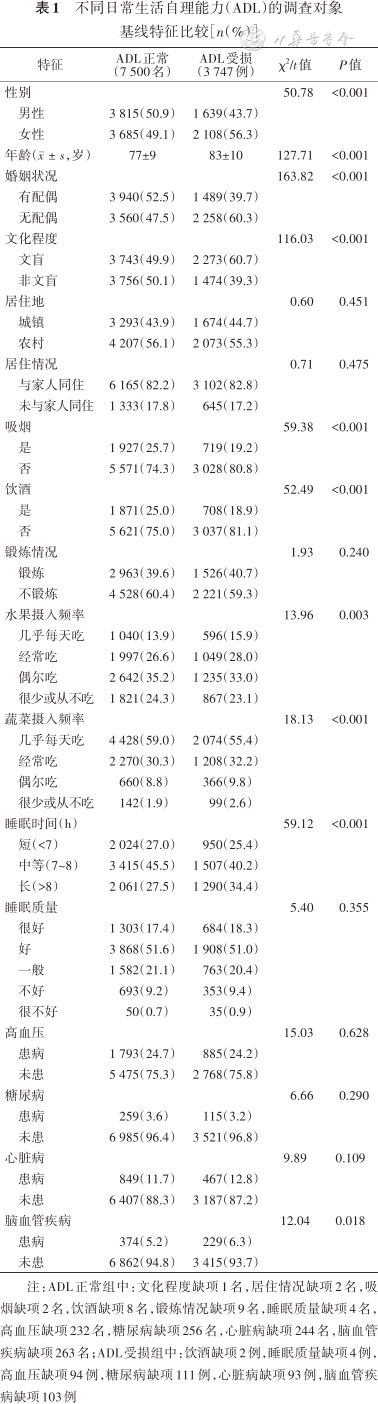
不同日常生活自理能力(ADL)的调查对象基线特征比较[n(%)]
不同日常生活自理能力(ADL)的调查对象基线特征比较[n(%)]
| 特征 | ADL正常(7 500名) | ADL受损(3 747例) | χ2/t值 | P值 |
|---|---|---|---|---|
| 性别 | 50.78 | <0.001 | ||
男性 | 3 815(50.9) | 1 639(43.7) | ||
女性 | 3 685(49.1) | 2 108(56.3) | ||
| 年龄(,岁) | 77±9 | 83±10 | 127.71 | <0.001 |
| 婚姻状况 | 163.82 | <0.001 | ||
有配偶 | 3 940(52.5) | 1 489(39.7) | ||
无配偶 | 3 560(47.5) | 2 258(60.3) | ||
| 文化程度 | 116.03 | <0.001 | ||
文盲 | 3 743(49.9) | 2 273(60.7) | ||
非文盲 | 3 756(50.1) | 1 474(39.3) | ||
| 居住地 | 0.60 | 0.451 | ||
城镇 | 3 293(43.9) | 1 674(44.7) | ||
农村 | 4 207(56.1) | 2 073(55.3) | ||
| 居住情况 | 0.71 | 0.475 | ||
与家人同住 | 6 165(82.2) | 3 102(82.8) | ||
未与家人同住 | 1 333(17.8) | 645(17.2) | ||
| 吸烟 | 59.38 | <0.001 | ||
是 | 1 927(25.7) | 719(19.2) | ||
否 | 5 571(74.3) | 3 028(80.8) | ||
| 饮酒 | 52.49 | <0.001 | ||
是 | 1 871(25.0) | 708(18.9) | ||
否 | 5 621(75.0) | 3 037(81.1) | ||
| 锻炼情况 | 1.93 | 0.240 | ||
锻炼 | 2 963(39.6) | 1 526(40.7) | ||
不锻炼 | 4 528(60.4) | 2 221(59.3) | ||
| 水果摄入频率 | 13.96 | 0.003 | ||
几乎每天吃 | 1 040(13.9) | 596(15.9) | ||
经常吃 | 1 997(26.6) | 1 049(28.0) | ||
偶尔吃 | 2 642(35.2) | 1 235(33.0) | ||
很少或从不吃 | 1 821(24.3) | 867(23.1) | ||
| 蔬菜摄入频率 | 18.13 | <0.001 | ||
几乎每天吃 | 4 428(59.0) | 2 074(55.4) | ||
经常吃 | 2 270(30.3) | 1 208(32.2) | ||
偶尔吃 | 660(8.8) | 366(9.8) | ||
很少或从不吃 | 142(1.9) | 99(2.6) | ||
| 睡眠时间(h) | 59.12 | <0.001 | ||
短(<7) | 2 024(27.0) | 950(25.4) | ||
中等(7~8) | 3 415(45.5) | 1 507(40.2) | ||
长(>8) | 2 061(27.5) | 1 290(34.4) | ||
| 睡眠质量 | 5.40 | 0.355 | ||
很好 | 1 303(17.4) | 684(18.3) | ||
好 | 3 868(51.6) | 1 908(51.0) | ||
一般 | 1 582(21.1) | 763(20.4) | ||
不好 | 693(9.2) | 353(9.4) | ||
很不好 | 50(0.7) | 35(0.9) | ||
| 高血压 | 15.03 | 0.628 | ||
患病 | 1 793(24.7) | 885(24.2) | ||
未患 | 5 475(75.3) | 2 768(75.8) | ||
| 糖尿病 | 6.66 | 0.290 | ||
患病 | 259(3.6) | 115(3.2) | ||
未患 | 6 985(96.4) | 3 521(96.8) | ||
| 心脏病 | 9.89 | 0.109 | ||
患病 | 849(11.7) | 467(12.8) | ||
未患 | 6 407(88.3) | 3 187(87.2) | ||
| 脑血管疾病 | 12.04 | 0.018 | ||
患病 | 374(5.2) | 229(6.3) | ||
未患 | 6 862(94.8) | 3 415(93.7) |
注:ADL正常组中:文化程度缺项1名,居住情况缺项2名,吸烟缺项2名,饮酒缺项8名,锻炼情况缺项9名,睡眠质量缺项4名,高血压缺项232名,糖尿病缺项256名,心脏病缺项244名,脑血管疾病缺项263名;ADL受损组中:饮酒缺项2例,睡眠质量缺项4例,高血压缺项94例,糖尿病缺项111例,心脏病缺项93例,脑血管疾病缺项103例
2.睡眠时间与ADL受损的关系:(1)Cox比例风险回归模型分析显示:以睡眠时间中等为参照,调整性别、年龄、婚姻状况和文化程度等因素后,睡眠时间长增加ADL受损风险[HR(95%CI):1.148(1.062~1.241)],睡眠时间短与ADL受损风险无关联[HR(95%CI):1.026(0.933~1.127)](表2);(2)亚组分析显示:女性睡眠时间长增加ADL受损风险[HR(95%CI):1.195(1.074~1.329)],男性二者无关联[HR(95%CI):1.084(0.966~1.217)],80岁及以上睡眠时间长增加ADL受损风险[HR(95%CI):1.185(1.076~1.305)],80岁以下二者无关联[HR(95%CI):1.020(0.890~1.169)](表3);(3)似然比检验显示:睡眠时间与年龄存在微弱的正相乘交互作用[HR(95%CI):1.004(1.000~1.009)],即睡眠时间对ADL受损风险的作用随研究对象年龄的增加而增加,睡眠时间与性别不存在相乘模型交互作用[HR(95%CI):0.948(0.870~1.034)];(4)敏感性分析显示:剔除重要变量缺失(包括文化程度、居住情况、吸烟、饮酒和锻炼情况等)对象、患病情况或睡眠质量后,睡眠时间与ADL受损风险的关联未发生明显变化;(5)限制性立方样条函数显示:睡眠时间与ADL受损风险呈非线性剂量-反应关系(P=0.007),睡眠时间长与ADL受损风险升高相关,睡眠时间为7.5 h时ADL受损风险最低(图1)。
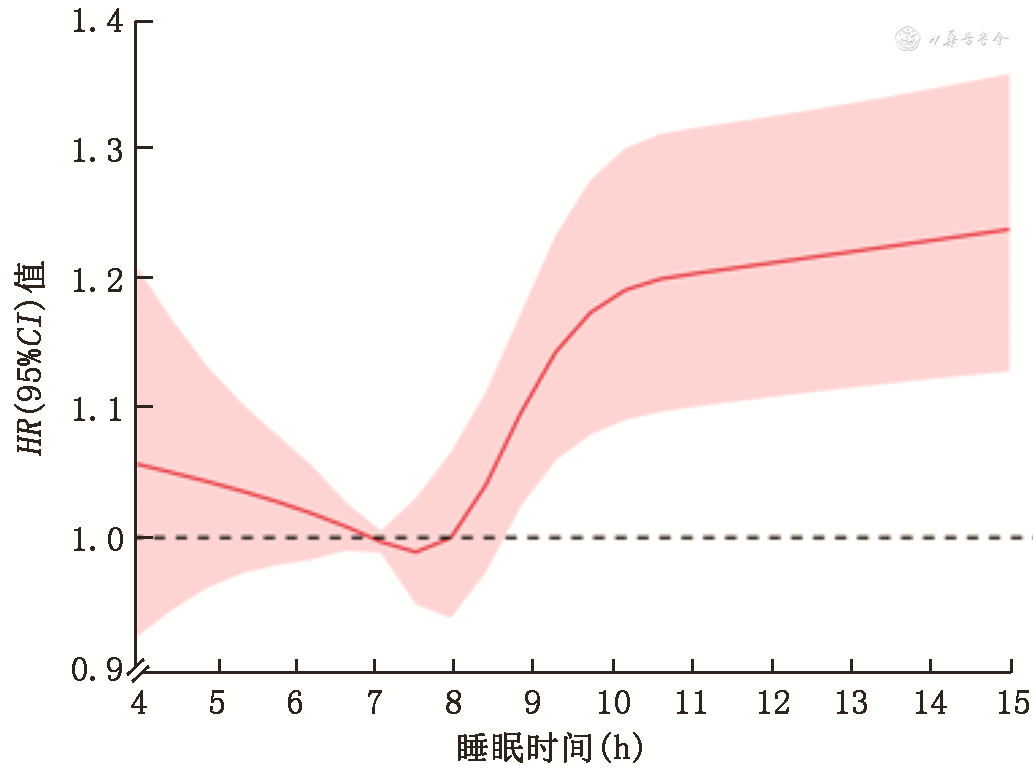

注:红色实线为HR点估计值;粉色区域为HR 95%CI;虚线为参考值;模型调整了性别、年龄、婚姻状况、文化程度、居住地、与家人同住、吸烟、饮酒、锻炼身体、水果摄入频率、蔬菜摄入频率、睡眠质量、高血压、糖尿病、心脏病、脑血管疾病等因素
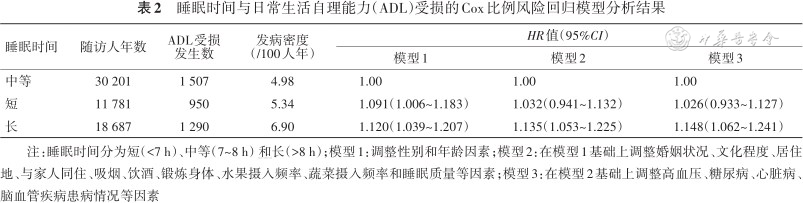
睡眠时间与日常生活自理能力(ADL)受损的Cox比例风险回归模型分析结果
睡眠时间与日常生活自理能力(ADL)受损的Cox比例风险回归模型分析结果
| 睡眠时间 | 随访人年数 | ADL受损发生数 | 发病密度 (/100人年) | HR值(95%CI) | ||
|---|---|---|---|---|---|---|
| 模型1 | 模型2 | 模型3 | ||||
| 中等 | 30 201 | 1 507 | 4.98 | 1.00 | 1.00 | 1.00 |
| 短 | 11 781 | 950 | 5.34 | 1.091(1.006~1.183) | 1.032(0.941~1.132) | 1.026(0.933~1.127) |
| 长 | 18 687 | 1 290 | 6.90 | 1.120(1.039~1.207) | 1.135(1.053~1.225) | 1.148(1.062~1.241) |
注:睡眠时间分为短(<7 h)、中等(7~8 h)和长(>8 h);模型1:调整性别和年龄因素;模型2:在模型1基础上调整婚姻状况、文化程度、居住地、与家人同住、吸烟、饮酒、锻炼身体、水果摄入频率、蔬菜摄入频率和睡眠质量等因素;模型3:在模型2基础上调整高血压、糖尿病、心脏病、脑血管疾病患病情况等因素
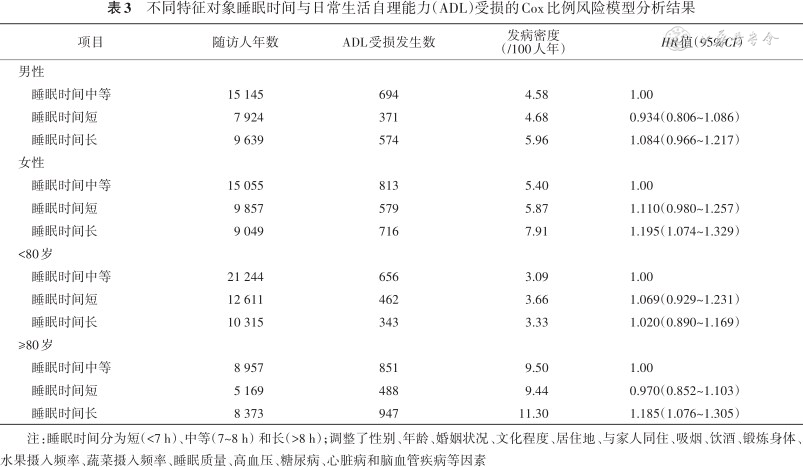
不同特征对象睡眠时间与日常生活自理能力(ADL)受损的Cox比例风险模型分析结果
不同特征对象睡眠时间与日常生活自理能力(ADL)受损的Cox比例风险模型分析结果
| 项目 | 随访人年数 | ADL受损发生数 | 发病密度 (/100人年) | HR值(95%CI) |
|---|---|---|---|---|
| 男性 | ||||
睡眠时间中等 | 15 145 | 694 | 4.58 | 1.00 |
睡眠时间短 | 7 924 | 371 | 4.68 | 0.934(0.806~1.086) |
睡眠时间长 | 9 639 | 574 | 5.96 | 1.084(0.966~1.217) |
| 女性 | ||||
睡眠时间中等 | 15 055 | 813 | 5.40 | 1.00 |
睡眠时间短 | 9 857 | 579 | 5.87 | 1.110(0.980~1.257) |
睡眠时间长 | 9 049 | 716 | 7.91 | 1.195(1.074~1.329) |
| <80岁 | ||||
睡眠时间中等 | 21 244 | 656 | 3.09 | 1.00 |
睡眠时间短 | 12 611 | 462 | 3.66 | 1.069(0.929~1.231) |
睡眠时间长 | 10 315 | 343 | 3.33 | 1.020(0.890~1.169) |
| ≥80岁 | ||||
睡眠时间中等 | 8 957 | 851 | 9.50 | 1.00 |
睡眠时间短 | 5 169 | 488 | 9.44 | 0.970(0.852~1.103) |
睡眠时间长 | 8 373 | 947 | 11.30 | 1.185(1.076~1.305) |
注:睡眠时间分为短(<7 h)、中等(7~8 h)和长(>8 h);调整了性别、年龄、婚姻状况、文化程度、居住地、与家人同住、吸烟、饮酒、锻炼身体、水果摄入频率、蔬菜摄入频率、睡眠质量、高血压、糖尿病、心脏病和脑血管疾病等因素
既往研究多关注睡眠时间与老年人认知功能、其他慢性病发病及死亡风险的关联[26, 27, 28, 29],鲜有研究探讨睡眠时间与ADL受损的关系。在一项基于美国夜班工人研究中,Yong等[30]发现睡眠时间与ADL受损相关;Ishimaru等[31]发现日本痴呆患者睡眠时间长与ADL受损相关。本研究显示:睡眠时间长增加老年人ADL受损发生风险,与上述研究结论一致。
本研究发现睡眠时间与ADL受损发生风险呈U型关系,与既往研究结论一致[32, 33]。睡眠时间与ADL受损的关联机制尚不明确,可能的解释包括:(1)睡眠时间与老年人事故致残风险相关[34];(2)睡眠时间过短或过长均为老年性痴呆的危险因素[35];(3)睡眠时间长与心血管事件风险升高相关[6]。值得注意的是,失眠症状或睡眠障碍与ADL受损相关[36, 37],相关研究表明:睡眠与DNA甲基化、组蛋白修饰等表观基因组的变化相关[38],还可导致学习和记忆等认知功能失调,这为探讨睡眠时间与ADL受损的关联机制提供了新思路。
与睡眠时间和死亡风险相关研究的性别、年龄亚组分析结果类似[34],本研究发现不同亚组人群睡眠时间与ADL受损的关联并不完全一致。男性睡眠时间长与ADL受损无关联,但睡眠时间短可能降低ADL受损风险,这可能是由不同性别内分泌或代谢作用(如睾丸激素)的生理差异造成[39]。
本研究的优势在于:本研究为前瞻性队列研究,样本量较大,目前已完成7轮随访(分别为2000、2002、2005、2008、2011、2014和2018年),是国内随访时间最长的老年健康调查,检验因果能力较强。本研究的局限性包括:(1)通过调查对象自评收集睡眠时间可能存在信息偏倚;(2)对象为中国65岁及以上老年人,结果外推至其他年龄段、地区或种族受到一定限制。
综上,需对睡眠时间长的老年人予以更多关注,建议其睡眠时间不要超过8 h;老年人群睡眠时间与ADL受损关联的确切机制尚需进一步研究。
感谢CLHLS项目组和现场调查的所有工作人员的辛苦付出
所有作者均声明不存在利益冲突



























