
探求特发性正常压力脑积水(iNPH)患者的脑白质病变与脑脊液放液试验结果及临床特征的关系。
回顾性分析2014年至2019年北京协和医院神经科门诊就诊和病房住院的iNPH患者。所有患者都经过详细的神经心理学及行走能力的评估,头磁共振检查和脑脊液放液试验。应用Fazekas评分以及弥散张量技术,比较脑脊液放液试验阳性和阴性组患者的脑白质病变的不同。分析感兴趣区的弥散张量成像技术相关参数各向异性分数(FA)、平均扩散率(MD)与iNPH患者临床特征的相关性。
43例iNPH患者(男∶女为29∶14,年龄52~79岁)被纳入本研究。脑脊液放液试验结果阳性组和阴性组患者相比,倾向于有更高的侧脑室周围白质Fazekas评分[2.5(1.0,3.0)分比1.0(1.0,2.0)分U=108.00,P=0.033],更高的左侧侧脑室后角旁MD值[(1.14±0.27)×10-9 mm2/s 比(0.85±0.08)×10-9 mm2/s,P=0.003],更低的右侧侧脑室前角旁FA值[(0.20±0.07)比(0.27±0.09),P=0.058],更高的右侧侧脑室后角旁MD值[(1.17±0.34)×10-9 mm2/s比(0.95±0.01)×10-9 mm2/s,P=0.003]。双侧侧脑室前角旁白质FA、MD值与运动功能、认知及功能评分、特发性正常压力脑积水评分(iNPHGS评分)均相关(均P<0.05)。
脑白质病变可能是iNPH临床症状的发病机制之一,是通过引流手术可以逆转的病理变化,较多的脑白质病变不应是引流手术的排除指征。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着社会逐渐老龄化,痴呆患病人数逐年增多,带来沉重的社会经济负担。然而,变性病痴呆治疗药物的研发屡屡受挫,在患者中筛选出可治性痴呆是每个临床医生需要重视的问题。特发性正常压力脑积水(idiopathic normal pressure hydrocephalus,iNPH)被认为是唯一可以通过手术治疗改善症状的“可逆性痴呆”[1, 2, 3]。但是其临床表现和影像学与很多老年期常见疾病很容易重叠、混淆,正确诊断和选择手术适应证具有很大的挑战性。
脑白质病变在iNPH患者中很常见,其影像特点很难与缺血性脑白质病变区别。有些研究认为,侧脑室旁和深部脑白质病变使脑可塑性降低,与手术效果呈负相关[4]。这使得对于iNPH合并脑白质病变患者,手术的选择往往很慎重。但是临床工作中可以观察到,iNPH患者通过脑脊液内引流手术治疗,临床症状可以明显缓解,伴有部分脑白质病变明显吸收。故本研究假设:脑白质病变参与iNPH患者的发病机制,病变程度与临床症状及脑脊液引流效果相关,不应作为手术适应证的排除标准。脑脊液放液试验(cerebrospinalfluid tap test,CSF TT)是iNPH诊疗过程中最常用的辅助诊断试验,一次性大容量引流30~50 ml可模拟脑脊液内引流手术的效果。本研究拟通过脑白质病变Fasekas评分及弥散张量成像技术(diffusion tensor imaging,DTI)技术,分析CSF TT阳性和阴性组iNPH患者的脑白质病变的不同,以及脑白质DTI参数与临床症状的相关性。
2014—2019年在中国医学科学院北京协和医院神经科门诊及住院的临床可能的iNPH 61例患者,均符合诊断标准[5, 6]。每例患者进行临床、影像、脑脊液放液试验评估(图1)。临床评估包括特发性正常压力脑积水评分(iNPHgradingscale,iNPHGS)[7]、神经心理学检查[包括简易精神状态检查量表(minimum mental state examination,MMSE)、蒙特利尔认知评估量表(Montreal cognitive Assessment,MoCA)、日常生活能力量表(activities of daihy living,ADL)、北京协和医院认知评估成套测验]。同时均进行头磁共振检查。
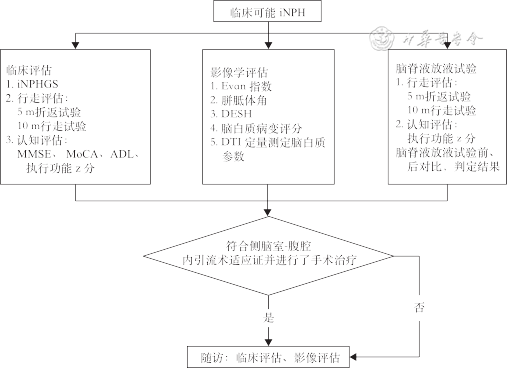

注:iNPH为特发性正常压力脑积水;iNPHGS为特发性正常压力脑积水评分;MMSE为简易精神状态检查量表;MoCA为蒙特利尔认知评估量表;ADL为日常生活能力量表;DESH为不成比例扩大蛛网膜下腔脑积水;DTI为弥散张量成像
队列中的患者进行CSF TT,操作过程见既往报道[8]。评估时间选取放液试验前(即0 h)、放液试验后8、24、72 h作为评估时间点。评估指标有(1)行走能力评估:10 m行走试验时间、步数,5 m折返试验时间(timed up and go test,TUG);(2)认知功能评估:连线A、数字符号、Stroop测验。认知测评结果与中国常模相比,得出z分,将3项认知测评结果平均得出执行功能z分。判定阳性标准:10 m行走试验时间、步数,5 m TUG,任何一个指标如果CSF TT后较放液试验前改善20%,或者时间和步数两个指标同时改善10%,判定为CSF TT阳性。北京协和医院临床可能的iNPH病人评估流程详见图1。
本研究为回顾性研究,纳入本院NPH队列中临床诊断可能的iNPH患者,同时完成CSF TT,并且完成结构核磁和DTI的检测。
本研究通过中国医学科学院北京协和医院伦理委员会审查通过(批号:ZS-907),受试者均签署了知情同意书。
患者在CSF TT之前,均进行3.0 T头核磁共振(GE DISCOVERY MR750,美国)检查,序列包括常规轴位和矢状位T1加权像(T1WI)、T2加权像(T2WI)、液体衰减反转恢复序列(FLAIR);有部分患者进行了DTI序列扫描。测量Evan指数、胼胝体角、观察是否存在不成比例扩大的蛛网膜下腔脑积水征象(disproportion enlarged subarachnoid hydrocephalus,DESH)[9],进行临床辅助诊断。纳入分析的神经影像指标包括:(1)Evans指数:侧脑室左右额角的最大距离与相应层面颅腔最大横径的比值[10];(2)脑白质病灶评分(Fazekas评分)[11]:计分0~3分,并且分为皮质下、侧脑室旁、深部白质3个部位分别评分。影像学读片由2名经验丰富的、不知晓患者临床及CSF TT结果的神经影像科医生完成。
DTI 的成像参数如下:FOV 24 cm×24 cm,采集矩阵96×96,层厚3 mm,无间隔,共48层,TR 6 963 ms,TE 81 ms,b值=1 000 s/mm2,扩散梯度方向数15。
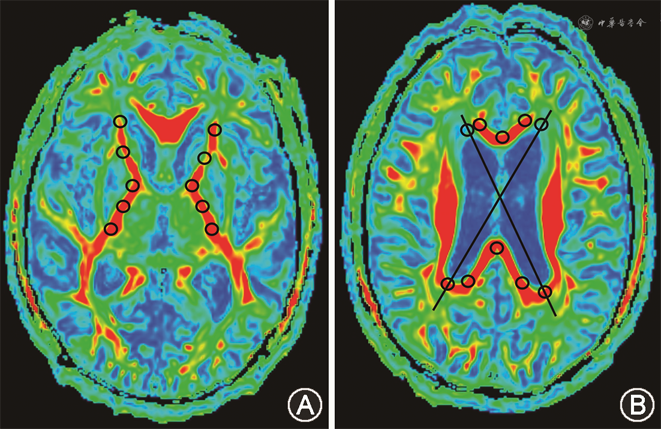
在生成的各向异性分数(fractional anisotropy,FA)图、平均扩散率(mean diffusivity,MD)图上,采用人工手动选取感兴趣区(region of interest,ROI)[12]方法测量19个感兴趣区域FA和MD。选取感兴趣区(轴位)及计算方法:(1)基底节层面:内囊前肢(左、右):前部、中部,取两者测定参数的平均值;内囊膝部;内囊后肢(左、右):前部、中部,取两者测定参数的平均值;(2)侧脑室层面:胼胝体压部:左侧、中部、右侧,取三者测定参数的平均值;胼胝体膝部:左侧、中部、右侧,取三者测定参数的平均值;侧脑室前角旁(左、右);侧脑室后角旁(左、右)(图2)。两名研究者进行测量,并进行一致性检验(Cranbach′s a系数>0.6)。

所有数据分析由SPSS 11.0统计软件完成。本组计量数据符合正态分布的,以表示,计量数据符合偏态分布,以M(Q1,Q3)表示。iNPH患者CSF TT阳性组和阴性组之间的人口学和临床特征,计量数据使用t检验,计数资料采用χ²检验。两组之间的脑白质Fasekas评分使用非参数Mann-Whitney U检验,DTI参数FA、MD值的比较采用t检验。iNPH患者的脑白质病变感兴趣区测定的FA、MD值,与临床特征评估参数包括iNPHGS(总分)、iNPHGS-行走评分、iNPHGS-认知评分、iNPHGS-尿便评分、MMSE、MoCA、ADL、10m行走时间、TUG、执行功能z分之间的相关性,应用spearman相关性分析,双侧检验,检验水准α=0.05。
本研究纳入iNPH患者43例,年龄52~79岁,男∶女比例为29∶14,病程1~7年,iNPHGS总分2~8分,均进行了CSF TT以及头MRI影像的检查。根据CSF TT的结果分为CSF TT阳性组和阴性组,两组患者的年龄、性别、病程及临床特征见表1。
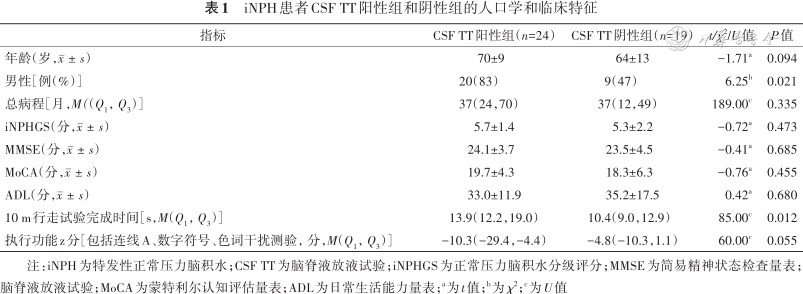
iNPH患者CSF TT阳性组和阴性组的人口学和临床特征
iNPH患者CSF TT阳性组和阴性组的人口学和临床特征
| 指标 | CSF TT阳性组(n=24) | CSF TT阴性组(n=19) | t/χ2/U值 | P值 |
|---|---|---|---|---|
| 年龄(岁,) | 70±9 | 64±13 | -1.71a | 0.094 |
| 男性[例(%)] | 20(83) | 9(47) | 6.25b | 0.021 |
| 总病程[月,M((Q1,Q3)] | 37(24,70) | 37(12,49) | 189.00c | 0.335 |
| iNPHGS(分,) | 5.7±1.4 | 5.3±2.2 | -0.72a | 0.473 |
| MMSE(分,) | 24.1±3.7 | 23.5±4.5 | -0.41a | 0.685 |
| MoCA(分,) | 19.7±4.3 | 18.3±6.3 | -0.76a | 0.455 |
| ADL(分,) | 33.0±11.9 | 35.2±17.5 | 0.42a | 0.680 |
| 10 m行走试验完成时间[s,M(Q1,Q3)] | 13.9(12.2,19.0) | 10.4(9.0,12.9) | 85.00c | 0.012 |
| 执行功能z分[包括连线A、数字符号、色词干扰测验,分,M(Q1,Q3)] | -10.3(-29.4,-4.4) | -4.8(-10.3,1.1) | 60.00c | 0.055 |
注:iNPH为特发性正常压力脑积水;CSF TT为脑脊液放液试验;iNPHGS为正常压力脑积水分级评分;MMSE为简易精神状态检查量表;脑脊液放液试验;MoCA为蒙特利尔认知评估量表;ADL为日常生活能力量表;a为t值;b为χ2;c为U值
iNPH患者的脑白质病变多分布在皮质下侧脑室周围,以侧脑室前后角最为常见。采用脑白质病变Fasekas评分,CSF TT阳性组与阴性组相比,侧脑室旁白质病变Fasekas评分升高(U=108.00,P=0.033),而深部白质、皮质下白质的Faseka评分差异无统计学意义。CSF TT阳性组Evan指数较阴性组差异亦无统计学意义(表2)。
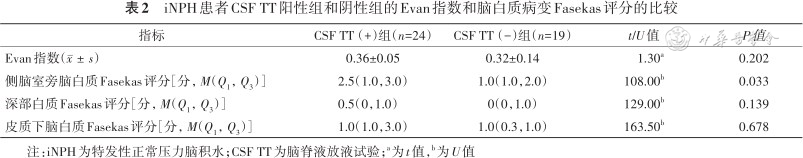
iNPH患者CSF TT阳性组和阴性组的Evan指数和脑白质病变Fasekas评分的比较
iNPH患者CSF TT阳性组和阴性组的Evan指数和脑白质病变Fasekas评分的比较
| 指标 | CSF TT(+)组(n=24) | CSF TT(-)组(n=19) | t/U值 | P值 |
|---|---|---|---|---|
| Evan指数() | 0.36±0.05 | 0.32±0.14 | 1.30a | 0.202 |
| 侧脑室旁脑白质Fasekas评分[分,M(Q1,Q3)] | 2.5(1.0,3.0) | 1.0(1.0,2.0) | 108.00b | 0.033 |
| 深部白质Fasekas评分[分,M(Q1,Q3)] | 0.5(0,1.0) | 0(0,1.0) | 129.00b | 0.139 |
| 皮质下脑白质Fasekas评分[分,M(Q1,Q3)] | 1.0(1.0,3.0) | 1.0(0.3,1.0) | 163.50b | 0.678 |
注:iNPH为特发性正常压力脑积水;CSF TT为脑脊液放液试验;a为t值,b为U值
22例iNPH患者完成了DTI检测,在基底节层面和侧脑室层面选取19个ROI测定FA值、MD值,iNPH患者CSF TT 阳性组(n=12)的左侧侧脑室后角旁MD值明显高于阴性组(n=10)[(1.14±0.27)×10-9 mm2/s 比(0.85±0.08)×10-9 mm2/s,t=3.32,P=0.003],CSF TT 阳性组的右侧侧脑室前角旁FA值低于阴性组[(0.20±0.07)比(0.27±0.09),t=-2.01,P=0.058],右侧侧脑室后角旁MD值也存在CSF TT阳性组高于阴性组[(1.17±0.34)×10-9 mm2/s 比(0.95±0.01)×10-9 mm2/s,t=3.32,P=0.003]。其余的ROI FA值、MD值没有发现两组间差异有统计学意义(均P>0.05)。
将22例iNPH患者的侧脑室旁白质的FA值、MD值,与临床症状评分包括(iNPHGS、MMSE、MoCA、ADL、10m行走时间、TUG、执行功能z分)做spearman相关性分析,发现侧脑室前后角的白质病变FA值、MD值和iNPH患者的临床症状评分有明显相关性(表3)。

与iNPH患者的侧脑室旁脑白质病变FA值、MD值相关的临床特征
与iNPH患者的侧脑室旁脑白质病变FA值、MD值相关的临床特征
| 侧脑室旁脑白质DTI参数 | iNPH患者临床症状定量评分 | r值 | P值 | 侧脑室旁脑白质DTI参数 | iNPH患者临床症状定量评分 | r值 | P值 | |||
|---|---|---|---|---|---|---|---|---|---|---|
| 右侧脑室前角旁 FA值 | 临床总分 | iNPHGS总分 | -0.72 | <0.001 | 左侧脑室前角旁FA值 | 临床总分 | iNPHGS总分 | -0.52 | 0.014 | |
| ADL | -0.67 | 0.007 | 认知 | iNPHGS-认知 | -0.57 | 0.006 | ||||
| 认知 | iNPHGS-认知 | -0.59 | 0.004 | MMSE | 0.70 | 0.002 | ||||
| MMSE | 0.74 | 0.001 | MoCA | 0.86 | <0.001 | |||||
| MoCA | 0.75 | 0.001 | 执行功能z分 | 0.74 | 0.001 | |||||
| 执行功能z分 | 0.74 | 0.001 | 行走 | TUG | -0.58 | 0.016 | ||||
| 行走 | iNPHGS-行走 | -0.55 | 0.008 | 左侧脑室前角旁 MD值 | 临床总分 | iNPHGS总分 | 0.46 | 0.033 | ||
| 10m行走时间 | -0.51 | 0.032 | 认知 | iNPHGS-认知 | 0.47 | 0.027 | ||||
| TUG | -0.61 | 0.010 | MMSE | -0.72 | 0.001 | |||||
| 右侧脑室前角旁 MD值 | 临床总分 | iNPHGS总分 | 0.54 | 0.009 | MoCA | -0.77 | <0.001 | |||
| ADL | 0.56 | 0.030 | 执行功能z分 | -0.76 | 0.001 | |||||
| 认知 | iNPHGS-认知 | 0.53 | 0.012 | 行走 | 10m行走时间 | 0.636 | 0.005 | |||
| MMSE | -0.68 | 0.003 | TUG | 0.75 | <0.001 | |||||
| MoCA | -0.78 | <0.001 | 左侧脑室后角旁 FA值 | 临床总分 | iNPHGS总分 | -0.57 | 0.006 | |||
| 行走 | TUG | 0.54 | 0.025 | 排尿功能 | iNPHGS-排尿 | -0.43 | 0.046 | |||
| 右侧脑室后角旁 FA值 | 认知 | MoCA | 0.57 | 0.018 | 左侧脑室后角旁MD值 | 临床总分 | iNPHGS总分 | 0.43 | 0.047 | |
| 右侧脑室后角旁MD值 | 临床总分 | iNPHGS总分 | 0.56 | 0.007 | 认知 | MoCA | -0.48 | 0.053 | ||
| 认知 | MoCA | -0.54 | 0.025 | |||||||
注:iNPH为特发性正常压力脑积水;FA为各向异性分数;MD为平均扩散率;DTI为弥散张量成像;iNPHGS为正常压力脑积水分级评分;MMSE为简易精神状态检查量表;MoCA为蒙特利尔认知评估量表;ADL为日常生活能力量表;TUG为折返试验时间
其中特别是右侧侧脑室前角旁FA值,与iNPH患者的临床评分、认知评分、行走试验指标显著相关,包括iNPHGS总分、iNPHGS-认知、MMSE、MoCA、ADL、10m行走时间、TUG(P<0.05)。右侧脑室前角旁MD值、左侧脑室前角旁FA值、左侧脑室前角旁MD值、右侧脑室后角旁MD值均与iNPHGS-认知相关(均P<0.05)。右侧侧脑室后角旁FA值与MoCA相关,MMSE有相关趋势。右侧侧脑室后角旁MD值与iNPHGS总分、iNPHGS-认知、MoCA相关,左侧脑室后角旁FA值与iNPHGS总分、iNPHGS-排尿显著相关,左侧脑室后角MD值与iNPHGS总分、MoCA、TUG显著相关(均P<0.05)。
本研究比较iNPH患者CSF TT阳性组与阴性组的脑白质病变,发现侧脑室旁白质病变Fasekas评分在CSF TT阳性组显著升高,侧脑室前后角脑白质DTI参数存在明显差异,并且侧脑室前后角旁白质的DTI参数和临床特征总分、认知及行走试验等多个临床指标显著相关。
1965年Hakim 和Adams[13]最早报道正常压力脑积水患者可以通过手术改善症状。但是iNPH患者由于合并老年期常见疾病[14, 15],诊断和手术适应证的选择很有挑战性。脑白质病变在iNPH患者中常见,影像学特点与脑小血管病并没有明显差异[16, 17],常常困扰诊断和手术适应证选择。
在早期的报道中,NPH合并脑血管病患者进行脑脊液内引流手术后效果不佳[3]。有学者认为iNPH的发病机制可能与血管因素有关,甚至提出可能是血管性痴呆的一种类型[18]。但两种疾病有不同的病理生理机制。iNPH的病因是脑脊液循环动力学障碍,蛛网膜颗粒重吸收功能减退,脑脊液随压力梯度扩散到脑室周围白质,超出毛细血管吸收能力[19],形成脑白质病变。脑室周围组织受损表现为室管膜破裂、水肿、神经元变性和胶质增生[20]。皮质下动脉粥样硬化脑病则表现为脑深部白质闭塞性微血管病变,伴有广泛的脱髓鞘、腔隙和变性[21]。近年来研究发现,iNPH患者合并较多的脑白质病变并不预示脑脊液引流反应差,甚至手术后改善更为明显[17,22]。本研究结果表明CSF TT阳性组侧脑室旁的白质Fasekas评分的DTI参数较阴性组显著异常也支持该结论。
DTI的参数FA和 MD,可以定量评估脑白质传导束的完整性和连通性。既往研究报道,iNPH患者脑白质传导束如丘脑前辐射、上纵束、额枕束、放射冠下纵束、内囊、胼胝体、扣带回、内囊前肢的DTI参数与行走能力和认知功能相关[23, 24, 25, 26],但是联合脑脊液引流效果的分析较少。
本研究重点关注iNPH患者CSF TT阳性和阴性组脑白质病变的不同,并且详细分析了侧脑室前后角白质DTI参数与临床总体评分以及认知、行走、排尿三联征量化指标的相关性。结果显示双侧侧脑室前后角旁脑白质的DTI参数,除了右侧脑室后角外,均与iNPHGS总分呈明显相关,体现了iNPH患者脑白质从前部到后部、广泛受损是其整体临床症状严重程度的病变基础之一。一方面,侧脑室前角旁白质的DTI参数与认知指标呈显著相关,反映了iNPH患者认知障碍与额叶皮质下白质传导束受累相关的病理机制。另一方面,双侧侧脑室前角旁白质(特别是右侧)DTI参数与行走试验指标显著性相关,支持iNPH患者的步态异常因额叶皮质下白质受累所致。本研究结果支持iNPH患者脑脊液渗出造成紧邻侧脑室的脑白质间质性损害是临床症状的病变基础,是潜在可逆性的病变的假设。而双侧侧脑室前后角(特别是右侧侧脑室前角)旁脑白质受累与iNPH临床症状相关,也与既往报道手术后右侧额角脑白质病变减少相一致[22]。
本研究报道了iNPH患者脑白质病变与临床三联征症状紧密相关,并且CSF TT阳性患者合并更明显的脑白质病变。此结论的临床指导意义在于合并脑白质病变较多的iNPH患者不应被排除在手术适应证之外。但是本研究为探索性研究,完成DTI检测的患者较少,存在一定的局限性。另外CSF TT虽然作为脑脊液引流手术效果的模拟,但是并不能真正代替手术的效果。脑白质病变对于手术效果的预判意义,有待于在今后更大样本量并且进行了手术后随访的研究中进一步探寻。
所有作者均声明不存在利益冲突



























