
探讨粪便中SDC2、PPP2R5C及ADHFE1基因甲基化状态及其在结直肠癌和癌前病变筛查中的价值。
招募青岛大学附属青岛市中心医院2020年8月至2021年3月结直肠癌患者64例、腺瘤患者72例、增生性息肉患者33例和健康体检者59名,收集研究对象清晨粪便标本,提取基因组DNA并进行亚硫酸盐修饰处理,采用甲基化特异性聚合酶链反应(MSP)检测SDC2、PPP2R5C及ADHFE1基因的甲基化状态;同时进行粪便隐血试验(FOBT)。以病理结果为金标准,通过受试者工作特征(ROC)曲线及曲线下面积(AUC)比较3个基因甲基化联合检测与FOBT预测结直肠癌和癌前病变的效果。采用R-Studio软件构建粪便基因甲基化联合检测与其他临床特征预测结直肠癌列线图,并行校准验证。
粪便SDC2、PPP2R5C和ADHFE1基因甲基化联合检测在结直肠癌+腺瘤[74.3%(101/136)比47.1%(64/136),χ2=23.20,P=0.001]、结直肠癌[90.6%(58/64)比70.3%(45/64),χ2=8.91,P=0.003]、腺瘤[59.7%(43/72)比26.4%(19/72),χ2=14.43,P=0.002]中的阳性率均高于FOBT,在增生性息肉[21.2%(7/33)比6.1%(2/33),χ2=0.12,P=0.125]、健康对照[10.2%(6/59)比8.5%(5/59),χ2=4.01,P=1.000]中阳性率差异均无统计学意义。基因甲基化联合检测预测结直肠癌+腺瘤的效能优于FOBT[AUC:0.85(95% CI 0.80~0.91)比0.71(95% CI 0.64~0.78),P<0.05],尤其对腺瘤的预测更优于FOBT[AUC:0.82(95% CI 0.74~0.89)比0.64(95% CI 0.57~0.69),P<0.001]。ADHFE1基因甲基化状态预测结直肠癌的灵敏度和特异度均较高(90.6%、96.6%)。在>50岁结直肠癌患者中,基因甲基化联合检测阳性率高于FOBT[90.2%(55/61)比68.9%(42/61),P<0.05]。依据基因甲基化联合检测和各临床特征构建的预测结直肠癌列线图校准曲线显示,预测和观察到的结直肠癌诊断效能之间具有高度一致性。
粪便中SDC2、PPP2R5C及ADHFE1基因甲基化水平在结直肠癌和腺瘤患者中升高,基因甲基化联合检测有望成为结直肠癌及癌前病变筛查的非侵入性检测方法。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是第3常见的癌症,居2020年全球死亡率的第2位[1]。结直肠癌是一种异质性疾病,可能由不同的途径发展而来。60%~80%结直肠癌是通过传统的"腺瘤-癌"途径发展而来的,其特征是一系列致癌基因和抑癌基因发生突变[2,3]。目前需改进筛查方法,在早期筛选出潜在的患者,通过手术切除,延长患者的生存时间[4,5,6]。基于粪便的DNA甲基化检测技术成为判断结直肠癌的一种新兴方法,但其一个明显的局限性是检测灵敏度取决于所选择的生物标志物,这些标志物只能识别大多数而不是所有的结直肠癌。因此寻找和开发合适的标志物组合是推动其临床应用的关键。SDC2、PPP2R5C和ADHFE1基因是癌症筛查潜在的生物标志物[7,8,9,10,11,12],但鲜见将这三者联合检测用于结直肠癌、腺瘤的研究。本研究对粪便中这3个基因甲基化状态进行联合检测,与传统的粪便隐血试验(FOBT)比较,评价3个基因甲基化联合检测在结直肠癌及癌前病变中的诊断价值。
纳入标准:年龄、性别不限;手术前初诊为结直肠癌;临床初诊的结直肠进展性腺瘤患者,腺瘤长径>10 mm;有完善的肠镜、组织病理检查结果;在采集粪便样本前未接受手术、放疗、化疗、靶向治疗及其他方式的肿瘤治疗;签署知情同意书。排除标准:既往患结直肠癌或其他恶性肿瘤;接受过肠道手术、化疗或放疗;炎症性肠病,主要包括溃疡性结肠炎和克罗恩病。2020年8月至2021年3月共招募了我院228例研究对象,均签署知情同意书。根据病理诊断结果,将研究对象分为4组:健康体检者(健康对照组)59名,增生性息肉组33例,腺瘤组72例,结直肠癌组64例。收集研究对象临床病理资料,包括年龄、性别、肿瘤位置、TNM分期、肿瘤分化程度、组织学和病理学检查结果。左半结肠为直肠、乙状结肠和降结肠,右半结肠为横结肠、升结肠和盲肠。本研究经我院伦理委员会批准(批准文号:KY2021-03501)。
在结肠镜检查前至少1 d,将粪便样品(约5 g)收集在50 ml试管中,加入15 ml防腐剂,-80 ℃保存。粪便样品解冻后用摇动装置均匀化1 min。每个试管12 000×g离心15 min。使用TIANamp粪便DNA试剂盒(北京天根生化科技有限公司)提取基因组DNA。用DNA亚硫酸盐转化试剂盒(深圳BGI基因有限公司)进行亚硫酸盐转化,以筛选甲基化DNA。使用NanoDrop 2000超微量分光光度计(美国ThermoFisher科技公司)检测DNA浓度;提纯和转化后,将DNA在-20 ℃保存备用。使用SLAN-96S实时荧光定量聚合酶链反应(qRT-PCR)仪(上海宏石科技有限公司)进行基因扩增,每个样品重复实验3次[13]。使用ADHFE1、SDC2和PPP2R5C基因DNA甲基化特异性聚合酶链反应(MSP)检测试剂盒(深圳华大基因有限公司)定量检测3个基因的甲基化水平,以GAPDH作为内参基因。根据说明书,采用以下公式计算交叉点dCp值,以确定单基因DNA甲基化水平;较低的dCp值代表较高的甲基化水平。共检测3个基因26个位点甲基化状态,甲基化位点数≥5个定义为阳性,<5个为阴性。
目的基因甲基化水平(dCp值)=目的基因dCp值-内参基因dCp值
在获得所有粪便样本后立即进行FOBT检测。将1滴过氧化物催化剂滴在测试卡上,1 min内出现蓝色反应为阳性。
采用SPSS 26.0软件进行统计学分析。计数资料以频数(%)表示,两种检测方法比较采用配对χ2检验。以病理结果为金标准,采用受试者工作特征(ROC)曲线分析粪便基因甲基化检测和FOBT预测结直肠不同病变的效能。计算约登指数[灵敏度+(特异度-1)],用其判断单基因甲基化预测效果时,以最高约登指数对应的MSP检测基因甲基化的dCp值为最佳临界值;用其判断多基因甲基化联合的预测效果时,以任意基因甲基化阳性为最佳临界值,获得相应的灵敏度和特异度,并分析基因甲基化检测和FOBT联合预测结直肠癌的效果。采用R-studio软件构建粪便基因甲基化联合检测预测结直肠癌的列线图及校准曲线。以P<0.05为差异有统计学意义。
228例研究对象年龄为(61±10)岁,包括男性131例(57.5%)。59名健康对照者年龄(52±12)岁,男性22名(44.1%);33例增生性息肉患者年龄(57±10)岁,男性19例(57.6%);72例腺瘤患者年龄(61±8)岁,男性39例(54.2%);64例结直肠癌患者年龄(65±10)岁,男性40例(62.5%)。结直肠癌患者中,TNM分期Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别为2例(3.1%)、11例(17.2%)、20例(31.3%)、25例(39.1%),未确定6例(9.4%);低、中、高分化者分别为10例(15.6%)、49例(76.6%)、5例(7.8%)。14例(42.4%)增生性息肉、43例(59.7%)腺瘤和50例(78.1%)结直肠癌患者病灶均位于左半结肠。
结直肠癌+腺瘤、结直肠癌、腺瘤中粪便SDC2、PPP2R5C和ADHFE1基因甲基化联合检测阳性率均高于FOBT(均P<0.01),在增生性息肉和健康对照中两种检测方法的阳性率差异均无统计学意义(均P>0.05)(表1)。提示3种基因甲基化联合检测在筛查结直肠癌及癌前病变方面比FOBT更灵敏。
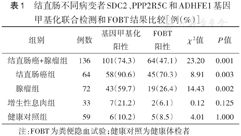
结直肠不同病变者SDC2、PPP2R5C和ADHFE1基因甲基化联合检测和FOBT结果比较[例(%)]
结直肠不同病变者SDC2、PPP2R5C和ADHFE1基因甲基化联合检测和FOBT结果比较[例(%)]
| 组别 | 例数 | 基因甲基化阳性 | FOBT阳性 | χ 2值 | P值 | |
|---|---|---|---|---|---|---|
| 结直肠癌+腺瘤组 | 136 | 101(74.3) | 64(47.1) | 23.20 | 0.001 | |
| 结直肠癌组 | 64 | 58(90.6) | 45(70.3) | 8.91 | 0.003 | |
| 腺瘤组 | 72 | 43(59.7) | 19(26.4) | 14.43 | 0.002 | |
| 增生性息肉组 | 33 | 7(21.2) | 2(6.1) | 0.12 | 0.125 | |
| 健康对照组 | 59 | 6(10.2) | 5(8.5) | 4.01 | 1.000 | |
注:FOBT为粪便隐血试验;健康对照为健康体检者
经ROC曲线分析,以健康对照为对比,利用单基因甲基化检测结果预测结直肠癌时,ADHFE1基因的灵敏度和特异度均最高(表2)。粪便基因甲基化联合检测预测结直肠癌+腺瘤的AUC高于FOBT[0.85(95% CI 0.80~0.91)比0.71(95% CI 0.64~0.78),P<0.05](图1A);粪便基因甲基化联合检测预测结直肠癌的AUC为0.91(95% CI 0.86~0.97)(图1B);基因甲基化联合检测预测腺瘤的效果优于FOBT[0.82(95% CI 0.74~0.89)比0.64(95% CI 0.57~0.69),P<0.001](图1C)。预测增生性息肉时,基因甲基化联合检测和FOBT的AUC差异无统计学意义[0.59(95% CI 0.46~0.72)比0.55(95% CI 0.42~0.68,P>0.05](图1D)。基因甲基化联合检测与FOBT组合时,预测结直肠癌和腺癌的灵敏度进一步提高,分别为100.0%和73.6%。
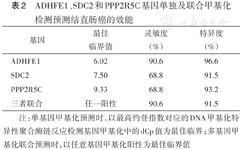
ADHFE1、SDC2和PPP2R5C基因单独及联合甲基化检测预测结直肠癌的效能
ADHFE1、SDC2和PPP2R5C基因单独及联合甲基化检测预测结直肠癌的效能
| 基因 | 最佳临界值 | 灵敏度(%) | 特异度(%) |
|---|---|---|---|
| ADHFE1 | 6.02 | 90.6 | 96.6 |
| SDC2 | 7.50 | 68.8 | 91.5 |
| PPP2R5C | 9.33 | 68.8 | 93.2 |
| 三者联合 | 任一阳性 | 90.6 | 91.5 |
注:单基因甲基化预测时,以最高约登指数对应的DNA甲基化特异性聚合酶链反应检测基因甲基化中的dCp值为最佳临界;多基因甲基化联合预测时,以任意基因甲基化阳性为最佳临界值
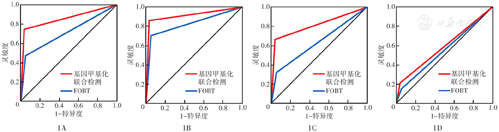

注:FOBT为粪便隐血试验;ROC为受试者工作特征;以病理诊断为金标准;各病变均以健康体检者为对比;基因甲基化联合检测时甲基化位点数≥5个为阳性
粪便SDC2、PPP2R5C和ADHFE1基因甲基化联合检测阳性率在年龄、性别、分化程度、TNM分期和肿瘤部位分层患者间差异均无统计学意义(均P>0.05);FOBT检测时,肿瘤位于左半结肠者阳性率高于右半结肠者(P<0.05),FOBT检测阳性率与其他因素均不相关(均P>0.05)(表3)。年龄不是基因甲基化联合检测和FOBT检测准确性的因素,提示二者对年轻人和老年人有同等的检测价值;基因甲基化联合检测和FOBT检测在筛查51~60岁的结直肠癌患者时均显示出较其他年龄段有良好的价值。在>50岁结直肠癌患者的筛查中,基因甲基化联合检测阳性率高于FOBT[90.2%(55/61)比68.9%(42/61),P<0.05]。依据基因甲基化联合检测和各临床特征构建的预测结直肠癌的列线图(图2A),列线图的校准曲线显示,预测和观察到的诊断结直肠癌效能之间具有高度一致性(图2B),表明构建的预测结直肠癌模型具有较高的辨别和校准能力。
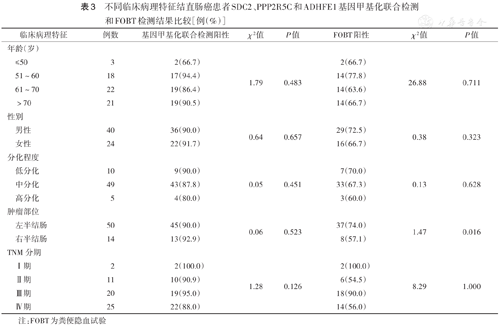
不同临床病理特征结直肠癌患者SDC2、PPP2R5C和ADHFE1基因甲基化联合检测和FOBT检测结果比较[例(%)]
不同临床病理特征结直肠癌患者SDC2、PPP2R5C和ADHFE1基因甲基化联合检测和FOBT检测结果比较[例(%)]
| 临床病理特征 | 例数 | 基因甲基化联合检测阳性 | χ 2值 | P值 | FOBT阳性 | χ 2值 | P值 | |
|---|---|---|---|---|---|---|---|---|
| 年龄(岁) | ||||||||
| ≤50 | 3 | 2(66.7) | 1.79 | 0.483 | 2(66.7) | 26.88 | 0.711 | |
| 51~60 | 18 | 17(94.4) | 14(77.8) | |||||
| 61~70 | 22 | 19(86.4) | 14(63.6) | |||||
| >70 | 21 | 19(90.5) | 14(66.7) | |||||
| 性别 | ||||||||
| 男性 | 40 | 36(90.0) | 0.64 | 0.657 | 29(72.5) | 0.38 | 0.323 | |
| 女性 | 24 | 22(91.7) | 16(66.7) | |||||
| 分化程度 | ||||||||
| 低分化 | 10 | 9(90.0) | 0.05 | 0.451 | 7(70.0) | 0.13 | 0.628 | |
| 中分化 | 49 | 43(87.8) | 33(67.3) | |||||
| 高分化 | 5 | 4(80.0) | 3(60.0) | |||||
| 肿瘤部位 | ||||||||
| 左半结肠 | 50 | 45(90.0) | 0.06 | 0.523 | 37(74.0) | 1.47 | 0.016 | |
| 右半结肠 | 14 | 13(92.9) | 8(57.1) | |||||
| TNM分期 | ||||||||
| Ⅰ期 | 2 | 2(100.0) | 1.28 | 0.126 | 2(100.0) | 8.29 | 1.000 | |
| Ⅱ期 | 11 | 10(90.9) | 6(54.5) | |||||
| Ⅲ期 | 20 | 19(95.0) | 18(90.0) | |||||
| Ⅳ期 | 25 | 22(88.0) | 14(56.0) | |||||
注:FOBT为粪便隐血试验
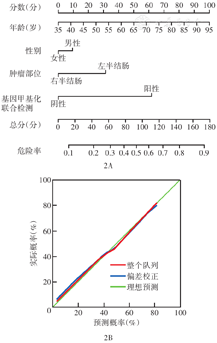

注:偏差校正通过Bootstrapping(1 000次重复)进行;整个队列样本数为150
癌及癌前病变筛查是防治癌症的重要环节。在许多国家,早期筛查项目已被证明能有效降低结直肠癌的发病率和病死率[14]。目前针对一般风险人群的结直肠癌筛查主要有两类:结构性检查和基于粪便的检查。结构性检查主要包括结肠镜检查、结肠气钡双重造影(DCBE)和乙状结肠镜检查(FSIG);粪便检查主要包括FOBT和粪便DNA检测[5]。其中结肠镜检查是最准确的,它可以查看到整个结肠和直肠的情况,同时能切除病灶,具有诊断和治疗的价值。但结肠镜检查也有局限性:由于其侵入性和有肠穿孔的风险,患者很少选择结肠镜作为筛查方法[15]。DCBE也可以检测和评估整个肠道,其为有禁忌证或结肠镜检查失败的患者提供了第2次机会。但是大量的肠道准备工作、对腺瘤的敏感性较低以及无法进行息肉切除或活组织检查,均限制了其应用。虽然FOBT是无创的,但其灵敏度相对较低,而且根据病变的位置不同,可能需要重复筛查或应用结肠镜检查进一步诊断[16]。在我国FOBT被广泛用于结直肠癌的早期筛查,但其灵敏度和特异度均较低[17]。研究发现,粪便DNA甲基化检测对结直肠癌和晚期腺瘤具有较高准确性[18,19,20]。Cologuard法将甲基化生物标志物(BMP3、NDRG4)和突变的KRAS与免疫化学法粪便隐血检测(FIT)相结合,已被美国食品药物管理局(FDA)批准用于结直肠癌筛查[21]。美国癌症协会(ACS)在更新的指南中建议将多靶点粪便DNA检测作为新的结直肠癌筛查方案[22]。由于肿瘤的表型、分子模式和基因型具有高度的异质性,单一的癌症或癌前病变的分子标志物意义有限,因此需要进行生物标志物联合检测。
本研究评估了一个新的DNA甲基化生物标志物组合的诊断效能,其不受性别、年龄、肿瘤位置或分期的影响,对于结直肠癌诊断的灵敏度为90.6%(AUC=0.91),特异度为91.5%。其对于腺瘤诊断的灵敏度也很高(59.7%,AUC=0.82),但在诊断增生性息肉时的灵敏度较低(21.2%,AUC=0.59)。我们选择了3个基因甲基化生物标志物SDC2、PPP2R5C和ADHFE1进行研究,结果显示在结直肠癌的所有分期中都发现了高甲基化的SDC2,基于粪便的SDC2甲基化检测用于筛查结直肠癌具有与Cologuard法同样高的灵敏度[17]。在2017年报道的基于MSP的SDC2甲基化检测中,对于结直肠癌和长径>1 cm腺瘤的灵敏度分别为81.1%和58.2%,特异度为93.3%[23],这与我们的结果一致,提示SDC2是结直肠癌筛查的一个有潜力的甲基化生物标志物。PP2A是一种丝氨酸/苏氨酸磷酸酶,其通过参与细胞生长和分裂的众多负信号传导途径而成为肿瘤抑制因子。有研究显示,抑制PP2A的活性可促进恶性肿瘤的转化[24]。PPP2R5C通过蛋白-蛋白结合界面的突变与PPP2R1A或其他PP2A亚基相互作用,干扰复合物的组装,从而削弱抑癌特性[25]。结直肠癌组织中ADHFE1的下调和高甲基化与结直肠癌患者的分化不良和TNM分期晚有关[26]。
肿瘤生物标志物在肿瘤发生的不同阶段会释放到不同的介质中。粪便DNA检测比血浆DNA检测对结直肠癌的预测有更高的灵敏度。一项荟萃分析显示,在结直肠癌发展过程中,粪便中的异常甲基化生物标志物比血液或尿液中出现更早[27]。因为粪便样本中的DNA直接来自肠道肿瘤或癌前病变,而血浆中的DNA必须通过许多屏障才能最终释放到血液中。因此,基于粪便的检测对于筛查癌前病变和早期癌症更有效、更适合。本研究中,3种基因甲基化检测在筛查腺瘤+Ⅰ期结直肠癌方面比FOBT灵敏度更高(60.8%比28.4%)。此外,基于粪便的检测经常受到肿瘤部位的影响。本研究结果亦显示,FOBT结果受肿瘤位置的影响,这与Ahlquist等[28]的研究结果一致。本研究中FOBT对近端结直肠癌的检测效果优于远端(74.0%比57.1%,P<0.05),而基因甲基化的检测结果不受肿瘤部位的影响(90.0%比92.9%,P>0.05)。
本研究也有一些局限性。本研究中结肠镜检查阴性的人群平均年龄低于结直肠癌组,考虑与结直肠癌起病隐匿有关,且由腺瘤进展为肠癌需10~15年。此外,本研究中结直肠癌患者男性比例高于女性、Ⅰ期结直肠癌和增生性息肉的样本数不足以评估诊断效果、炎症性肠病(溃疡性结肠炎和克罗恩病)患者被排除在外,这需要在未来的研究中纳入更多的患者进一步验证。本研究为回顾性的,应考虑进行多中心的前瞻性研究,以更好地准确评估粪便DNA甲基化检测在结直肠癌及癌前病变筛查中的作用。此外,还需要进一步测试粪便DNA甲基化检测的筛查周期。
本研究结果表明,基于粪便SDC2、PPP2R5C和ADHFE1基因甲基化的联合检测是筛查结直肠癌及癌前病变的潜在方法,将使不愿意接受结肠镜检查的患者受益。今后还需对基因甲基化联合检测的临床效用进一步研究。
所有作者均声明不存在利益冲突



























