
研究常用组织材料脱细胞试剂十二烷基硫酸钠(SDS)、聚乙二醇辛基苯基醚(Triton X-100)和硫代甜菜碱10(SB-10)的残留量与细胞毒性的相关性,并找出控制试剂残留的安全阈值。
参照GB/T 16886.5中的细胞毒性检测方法,分别检测不同质量浓度的SDS、Triton X-100、SB-10对L-929细胞和MC3T3-E1细胞的细胞毒性。细化上述3种脱细胞试剂的质量浓度区间,确定单种试剂残留无细胞毒性的阈值。将3种试剂两两混合或3种共混,通过细胞毒性实验确定试剂混合后无细胞毒性的阈值。
SDS、Triton X-100和SB-10对L-929细胞产生细胞毒性的临界浓度分别为4×10-3、2×10-2和6×10-1 mg/ml,对MC3T3-E1细胞产生细胞毒性的临界浓度分别为6×10-3、4×10-2和2 mg/ml。3种试剂细胞毒性大小趋势为SDS>Triton X-100>SB-10。将临界浓度的3种试剂两两混合或3种共混,对L-929细胞和MC3T3-E1细胞均无细胞毒性。
采用上述3种脱细胞试剂制备脱细胞支架时应采用多种试剂清洗工序,高效清洗组织使试剂残留量低于临界值,以确保脱细胞支架的生物安全性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来脱细胞基质一直是研究的焦点和热点。动物源性组织如同种异体或异种骨、皮肤、肌腱、小肠黏膜等组织材料经脱细胞处理后可得到一种生物相容性优良、免疫原性低的支架材料[1,2,3]。较之大部分合成材料,其具有无法比拟的天然结构,在去除了抗原成分的同时保留了一些对细胞增殖、分化有利的因子,如骨形态发生蛋白、转化生长因子β、血管内皮生长因子等,是一种较为理想的生物支架材料。在组织工程研究领域,脱细胞基质也表现出显著的应用价值[4,5]。
常用的组织脱细胞试剂以十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、聚乙二醇辛基苯基醚(Triton X-100)和硫代甜菜碱10(sulfobetaine 10, SB-10)等表面活性剂为主,其不仅具有清洁组织的作用,对细胞的去除效果也得到了广泛认可[1,6,7]。但上述表面活性剂均具有不同程度的毒性,若清洗不干净,则残留于脱细胞基质中的试剂会对机体造成不同程度的毒副作用[8]。在生物医用材料转化为医疗器械产品的过程中,对于试剂残留也提出了控制要求,应明确试剂残留限度值且试剂残留不应导致细胞毒性。目前,尚未有人系统研究过常用组织脱细胞试剂SDS、Triton X-100和SB-10中一种或多种试剂残留造成细胞毒性的临界浓度。本研究即参照国标GB/T 16886.5中的细胞毒性检测方法,探究不同脱细胞试剂单独或混合使用对小鼠成纤维细胞L-929和小鼠胚胎成骨细胞MC3T3-E1两种细胞系的细胞毒性。
离子型表面活性剂SDS、非离子型表面活性剂Triton X-100(西安天正药用辅料有限公司),两性离子型表面活性剂SB-10(上海阿拉丁生化科技股份有限公司),噻唑蓝(上海碧云天生物技术有限公司),α-MEM培养基、质量浓度为2.5 g/L的胰蛋白酶(美国HyClone公司),青链霉素双抗溶液(美国Gibco公司),胎牛血清(杭州四季青生物有限公司),异丙醇(上海凌峰化学试剂有限公司),无菌磷酸盐缓冲液(phosphate buffered saline, PBS)(武汉赛维尔生物科技有限公司),L-929细胞、MC3T3-E1细胞(上海生命科学研究院细胞中心)。
ECLIPSE Ts2倒置显微镜(日本Nikon公司),QP-160 CO2培养箱(济南鑫贝西生物技术有限公司),INFINITE 200 PRO多功能酶标仪(瑞士Tecan公司),H-1650R台式高速冷冻离心机(湘仪离心机仪器有限公司)。
L-929细胞和MC3T3-E1细胞均采用含体积分数为10%胎牛血清和1%青链霉素的α-MEM培养基,于37 ℃、5%CO2培养箱中培养。每隔1 d换液1次,细胞融合率达约90%时进行细胞传代,采用质量浓度为2.5 g/L的胰蛋白酶溶液消化细胞。
分别取对数生长期的L-929细胞和MC3T3-E1细胞,消化制成单细胞悬液后计数,调整细胞浓度为1.0×105个/ml,按每孔100 μl接种于96孔板中,于37 ℃、5%CO2培养箱中培养24 h;吸弃培养液,PBS洗涤2次,分别加入不同质量浓度的脱细胞试剂液,阴性对照组加入不含脱细胞试剂的新鲜培养基,继续培养24 h;吸弃培养液,每孔加入50 μl质量浓度为1 g/L的噻唑蓝溶液共培养4 h;吸弃噻唑蓝溶液,每孔加入100 μl异丙醇,采用酶标仪检测各孔于570 nm处的吸光度值,计算细胞存活率。
细胞毒性判定:细胞活性下降大于30%认为有细胞毒性(定量);可观察到超过50%的细胞生长抑制现象,即超过50%的细胞呈圆缩状、无胞质内颗粒,大范围溶解(定性)。
由图1,图2,图3可知,3种脱细胞试剂(SDS、Triton X-100和SB-10)对L-929细胞的细胞毒性与其质量浓度呈依赖性关系,随着脱细胞试剂质量浓度的增加,毒性也依次增大。当SDS质量浓度为1×10-3 mg/ml时,细胞存活率为88.2%,表现出明显的细胞毒性;当质量浓度增至1×10-2 mg/ml时,细胞存活率降为45.7%,细胞毒性反应明显;进一步稀释检测得出SDS无细胞毒性的临界浓度为4×10-3 mg/ml,高于该值则表现出显著的细胞毒性。当Triton X-100质量浓度为1×10-2 mg/ml时无细胞毒性,当质量浓度达1×10-1 mg/ml时则表现为显著的细胞毒性,进一步检测得出Triton X-100无细胞毒性的临界浓度为2×10-2 mg/ml。当SB-10质量浓度为1×10-1 mg/ml时无细胞毒性,当质量浓度为1 mg/ml时具有显著的细胞毒性,进而检测出其临界浓度为6×10-1 mg/ml。上述3种脱细胞试剂对L-929细胞产生毒性的临界浓度大小依次为SB-10>Triton X-100>SDS。将上述临界浓度的3种脱细胞试剂两两混合或3种共混加入L-929细胞培养24 h后,均未观察到细胞毒性,表明这3种脱细胞试剂无毒性叠加效应(图4)。


SDS—十二烷基硫酸钠
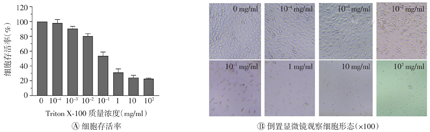

Triton X-100—聚乙二醇辛基苯基醚


SB-10—硫代甜菜碱10
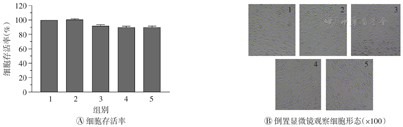

SDS—十二烷基硫酸钠;Triton X-100—聚乙二醇辛基苯基醚;SB-10—硫代甜菜碱10;1—空白;2—SDS+SB-10;3—SDS+Triton X-100;4—Triton X-100+SB-10;5—SDS+Triton X-100+SB-10
由图5,图6,图7可知,3种脱细胞试剂(SDS、Triton X-100和SB-10)对MC3T3-E1细胞的细胞毒性趋势与L-929细胞大致相同,表现为SDS毒性最大(临界浓度最小),Triton X-100次之,SB-10最小。当SDS质量浓度为1×10-3 mg/ml时,细胞存活率为94.6%;质量浓度增至1×10-2 mg/ml时,细胞存活率降至65.4%,且超过50%的细胞呈圆缩状。当Triton X-100质量浓度为1×10-2 mg/ml时,细胞存活率为77.2%;质量浓度增至1×10-1 mg/ml时,细胞存活率降为32.1%,且大部分细胞呈死亡状态。当SB-10质量浓度为1 mg/ml时,细胞存活率为79.6%;质量浓度增至10 mg/ml时,大部分细胞呈死亡状态,细胞存活率为32.8%。进一步检测得出SDS、Triton X-100和SB-10试剂对MC3T3-E1细胞产生毒性的临界浓度分别为6×10-3、4×10-2、2 mg/ml,均高于对L-929细胞的临界浓度。将上述临界浓度的3种脱细胞试剂两两混合或3种共混加入MC3T3-E1细胞培养24 h后,均未观察到细胞毒性,表明这3种脱细胞试剂无毒性叠加效应(图8)。
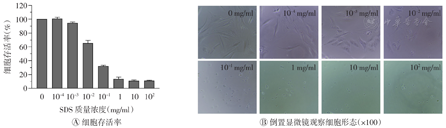

SDS—十二烷基硫酸钠


Triton X-100—聚乙二醇辛基苯基醚
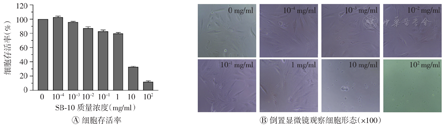

SB-10—硫代甜菜碱10


SDS—十二烷基硫酸钠;Triton X-100—聚乙二醇辛基苯基醚;SB-10—硫代甜菜碱10;1—空白;2—SDS+SB-10;3—SDS+Triton X-100;4—Triton X-100+SB-10;5—SDS+Triton X-100+SB-10
表面活性剂在生活中极为常见,其分子结构一端为极性亲水基团,另一端为非极性疏水基团。根据亲水性头部的带电性质,表面活性剂可分为离子型、非离子型和两性离子型。离子型表面活性剂又因所带电荷不同,分为阳离子型和阴离子型。表面活性剂的独特理化性质使其具有洗涤、分散、乳化、防腐、杀菌等作用,在民用、工业以及生物医药领域应用非常广泛[9]。常见的表面活性剂有季铵化物、硬脂酸、SDS、甜菜碱、聚山梨酯和Triton X-100等。
在组织工程材料研究领域,脱细胞组织/器官因具有天然组织/器官的结构、较好的生物相容性、能为细胞和组织生长提供良好的生物学环境而被广泛应用。表面活性剂则是最常用的脱细胞试剂,其可溶解细胞膜,使DNA与蛋白质分离,有效去除组织中的细胞成分,降低免疫原性,故被广泛应用于同种或异种组织/器官的脱细胞过程[10]。但表面活性剂广泛应用的同时也带来了另一个问题:试剂残留。笔者注意到研究者在使用表面活性剂制备脱细胞支架后,通常使用大量的水或PBS长时间清洗脱细胞支架,以求降低试剂残留量。但却很少有研究讨论常用脱细胞试剂残留量的限度值应为多少,而盲目清洗会造成时间和资源的浪费,甚至对脱细胞支架的性能造成不利影响[1,11]。因此,研究确定表面活性剂的安全浓度值,制定其残留量控制标准显得尤其重要。本研究即选择常用的具有代表性的离子型表面活性剂SDS、非离子型表面活性剂Triton X-100以及两性离子型表面活性剂SB-10,参照国标GB/T 16886.5细胞毒性检测方法,以L-929细胞和MC3T3-E1细胞为模型,探究了上述3种表面活性剂单独或混合使用的细胞毒性临界浓度。
对于L-929细胞,SDS、Triton X-100和SB-10的细胞毒性临界浓度分别为4×10-3、2×10-2和6×10-1 mg/ml,毒性大小依次为SDS>Triton X-100>SB-10。这与表面活性剂本身的作用强弱有一定关联,SDS是一种比较强力的表面活性剂,不仅可溶解细胞膜,还可能打破蛋白质分子内和分子间的相互作用,致使蛋白质变性[12],故SDS表现出较强的细胞毒性。Triton X-100相对于SDS属于较温和的表面活性剂,其细胞毒性临界浓度略低于SDS。两性离子型表面活性剂SB-10最为温和,其细胞毒性临界浓度最大,分别为SDS和Triton X-100临界浓度的150倍和30倍,表明其毒性最小。MC3T3-E1细胞呈现出与L-929细胞相似的趋势,SDS、Triton X-100以及SB-10的临界浓度分别为6×10-3、4×10-2和2 mg/ml。这与以往报道的其他离子型和非离子型表面活性剂细胞毒性数据基本一致,即毒性大小趋势为阳离子型表面活性剂>阴离子型表面活性剂>非离子型表面活性剂[13,14]。本研究结果显示,3种表面活性剂(SDS、Triton X-100和SB-10)对L-929、MC3T3-E1细胞产生毒性的临界浓度不同,对MC3T3-E1细胞的临界浓度大于对L-929细胞,提示表面活性剂对不同细胞的毒性作用/浓度可能存在差异。将上述临界浓度的3种试剂两两混合或3种共混加入L-929、MC3T3-E1细胞培养后,均未观察到细胞毒性,表明这3种试剂无毒性叠加效应。
虽然直接采用不同浓度的试剂进行细胞毒性实验不能完全替代脱细胞支架试剂残留的真实情况,但对于脱细胞支架而言,组织中的试剂残留量应低于组织浸提、洗脱、消解后的试剂残留量。本研究结果可为研究人员采用上述表面活性剂制备脱细胞支架提供一些安全性证据,以便在了解临界浓度后采用多种试剂清洗工序高效清洗组织,使试剂残留量低于临界值,确保脱细胞支架的生物安全性。
所有作者均声明不存在利益冲突



























