
探讨子宫内膜癌(EC)分子分型在术后辅助治疗选择中的应用价值。
回顾性分析2022年1月至2022年4月196例在北京大学第三医院接受手术治疗并且病理分期为Ⅰ期的EC患者的临床资料,分析不同分子分型EC患者术后选择辅助治疗方案的差异。
196例患者的年龄为(55.1±10.2)岁,体质指数(BMI)为(26.0±3.9)kg/m2;POLE突变型19例(9.7%),错配修复系统缺陷型(dMMR)28例(14.3%),无特异性分子谱型(NSMP)142例(72.4%),p53突变型(p53abn)7例(3.6%)。不同分子分型EC患者术后选择辅助治疗方案情况差异有统计学意义(P=0.003)。POLE突变型、dMMR型和NSMP型EC患者术后选择放疗,或者放化疗联合方案情况差异均无统计学意义(均P>0.012 5),p53abn型EC患者术后选择辅助放疗方案情况差异无统计学意义(P=0.209),但术后选择放化疗联合治疗方案情况差异有统计学意义(P<0.001),p53abn型患者选择放化疗联合方案的比例高于非此型别患者[5/7比14.4%(27/188)]。
EC分子分型中的p53abn型患者术后选择放化疗联合治疗方案可能性更大。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
子宫内膜癌(endometrial carcinoma,EC)是发病率最高的女性生殖系统恶性肿瘤之一。随着精准医疗的发展和基因组学的进步,EC分子分型开始在临床得以应用,这不仅仅对EC病理形态学分型起到补充和完善的作用,而且提高了EC诊断的精准率,有利于评估患者预后,对患者个体化治疗有益[1]。2013 年,癌症基因组图谱(the cancer genome atlas,TCGA)首次将EC分为POLE超突变型、高度微卫星不稳定(high microsatellite instability,MSI-H)型、低拷贝型、高拷贝型等4种分子类型,并初步研究了其对患者预后的影响[2]。因上述方法花费巨大,不宜推广,随后,分子分型方法不断改进和变迁,先后出现基于TCGA的EC前瞻性分子危险分类系统(proactive molecular risk classifier for endometrial cancer,ProMisE)、改良的Vancouver方案以及TransPORTEC分型[3, 4],根据一代或二代测序结果,并结合免疫组化,将EC分为4种类型。目前WHO采用如下分子分型[5]:POLE突变型;错配修复系统缺陷(mismatch repair-deficient,dMMR)型(相当于MSI-H型);无特异性分子谱(no-specific molecular profile,NSMP)型(相当于低拷贝型);p53突变(p53abn)型(相当于高拷贝型)。虽然因检测方法各不相同,命名名词亦各不相同,但各种方式具体分类系统大致相似。
由于分子分型模式在国际上开始应用至今尚不足10年,因此,对于EC患者预后及选择相应的针对性治疗策略的研究较少。本研究回顾性分析在北京大学第三医院妇科经手术-病理分期为Ⅰ期的EC患者的临床资料,结合影响EC预后的高危因素,研究EC分子分型是否在早期EC术后辅助治疗中存在影响,为临床上EC的治疗提供依据,现将结果报告如下。
本研究为横断面研究,连续性纳入2020年1月至2022年4月在北京大学第三医院妇科手术治疗的EC患者的临床资料。纳入标准:符合2021年美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)诊治指南的EC诊断标准;临床资料和病例资料完整;手术-病理分期为Ⅰ期。排除标准:因严重心脏、肝脏和肾脏等疾病不能耐受手术及辅助治疗者;同时合并其他恶性肿瘤者;手术-病理分期为Ⅱ期及以上者。最终符合上述标准纳入研究的具有分子分型的Ⅰ期EC患者196例。本研究已通过北京大学第三医院医学科学研究伦理委员会审核(批号:IRB000067612016145),所有患者签署了知情同意书。
1. EC患者分子分型:按照WHO第五版分型标准,将子宫内膜癌患者分为4种分子分型,POLE突变型、dMMR型、NSMP型和p53abn型[5],了解各分子分型在EC患者中的占比。
2. 资料:收集入组EC患者的人口学信息、手术病理资料及术后治疗等,如年龄、合并症、体质指数(body mess index,BMI)、临床病理资料、分子分型、手术-病理分期及术后辅助治疗措施(放疗、放化疗联合治疗、化疗)等,分析EC患者高危因素及分子分型对患者术后辅助治疗选择的影响。
采用SPSS 23.0软件进行数据处理及统计学分析。符合正态分布的连续变量用描述。分类变量采用例数(%)表示,组间比较采用χ²检验或Fisher确切概率法。χ²检验的多重比较采用Bonferroni法校正检验水准,即检验水准为P′=0.05/4=0.012 5。除多重校正外,其他所有检验均为双侧检验,检验水准α=0.05。
196例患者的年龄为(55.1±10.2)岁,BMI为(26.0±3.9)kg/m2;合并高血压55例(28.1%)、糖尿病29例(14.8%)、肥胖(BMI>28 kg/m2)62例(31.6%)、超重(BMI≤28 kg/m2且BMI>24 kg/m2)76例(38.8%);POLE突变型19例(9.7%)、dMMR型28例(14.3%)、NSMP型142例(72.4%)、p53abn型 7例(3.6%);术后无辅助治疗87例(44.4%),有辅助治疗109例(55.6%),其中放疗76例(69.7%),放疗+化疗联合治疗32例(29.4%),单纯化疗1例(0.9%)。所有患者EC术后高危因素及分子分型情况见表1。

196例子宫内膜癌患者临床及病理特征分布
196例子宫内膜癌患者临床及病理特征分布
| 项目 | 例数 | 构成比(%) |
|---|---|---|
| 年龄(岁) >60 ≤60 | 56 140 | 28.6 71.4 |
| 肿瘤直径(cm) >2 ≤2 | 112 84 | 57.1 42.9 |
| LVSI 是 否 | 19 177 | 9.7 90.3 |
| 子宫下段受累 是 否 | 46 150 | 23.5 76.5 |
| 深肌层浸润 是 否 | 24 172 | 12.2 87.8 |
| 分化差 是 否 | 19 177 | 9.7 90.3 |
| Ⅱ型子宫内膜癌 是 否 | 6 190 | 3.0 97.0 |
| 分子分型 POLE突变型 dMMR型 NSMP型 p53abn型 | 19 28 142 7 | 9.7 14.3 72.4 3.6 |
注:LVSI为淋巴血管间隙侵犯;dMMR为错配修复缺陷;NSMP为无特异性分子谱;p53abn为p53突变
年龄>60岁、肿瘤直径>2 cm、淋巴血管间隙侵犯(LVSI)、子宫下段受累、深肌层浸润、分子分型均为术后选择辅助治疗的影响因素(均P<0.05)。因术后单纯化疗病例数过少(1例),未进行统计分析。详见表2。

不同临床及病理特征子宫内膜癌患者术后选择辅助治疗情况比较[例(%)]
不同临床及病理特征子宫内膜癌患者术后选择辅助治疗情况比较[例(%)]
| 项目 | 无辅助 治疗 | 放疗 | 放疗+ 化疗 | χ2值 | P值 |
|---|---|---|---|---|---|
| 年龄(岁) | 29.25 | <0.001 | |||
| >60 | 8(14.3) | 34(60.7) | 14(25.0) | ||
| ≤60 | 79(56.8) | 42(30.2) | 18(13.0) | ||
| 肿瘤直径(cm) | 37.78 | <0.001 | |||
| >2 | 29(25.9) | 60(53.6) | 23(20.5) | ||
| ≤2 | 58(69.9) | 16(19.3) | 9(10.8) | ||
| LVSI | 52.33 | <0.001 | |||
| 是 | 0 | 5(26.3) | 14(73.7) | ||
| 否 | 87(49.5) | 71(40.3) | 18(10.2) | ||
| 子宫下段受累 | 14.50 | <0.001 | |||
| 是 | 10(21.7) | 28(60.9) | 8(17.4) | ||
| 否 | 77(51.7) | 48(32.2) | 24(16.1) | ||
| 深肌层浸润 | 36.31 | <0.001 | |||
| 是 | 0 | 11(45.8) | 13(54.2) | ||
| 否 | 87(50.9) | 65(38.0) | 19(11.1) | ||
| 分化差 | 0.29 | 0.864 | |||
| 是 | 9(50.0) | 6(33.3) | 3(16.7) | ||
| 否 | 78(44.1) | 70(39.5) | 29(16.4) | ||
| Ⅱ型内膜癌 | 0.61 | 0.863 | |||
| 是 | 2(33.3) | 3(50.0) | 1(16.7) | ||
| 否 | 85(45.0) | 73(38.6) | 31(16.4) | ||
| 分子分型 | 18.08 | 0.003 | |||
| POLE突变型 | 12(63.2) | 3(15.8) | 4(21.0) | ||
| dMMR型 | 9(32.1) | 14(50.0) | 5(17.9) | ||
| NSMP型 | 65(46.1) | 58(41.1) | 18(12.8) | ||
| p53abn型 | 1(14.3) | 1(14.3) | 5(71.4) |
注:LVSI为淋巴血管间隙侵犯;dMMR为错配修复缺陷;NSMP为无特异性分子谱;p53abn为p53突变
表3结果显示,不同分子分型EC患者术后选择辅助放疗方案间差异均无统计学意义(均P>0.012 5)。
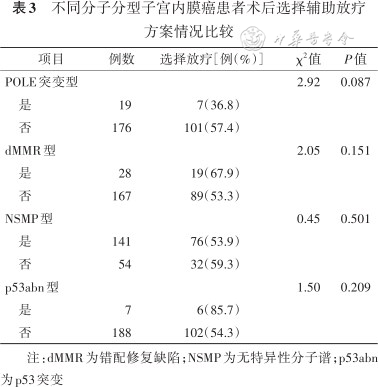
不同分子分型子宫内膜癌患者术后选择辅助放疗方案情况比较
不同分子分型子宫内膜癌患者术后选择辅助放疗方案情况比较
| 项目 | 例数 | 选择放疗[例(%)] | χ2值 | P值 |
|---|---|---|---|---|
| POLE突变型 | 2.92 | 0.087 | ||
| 是 | 19 | 7(36.8) | ||
| 否 | 176 | 101(57.4) | ||
| dMMR型 | 2.05 | 0.151 | ||
| 是 | 28 | 19(67.9) | ||
| 否 | 167 | 89(53.3) | ||
| NSMP型 | 0.45 | 0.501 | ||
| 是 | 141 | 76(53.9) | ||
| 否 | 54 | 32(59.3) | ||
| p53abn型 | 1.50 | 0.209 | ||
| 是 | 7 | 6(85.7) | ||
| 否 | 188 | 102(54.3) |
注:dMMR为错配修复缺陷;NSMP为无特异性分子谱;p53abn为p53突变
NSMP型患者选择放化疗联合方案的比例低于非此型别患者(12.8%比25.9%)(P<0.012 5);p53abn型患者选择放化疗联合方案的比例高于非此型别患者(71.4%比14.4%)(P<0.05);POLE突变型和dMMR型患者术后选择放化疗联合方案构成差异均无统计学意义。详见表4。
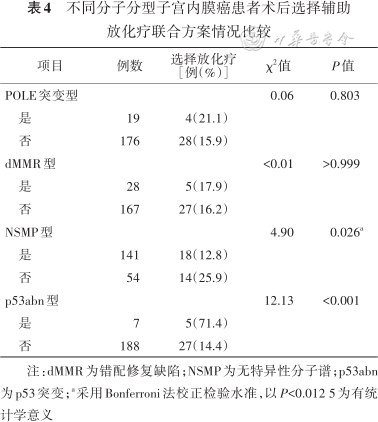
不同分子分型子宫内膜癌患者术后选择辅助放化疗联合方案情况比较
不同分子分型子宫内膜癌患者术后选择辅助放化疗联合方案情况比较
| 项目 | 例数 | 选择放化疗[例(%)] | χ2值 | P值 |
|---|---|---|---|---|
| POLE突变型 | 0.06 | 0.803 | ||
| 是 | 19 | 4(21.1) | ||
| 否 | 176 | 28(15.9) | ||
| dMMR型 | <0.01 | >0.999 | ||
| 是 | 28 | 5(17.9) | ||
| 否 | 167 | 27(16.2) | ||
| NSMP型 | 4.90 | 0.026a | ||
| 是 | 141 | 18(12.8) | ||
| 否 | 54 | 14(25.9) | ||
| p53abn型 | 12.13 | <0.001 | ||
| 是 | 7 | 5(71.4) | ||
| 否 | 188 | 27(14.4) |
注:dMMR为错配修复缺陷;NSMP为无特异性分子谱;p53abn为p53突变;a采用Bonferroni法校正检验水准,以P<0.012 5为有统计学意义
本研究结果显示,EC分子分型除了具有EC预后指导意义外,尚可与组织病理学分型等高危因素相结合,在一定程度上用于指导EC术后辅助治疗。
截至目前,对于EC分子分型的研究,主要集中在预测EC患者的预后上。TCGA研究结果显示,4个分子亚群具有很强的预后意义[2]。POLE突变型患者罕见复发,是预后最好的一类EC[2,6, 7]。NSMP、p53abn均与EC进展、G3级和非子宫内膜样癌(主要是浆液性)组织学有关,其中,NSMP型预后中等,p53abn型预后最差[2,8]。dMMR(MSI-H)型是一种中间危险因素,预后居于POLE超突变型及NSMP型之间[3]。赵路阳等[9]对66例EC患者的预后分析(中位随访时间为10个月)结果显示,随访期内死亡和复发均发生于p53abn型和NSMP型。因此,TCGA分子分型对于EC患者的预后有一定的预测作用,这也为其指导EC术后辅助治疗提供了可能。
基于TCGA分子分型结果,León-Castillo等[10]完成了高危EC患者的随机辅助放化疗与单纯放疗(The randomized Adjuvant Chemoradiotherapy Versus Radiotherapy Alone in Women With High-Risk Endometrial Cancer,PORTEC-3)临床试验。在410例EC中,POLE突变型、MSI-H、低拷贝型和高拷贝型患者的5年无复发生存率(recurrence-free survival,RFS)分别为98%、72%、74%和48%(P<0.001);各组5年辅助治疗(联合放化疗比单独放疗)的RFS分别为:POLE突变型100%比97%(P=0.637);MSI-H型68%比76%(P=0.428);低拷贝型80%比68%(P=0.243);高拷贝型59%比36%(P=0.019)。可见,高拷贝组更能从术后放化疗联合治疗中获益。Santin等[11]研究也发现,POLE突变型肿瘤细胞对铂类药物耐药率明显高于POLE 野生型细胞株,MSI-H(dMMR)型放疗敏感性优于化疗,提示不同分子分型EC生物学行为有所不同。另有文献显示MSI-H(dMMR)型患者接受术后辅助放疗有助于提高疾病特异性生存期,而对于高拷贝(p53abn)型EC患者,化疗可改善预后[12, 13]。
因此,对于预后相对最好和最差的两种类型,即POLE突变型和高拷贝型(p53abn),分子分型对术后添加辅助治疗的指导作用较为明确。对于POLE突变型EC,PORTEC-3研究提示可不进行辅助治疗[10]。ESGO/ESTRO/ESP指南亦建议所有POLE突变型EC,无论其他病理因素如何,Ⅰ~Ⅱ期均为低风险组,不需要术后辅助治疗[8]。本研究结果亦显示POLE突变型不是EC术后选择放疗或放化疗联合治疗的影响因素。
本研究结果中,P53abn型是术后选择放化疗联合治疗的相关因素(P<0.001)。TCGA数据库显示,高拷贝型(p53abn)型包括几乎所有浆液性癌(97.7%)、19.6%高级别EC、5%低级别EC和75%混合组织学肿瘤,与其他亚组相比,预后最差[2]。因此,ESGO/ESTRO/ESP指南结合分子分型及国际妇产科联盟(FIGO)分期对EC患者的预后风险进行评估并分组,根据有无肌层浸润分为中风险组(无肌层浸润)和高风险组(有肌层浸润),进而采取不同的联合辅助治疗方案[14, 15]。在PORTEC-4a试验中,提出对于高-中风险组,在临床预后不良的患者中,将辅助治疗从阴道近距离放疗(VBT)升级为外照射放疗(EBRT)[16];在PORTEC‐3 试验中,与单独放疗相比,高拷贝组(p53abn)无论组织学类型如何,患者在放化疗联合辅助治疗的绝对获益更大(5年RFS放化疗为59%,而放疗为36%)[10]。因此,对于此分子分型,强调更积极地以放化疗联合治疗为主的辅助治疗,这与本研究结果一致。
dMMR和NSMP型在分子分型中属于中度预后组,其对术后辅助治疗选择的价值更加令人关注。本研究中,dMMR型和NSMP型不是术后选择辅助治疗的相关因素。有研究提示,对于上述两种分子分型,FIGO分级、子宫肌层浸润深度,特别是LVSI等是评估肿瘤风险的关键因素[17]。NSMP组与其他分子分型组相比,缺乏特定分子特征,似乎伴随着更异质的生物学行为。Stelloo等[18]发现,位于3号染色体的基因(cadherin-associated protein beta 1,CTNNB1)外显子3突变和L1CAM基因(L1-like adhesion cell molecule gene,L1CAM)表达是该亚组的进一步独立预后因素。CTNNB1突变的存在可能预后中等(类似于MSI-H/dMMR型),而L1CAM在>10%的癌细胞中的表达可能提示预后不良(类似于p53abn/高拷贝型),而未显示这些因素者可能具有良好的预后,类似于POLE突变型。因此,对于这两种分子分型,特别是NSMP型,需联合其他传统高危因素如LVSI和病理分级等来讨论患者的个体风险,制定个体化治疗方案;对其分子事件的进一步研究可能有助于更精确地进行预后分层。
本研究尚有许多不足之处。首先,这是一项单中心回顾性研究,病例数相对较少,与PORTEC-3临床试验报道分型占比有一定出入[12],因此研究结果可能存在一定局限性;但本研究与PORTEC-3中分型占比的差异也提示,中国人与西方人在EC分子分型的分布比例可能有所不同。由于近2年分子分型才开始在国内大型医院较为广泛地应用,因此尚需积累数据并进行多中心联合研究,才能得出属于中国人的分型数据;其次,EC术后辅助治疗的选择受医院、科室、医生及年份跨度等影响很大,本研究为减少选择偏倚,选择近2年的患者,所有患者术后均经过肿瘤多学科联合会诊,集体讨论决定辅助治疗,尽可能保证治疗选择的一致性。但仍需在今后扩大样本量,并对可能影响EC预后的分子事件进行更深层次的研究,以便对本研究结果进行论证。
综上,EC分子分型是EC术后辅助治疗选择的相关因素之一。其中,P53abn(高拷贝)型影响EC术后放化疗联合治疗方案的选择。因此,EC分子分型在EC分期术后辅助治疗选择中具有一定的指导意义。同时,临床医师应综合评估患者的临床病理学特征,结合分子分型,在规范诊疗的基础上为患者制定个体化、精准化、标准化的治疗措施以改善EC患者的预后。
所有作者均声明不存在利益冲突



























