
探讨不同治疗方案治疗初诊急性早幼粒细胞白血病(APL)的临床效果和治疗费用。
回顾性分析2011年1月至2020年12月靖江市人民医院收治的37例初诊APL患者资料,患者接受不同治疗方案进行诱导治疗及完全缓解(CR)后巩固治疗,其中11例接受全反式维甲酸(ATRA)联合蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固(ATRA+化疗组);13例接受ATRA联合三氧化二砷(ATO)+蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固(ATRA+ATO+化疗组);13例接受ATRA联合ATO双诱导治疗,缓解后以ATRA联合ATO巩固(ATRA+ATO双诱导组)。分析3组初诊APL患者的临床疗效和治疗费用。
ATRA+化疗组、ATRA+ATO+化疗组和ATRA+ATO双诱导组中获得CR患者分别有10、12、12例,差异无统计学意义(P>0.05)。3组间血液学、心脏、消化道不良反应和感染发生差异均无统计学意义(均P>0.05)。ATRA+化疗组、ATRA+ATO+化疗组、ATRA+ATO双诱导组诱导治疗费用分别为(73 755±4 820)元、(74 101±5 097)元、(52 944±4 099)元,巩固治疗费用分别为(26 366±2 497)元、(25 801±2 528)元、(19 674±1 940)元,治疗时间分别为(41±4)d、(39±4)d、(34±3)d,差异均有统计学意义(F值分别为84.77、31.90、9.62,均P<0.001)。
ATRA联合ATO进行诱导及巩固的无化疗治疗方案治疗初诊APL患者,在临床疗效无明显差异的情况下,具有成本效益高的优势。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性早幼粒细胞白血病(APL)是急性髓系白血病的一个特殊类型,临床表现以凝血功能异常、高出血风险伴随特异性基因和染色体核型改变为特征[1,2]。传统的诱导化疗方案往往在治疗早期会并发难以纠正的凝血功能异常、高发生率的弥散性血管内凝血(DIC),由此所致的重要脏器难治性出血使APL患者在诱导化疗期间存在极高的早期死亡风险[3,4,5]。随着全反式维甲酸(ATRA)及砷剂的规范化应用,传统化疗在诱导和巩固治疗中的权重不断下降,在不影响疗效的前提下,更好地避免了化疗药物对患者的不良影响,APL患者的早期病死率逐步下降,治疗费用也得到了有效控制[6,7,8]。本研究分析3种不同诱导及巩固治疗方案治疗初治APL患者的临床效果及成本效益,为临床治疗选择提供参考依据。
回顾性分析我科2011年1月至2020年12月收治的初诊APL患者临床资料。APL的诊断标准参照中国APL诊疗指南(2018年版)[9],细胞遗传学检测t(15;17)易位或PML-RARα融合基因至少1项阳性。至随访结束,生存患者应完成诱导缓解治疗及巩固治疗。确诊APL后即放弃治疗及诱导化疗前因并发症死亡的患者未纳入本研究。最终纳入37例患者,其中,11例接受ATRA联合蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固(ATRA+化疗组);13例接受ATRA联合三氧化二砷(ATO)+蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固(ATRA+ATO+化疗组);13例接受ATRA联合ATO双诱导,缓解后以ATRA联合ATO巩固(ATRA+ATO双诱导组)。37例患者中3例为高危患者,2例发生早期死亡的患者危险度分层为中低危。本研究符合《赫尔辛基宣言》有关规定,所有患者均知情同意。
ATRA+化疗组:口服ATRA 25 mg·m-2·d-1至血液学完全缓解(CR),中低危患者于第2、4、6、8天给予去甲氧柔红霉素(IDA)8 mg·m-2·d-1或柔红霉素45 mg·m-2·d-1,高危患者在此基础上联合应用ATO 0.16 mg·m-2·d-1至血液学CR。ATRA+ATO+化疗组:中低危患者及高危患者均以ATRA 25 mg·m-2·d-1、ATO 0.16 mg·m-2·d-1应用至血液学CR;IDA 8 mg·m-2·d-1或柔红霉素45 mg·m-2·d-1,第2、4、6天。ATRA+ATO双诱导组:ATRA 25 mg·m-2·d-1联合应用ATO 0.16 mg·m-2·d-1或复方黄黛片60 mg·m-2·d-1至血液学CR,白细胞计数(WBC)>10×109/L的高危患者使用小剂量蒽环类药物化疗控制白细胞增高。
完成诱导治疗取得CR的患者,巩固治疗阶段均使用ATRA 25 mg·m-2·d-1口服14 d。高危组患者常用化疗方案包括:(1)HA方案:高三尖杉酯碱(HHT)4 mg·m-2·d-1×3 d,阿糖胞苷100 mg·m-2·d-1×7 d;(2)MA方案:米托蒽醌8 mg·m-2·d-1×3 d,阿糖胞苷100 mg·m-2·d-1×7 d;(3)DA方案:柔红霉素45 mg·m-2·d-1×3 d,阿糖胞苷100 mg·m-2·d-1×7 d。中低危组患者化疗方案常选择IDA方案:IDA 10 mg·m-2·d-1× 3 d。
根据患者一般情况、临床表现及血常规、凝血功能、外周血涂片等实验室检查,如诱导化疗期间血小板计数(Plt)<50×109/L、纤维蛋白原<100 mg/L,适量按需输注血小板、新鲜冰冻血浆、纤维蛋白原、aⅦ因子。
采用SPSS 16.0统计学软件处理数据,计数资料以频数(%)表示,比较采用Fisher确切概率法;计量资料符合正态分布,以 ±s表示,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
±s表示,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
37例APL患者中,ATRA+化疗组、ATRA+ATO+化疗组、ATRA+ATO双诱导组患者资料见表1。
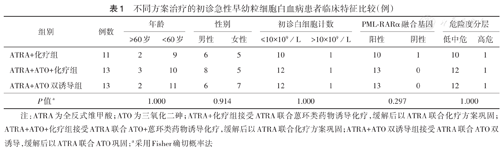
不同方案治疗的初诊急性早幼粒细胞白血病患者临床特征比较(例)
不同方案治疗的初诊急性早幼粒细胞白血病患者临床特征比较(例)
| 组别 | 例数 | 年龄 | 性别 | 初诊白细胞计数 | PML-RARα融合基因 | 危险度分层 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| ≥60岁 | <60岁 | 男性 | 女性 | ≤10×109/L | >10×109/L | 阳性 | 阴性 | 低中危 | 高危 | ||
| ATRA+化疗组 | 11 | 2 | 9 | 6 | 5 | 10 | 1 | 10 | 1 | 10 | 1 |
| ATRA+ATO+化疗组 | 13 | 3 | 10 | 8 | 5 | 12 | 1 | 13 | 0 | 12 | 1 |
| ATRA+ATO双诱导组 | 13 | 2 | 11 | 6 | 7 | 12 | 1 | 13 | 0 | 12 | 1 |
| P值a | 1.000 | 0.914 | 1.000 | 0.297 | 1.000 | ||||||
注:ATRA为全反式维甲酸;ATO为三氧化二砷;ATRA+化疗组接受ATRA联合蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固;ATRA+ATO+化疗组接受ATRA联合ATO+蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固;ATRA+ATO双诱导组接受ATRA联合ATO双诱导,缓解后以ATRA联合ATO巩固;a采用Fisher确切概率法
ATRA+化疗组11例患者诱导化疗过程中因颅内出血发生早期死亡1例,10例获得缓解后以ATRA联合化疗巩固;ATRA+ATO+化疗组13例患者诱导过程中因DIC发生早期死亡1例,10例缓解后以ATRA联合化疗巩固;ATRA+ATO双诱导组13例患者缓解后以ATRA+ATO巩固。3组获得CR患者分别为10、12、12例,差异无统计学意义(P=1.000)。
ATRA+化疗组、ATRA+ATO+化疗组和ATRA+ATO双诱导组间各不良反应发生差异均无统计学意义(均P>0.05)(表2)。
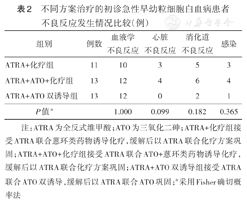
不同方案治疗的初诊急性早幼粒细胞白血病患者不良反应发生情况比较(例)
不同方案治疗的初诊急性早幼粒细胞白血病患者不良反应发生情况比较(例)
| 组别 | 例数 | 血液学不良反应 | 心脏不良反应 | 消化道不良反应 | 感染 |
|---|---|---|---|---|---|
| ATRA+化疗组 | 11 | 10 | 3 | 5 | 3 |
| ATRA+ATO+化疗组 | 13 | 12 | 4 | 6 | 4 |
| ATRA+ATO双诱导组 | 13 | 12 | 0 | 2 | 1 |
| P值a | 1.000 | 0.099 | 0.182 | 0.365 |
注:ATRA为全反式维甲酸;ATO为三氧化二砷;ATRA+化疗组接受ATRA联合蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固;ATRA+ATO+化疗组接受ATRA联合ATO+蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固;ATRA+ATO双诱导组接受ATRA联合ATO双诱导,缓解后以ATRA联合ATO巩固;a采用Fisher确切概率法
ATRA+化疗组及ATRA+ATO+化疗组诱导治疗及巩固治疗相关费用均高于ATRA+ATO双诱导组(均P<0.001),住院时间较ATRA+ATO双诱导组长(P<0.001)(表3)。
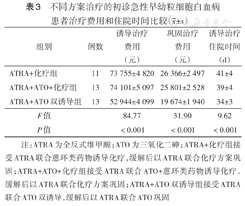
不同方案治疗的初诊急性早幼粒细胞白血病患者治疗费用和住院时间比较( ±s)
±s)
不同方案治疗的初诊急性早幼粒细胞白血病患者治疗费用和住院时间比较( ±s)
±s)
| 组别 | 例数 | 诱导治疗费用(元) | 巩固治疗费用(元) | 诱导治疗住院时间(d) |
|---|---|---|---|---|
| ATRA+化疗组 | 11 | 73 755±4 820 | 26 366±2 497 | 41±4 |
| ATRA+ATO+化疗组 | 13 | 74 101±5 097 | 25 801±2 528 | 39±4 |
| ATRA+ATO双诱导组 | 13 | 52 944±4 099 | 19 674±1 940 | 34±3 |
| F值 | 84.77 | 31.90 | 9.62 | |
| P值 | <0.001 | <0.001 | <0.001 |
注:ATRA为全反式维甲酸;ATO为三氧化二砷;ATRA+化疗组接受ATRA联合蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固;ATRA+ATO+化疗组接受ATRA联合ATO+蒽环类药物诱导化疗,缓解后以ATRA联合化疗方案巩固;ATRA+ATO双诱导组接受ATRA联合ATO双诱导,缓解后以ATRA联合ATO巩固
APL起病急骤、凝血功能严重紊乱,出血倾向明显。传统化疗早期,因早幼粒细胞大量破坏,释放出细胞内促凝颗粒并消耗大量血小板,继发DIC及重要脏器出血是高死亡率的主要原因[10]。随着研究的深入,明确了t(15;17)染色体易位产生异常PML-RARα融合基因是APL发病的主要机制,而ATRA及ATO可靶向于APL患者的PML-RARα融合基因,诱导早幼粒细胞分化并促使其凋亡,从而起到治疗的作用[11]。
ATRA联合蒽环类药物的应用虽然使APL患者的早期病死率较传统化疗显著降低,但由于蒽环类药物的不良反应,尤其是对心脏功能的影响较大,以化疗为主导的治疗模式仍具有较高的早期死亡风险和化疗相关不良事件发生率,治疗成本亦较高。ATRA联合砷剂双诱导治疗在不影响疗效的前提下,更好地避免了化疗药物对患者的影响,APL患者的早期病死率进一步下降,治疗费用也得到了有效的控制,从而使APL成为预后最好、治疗依从性和耐受性以及治疗成本效益高的急性髓系白血病[12,13]。
两项针对新诊断中低危和高危APL患者的临床试验比较了ATRA+ATO和ATRA+IDA诱导方案的疗效,结果表明,与ATRA+IDA相比,ATRA+ATO提高了不同危险度分层APL患者的总生存,而无事件生存ATRA+ATO组亦明显好于ATRA+IDA组[12]。
本研究比较了3种不同治疗方案对初治APL的临床疗效。结果显示,3组CR率差异无统计学意义,与Shen等[14]的研究结果一致;3组血液学、心脏、消化道不良反应和感染的发生率差异均无统计学意义。
计算化疗方案成本包含的项目一般分为直接费用(化疗费用、护理费用、床位费用、医用材料费用、检查费用、血制品费用、治疗相关并发症及不良反应治疗费用)和间接费用(疾病导致的患者及家属时间和精力消耗的成本)。为方便观察和比较,且疾病导致的患者及家属时间和精力消耗的成本难以具体量化,故此类间接费用及因经外周静脉置入中心静脉导管(PICC)护理、住院时长增加而产生的交通费、误工费等未纳入计算。本次研究仅统计每种治疗模式下诱导及巩固治疗的直接成本。结果表明以ATRA联合ATO双诱导治疗,缓解后以ATRA+ATO巩固的治疗模式费用最低,住院时间最短,成本效益最高。
APL的诱导治疗方案经历了传统化疗、ATRA联合化疗、ATRA+ATO联合化疗、ARTA+ATO双诱导治疗等一系列改进和完善。采用ATRA联合ATO诱导及巩固的无化疗治疗模式取得了比以联合化疗为主导的诱导和巩固治疗更好的临床疗效,成本效益更高。该治疗模式适用于不同危险分层的初治APL患者,并显示出了较好的安全性,改善了患者的生命质量,并降低了整体医疗费用。
所有作者均声明不存在利益冲突



























