
探讨新型硬组织切片技术在临床骨与骨髓病理诊断中的潜在应用价值。
收集2021年3至12月上海市第六人民医院19例骨病病例(骨软骨瘤1例、软骨肉瘤2例、骨肉瘤4例、纤维结构不良2例、甲状腺乳头状癌骨转移2例、骨髓炎病例2例、骨巨细胞瘤4例、尤文肉瘤2例),其中男14例,女5例,年龄M(范围)为31(10~66)岁;16例血液病病例,其中男7例,女9例,年龄M(范围)为28(16~65)岁。对35例临床病例标本分别采用新型硬组织切片技术与石蜡包埋切片技术制片,通过苏木精-伊红(HE)染色、免疫组织化学染色、荧光原位杂交及Sanger测序等方法比较两种制片方法对于临床骨与骨髓疾病病理诊断的优缺点。
新型硬组织切片在HE染色中展现出更好的组织细胞形态;在免疫组织化学染色检测Ki67、SATB2、CD34、SMA、CD68、MPO、CD4、CD33等指标时,新型硬组织切片技术相对于石蜡切片技术表达更好,定位更准确;针对MDM2荧光原位杂交结果显示,新型硬组织切片技术荧光强度更高;Sanger测序结果显示,两种切片技术的DNA纯度均满足条件,且均检测到突变。
新型硬组织切片技术简单易行、耗时短,适用于优化临床骨与骨髓病理诊断流程。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
硬组织切片技术是与石蜡切片及冰冻切片技术并行的三大切片技术之一。硬组织切片采用树脂包埋切片,所用包埋剂主要包括环氧树脂包埋剂和丙烯酸甲酯类包埋剂[1],环氧树脂类包埋剂多用于电镜观察[2],但是对于抗原的保留效果较差[3]。由于包埋过程不需要脱钙,细胞细微结构形态较石蜡组织更加清晰[4, 5],研究者一般采用树脂包埋切片来观察细微的组织结构[6, 7],例如高分辨率的脑膜显微镜可以通过对树脂包埋样品的表层进行成像和切片来还原3D组织结构[8]。但是长久以来,硬组织切片技术因为其操作复杂,需要较长的时间,同时不能实现稳定的免疫组化,而导致其应用受到限制。临床应用较多的是石蜡切片技术及冰冻切片技术[9, 10, 11, 12],但骨组织内含有大量的钙质,质地坚硬,直接石蜡包埋无法切片。因此,临床上处理骨等硬性标本的常规办法是脱钙后石蜡包埋切片[13, 14, 15]。常用的脱钙剂包括强酸性脱钙液、乙二胺四乙酸(EDTA)脱钙液。酸性脱钙液常常会导致脱钙后抗原丢失[16]。EDTA脱钙液脱钙效果好,能保留大部分抗原,但是脱钙时间较长,5 mm厚度的骨组织脱钙时间在1~2周,环境温度低时则需要更长的时间,且临床上判断脱钙完成需要针刺确认,并没有一定标准。同时,无论是哪种脱钙液,均会导致组织标本的细胞形态皱缩,脱钙时间越长,对组织细胞的形态影响越大。相对而言,树脂包埋切片在形态保留上具有非常大的优势[17, 18],特别是对于临床骨髓活检的组织标本,组织切片能与涂片一样进行细胞分类与计数,并可免除血液稀释的影响。有研究采用硬组织切片技术将骨髓活检标本切到2 μm厚度,可获得更好的细胞形态,但无法稳定实现免疫组织化学及进一步的分子病理诊断[19, 20]。本研究旨在明确改良的新型硬组织切片技术处理的骨硬性标本切片是否适用于苏木精-伊红(HE)染色、免疫组织化学染色、荧光原位杂交及Sanger测序等常规病理检测方法,初步探讨其潜在的临床应用价值。
收集2021年3至12月上海市第六人民医院19例骨病病例(骨软骨瘤1例、软骨肉瘤2例、骨肉瘤4例、纤维结构不良2例、甲状腺乳头状癌骨转移2例、骨髓炎病例2例、骨巨细胞瘤4例、尤文肉瘤2例),其中男14例,女5例,年龄[M(范围)]为31(10~66)岁;16例血液病病例,其中男7例,女9例,年龄[M(范围)]为28(16~65)岁。
手术取下的硬组织标本迅速丢到4%甲醛溶液中,固定24 h。固定后将标本分成两部分,流水冲洗10 min,然后分别进行脱钙和不脱钙处理。
1. 脱钙:标本切成0.5 cm×2.0 cm×2.0 cm的组织块,置于脱钙液(EDTA+氢氧化钠)中,脱钙2周,当大头针刺标本易穿透,停止脱钙,流水冲洗10 min后进行脱水。
2. 脱水及透明:将标本放入组织脱水机中进行梯度酒精脱水处理。脱水后标本浸入二甲苯Ⅰ(2 h)和二甲苯Ⅱ(2 h),后浸入石蜡浸泡液Ⅰ、Ⅱ各3 h。
3. 包埋及切片:组织标本从脱水机取出后置于包埋框中,滴加石蜡溶液进行包埋,包埋结束后将标本块置于室温冷却后切片,将标本切片至2~4 μm厚度,65 ℃烘干备用。
4. HE染色:石蜡切片置于二甲苯中脱蜡处理,经梯度酒精脱水后,HE染色,并封片观察。
5. 免疫组织化学:分别将载玻片浸入二甲苯Ⅰ和二甲苯Ⅱ各10 min进行脱蜡,后梯度酒精处理。在自动免疫组化仪中完成免疫组织化学实验。
6. 荧光原位杂交:脱蜡处理后,依次梯度酒精处理,此后操作方法参照试剂盒(试剂盒由广州安必平医药科技股份有限公司提供)说明书进行。
7. GNAS基因突变检测:通过PCR仪扩增GNAS外显子基因片段,相关引物由北京信诺美迪基因检测技术有限公司提供,酶解程序如下:37 ℃、60 min,80 ℃、15 min。获得的PCR产物交由北京鑫诺美迪基因检测技术有限公司进行测序分析。
1. 脱水及透明:标本固定并流水冲洗后,无需脱钙,直接放入组织脱水机中进行梯度酒精脱水处理,脱水后标本浸入二甲苯Ⅰ(2 h)和二甲苯Ⅱ(2 h),然后浸入包埋A液(甲基丙烯酸甲酯+邻苯二甲酸二丁酯)及B液(A液+过氧化苯甲酰)做进一步处理。
2. 包埋、聚合及切片:组织标本从脱水机取出后依次浸入配好的硬组织包埋液A及包埋液B,4 ℃静置3 h,将标本置入装有B溶液的玻璃包埋瓶,置于45 ℃水浴锅中过夜聚合。聚合完成后,将包埋瓶中的标本取出,在切片机上装载硬组织切片刀[专利号:CN214055373U(中国)],将标本切至2~4 μm厚度,用载玻片捞片后,置入硬组织切片压片装置中,65 ℃烘干备用。
3. HE染色:树脂包埋切片置于防脱处理装置[专利号:CN113092219A(中国)]中,加入乙二醇乙醚乙酸酯Ⅰ和Ⅱ,依次脱塑、梯度酒精处理后,透明化30 min,HE染色,封片,镜下观察。
4. 免疫组织化学:硬组织切片参照之前步骤脱塑,乙醇丙酮2 min,无水乙醇Ⅰ 2 min,滴加防脱试剂,将切片从防脱处理装置中取出,放入普通染缸中,梯度酒精处理。在自动免疫组化分析仪中完成免疫组织化学实验。
5. 荧光原位杂交:脱塑过程同上。防脱处理完成后,依次梯度酒精处理。之后的操作过程与石蜡切片处理方法一致。
6. GNAS基因突变检测:脱塑处理后操作步骤同石蜡切片。
骨软骨瘤HE染色显示,石蜡切片在骨与软骨连接处较容易发生碎裂,而硬组织切片中完整性更好。另外,硬组织切片可见骨小梁边缘呈串珠样爬附的成骨细胞,而对应的石蜡切片中大部分成骨细胞脱落丢失。对于纤维结构不良的病例,由于松质骨和周围软组织的膨胀系数不同,在脱钙处理后,绝大多数松质骨周围都出现了明显的裂痕,且松质骨粘合线显示不佳。而改良的硬组织切片骨粘合线显示清晰,未矿化部分显示粉红色,中心成熟骨质显示淡紫色,骨质中央的骨细胞核呈现出深蓝色,且松质骨与周围纤维组织衔接良好。本研究结果显示,石蜡切片的着色基底往往呈现蓝色,在胞质或者胞外基质均残留有苏木素染料。在去分化软骨肉瘤中,石蜡切片底色偏蓝色,软骨肉瘤区域有明显的苏木素残留,但是硬组织切片肉瘤的基质呈现均匀的粉红色,软骨细胞核着蓝色,更符合HE染色的标准。骨髓炎的骨组织HE染色可见硬组织切片中骨细胞核更加清晰,骨细胞核或固缩变形,或肿胀崩解,核仁显示清晰,这些表现可一定程度上反映该部分骨代谢的活跃程度。在石蜡切片中,骨细胞核固缩变形,核深染,无法准确判断骨细胞的状态(图1)。


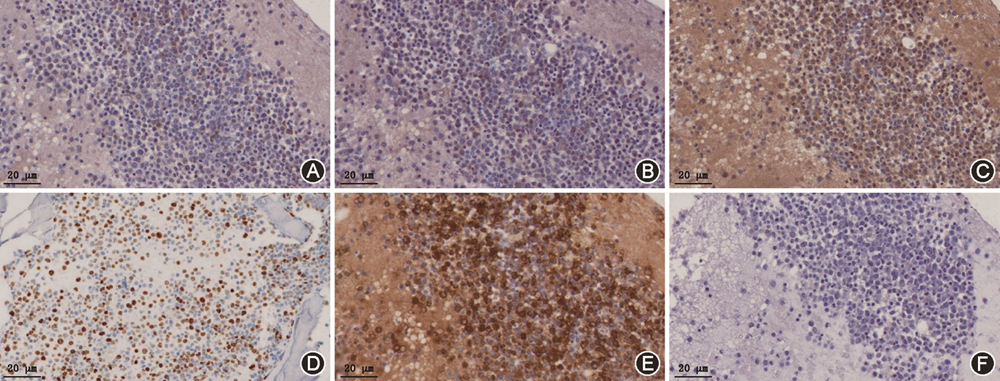
对同一病例石蜡切片及硬组织切片同时进行免疫组织化学染色,Ki67、SATB2、CD34、SMA、CD68在两种切片中均呈阳性表达。硬组织切片中细胞的原始形态保持良好,组织层次更加清晰,Ki67 及SATB2抗原核内定位更加准确。Ki67是一种增殖细胞的相关抗原,其与染色质的有丝分裂密切相关,可侧面反映肿瘤细胞的恶性程度。在骨巨细胞瘤中,阴性区域与阳性着色细胞核分界清晰,细胞核内染色质有丝分裂的不同时期Ki67表达的状态略有不同,这使对处于有丝分裂的不同时期的细胞进行定量成为可能。相对而言,石蜡切片Ki67阳性细胞核整个核着色,在非阳性区域也存在干扰性着色,需要经验丰富的病理医师通过肉眼排除假阳性着色并定量Ki67,造成主观判读结果差异较大。SATB2可以与DNA核基质结合区特异性结合,在染色质转录和重塑、成骨细胞发育中发挥重要作用,对于鉴别成骨性和非成骨性肿瘤有重要意义。在硬组织切片中,SATB2定位更加准确。甲状腺乳头状癌骨转移病例中,CD34血管(+),硬组织切片的阳性定位更佳。SMA在已有的文献报道中,多存在于脑、肺、肾、骨骼肌中,尚未有文献显示其在骨细胞呈阳性表达,本研究硬组织切片中部分区域骨细胞SMA强阳性,对慢性骨髓炎中骨质病理状态有一定的提示作用。慢性骨髓炎两种方法均检测到SMA(+),其中硬组织切片在骨小梁内成骨细胞及骨细胞SMA(+),而同一病例的石蜡切片免疫组织化学染色未见到同样的阳性表达,这提示硬组织切片保留了更多的抗原活性。CD68与溶酶体颗粒有关,多用于标记巨噬细胞、外周血单核细胞、骨髓前体细胞及外周血粒细胞。恶性骨巨细胞瘤CD68抗原检测,石蜡切片仅在肿瘤软组织中呈阳性,含骨质较多的切片中未获得满意的染色,但是硬组织切片中CD68(+)的破骨细胞标记良好,体现了硬组织切片在处理骨等硬性标本中的优势(图2)。急性粒-单核细胞白血病进行骨髓穿刺后,通过改良的硬组织切片技术获得了较好的硬组织切片标本,以PBS作为阴性对照,检测出该标本CD34(+)、CD4(+)、MPO(+)、CD33(+)、Ki67(+)(图3)。



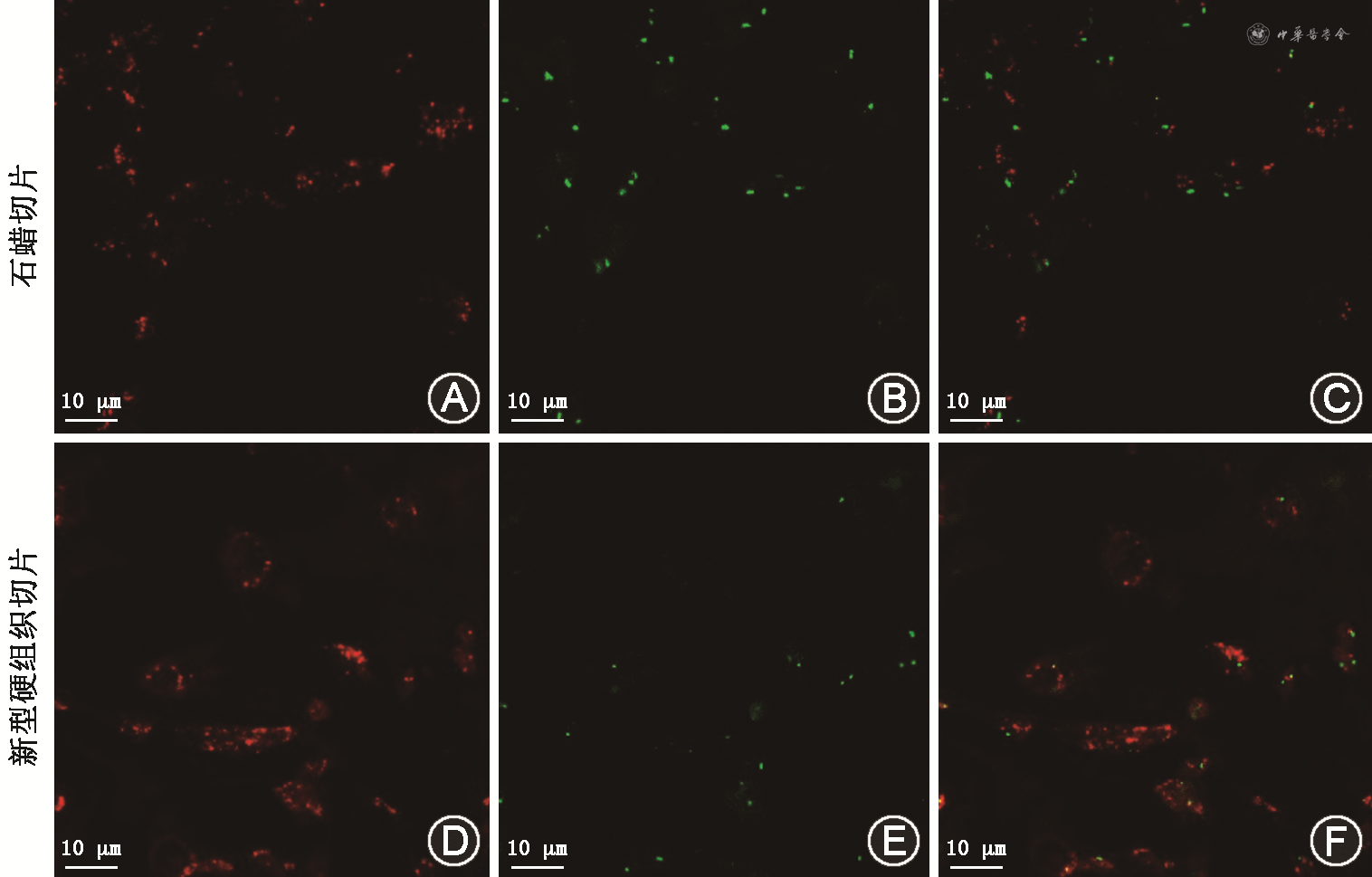
去分化骨旁骨肉瘤病例的石蜡切片及硬组织切片荧光原位杂交检测MDM2基因结果显示,两种方法均检测到了MDM2的阳性表达。MDM2与肿瘤转移密切相关,其异常表达可能是疗效和预后的预测指标。在对两种方法获得的切片进行共聚焦摄片时,发现石蜡切片需要更高强度的激发光才会显影,证明硬组织切片中MDM2保留更好(图4)。Sanger测序结果显示,硬组织切片标本和石蜡切片标本样品DNA的吸光度(A260/A280)均为2.0,且均检测到了突变位点,提示硬组织切片与EDTA脱钙的石蜡切片相比,完全保留了DNA序列的完整性。

硬组织切片与石蜡切片相比,对细胞的结构损伤小,成像分辨率高,在血液疾病、骨肿瘤、骨转移癌、口腔疾病等含有骨质的硬性组织以及昆虫、植物等标本上有独特的优势[21, 22, 23]。对生物组织进行树脂包埋已被广泛用于电子显微镜和光学显微镜[5,24],以获得更详细的微观结构信息。Bell等[25]利用树脂包埋获得了可以较好保留抗原的植物切片标本,但是该研究使用的Ultracut UCT超薄切片机切片流程复杂,效率低下,同时用于该硬组织切片机配套的硬组织切片刀价格昂贵,使用寿命短,因此只适用于基础科学研究,难以在临床病理诊断中推广。
长久以来,莱卡硬组织切片机及专用的钨钢刀是主流的硬组织切片设备,在国内外应用都非常广泛。本研究对比了莱卡切片刀和国产硬组织切片刀,发现国产硬组织切片刀弹性模量更佳,更适合树脂包埋的标本。在展片仪内,国产硬组织切片刀所切5 μm薄片及20 μm厚片均更易展开,所切标本完整性更好。同时国产切片刀成本仅仅是莱卡切片刀的5%~10%,其低廉的成本非常适合在临床推广。另外,本研究将整套硬组织切片技术进行了改良,使其流程标准化,优势如下:(1)制片时间更短(2~3 d即可获得优良的切片),缩短了诊断等候期;(2)新型硬组织切片刀适用于市面上大部分石蜡切片机,比莱卡切片刀更加耐磨,韧性好,不易崩口,使用寿命长,大幅降低了临床使用成本;(3)降低了脱片率,提高了成片率。传统硬组织切片因为脱片率高(85%左右),制片流程复杂,难以在临床推广,改良的新型硬组织切片通过特定仪器加以防脱辅助,标本脱片率低于15%,使该技术在临床推广成为可能;(4)改良的新型硬组织制片方法在免疫组织化学、荧光原位杂交及DNA测序等进一步的分子诊断中均表现良好,且显示出胞内更好的定位,这为进一步精准诊断提供了可能;(5)石蜡包埋组织切片上进行的各种特殊染色均可适用于硬组织切片包埋组织块,且染色方法基本相同,这使得推广更容易。
综上所述,改良新型硬组织切片方法可以在临床骨病、血液病等涉及骨及骨髓等硬性标本的临床诊断中有巨大的应用潜力,为更快速、精准的临床病理诊断及预后评估提供帮助[26, 27]。本研究将继续扩大临床样本量来测试该改良方法的稳定性,同时通过不断的重复实验验证更多的免疫组织化学及分子学指标,为进一步的临床推广提供条件。
所有作者均声明不存在利益冲突



























