
颅内动脉瘤是神经外科常见疾病,术中血管损伤引起术后缺血性并发症,严重影响患者预后。术中神经电生理监测(IONM)能有效识别早期术中缺血,减少相关并发症。中国研究型医院学会临床神经电生理专业委员会和中国医师协会神经外科医师分会神经电生理学组组织了全国神经电生理及脑血管病方面的专家,在回顾国内外已发布的指南共识和临床证据基础上,经过德尔菲专家咨询,制定了本专家共识。形成了常用的IONM技术及参数设置、围手术期准备与结果解读、不同部位动脉瘤术中电生理监测价值和特殊情况下电生理监测四个方面的共识。并根据GRADE证据等级标准,从上述四个方面给出了9条推荐意见,为临床颅内动脉瘤术中神经电生理监测实践提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
颅内动脉瘤的手术主要包括开颅夹闭术和介入栓塞术,两种术式都有发生缺血性并发症的风险。研究表明,动脉瘤术后脑缺血的发生率为10%~12%[1],主要原因包括:载瘤动脉狭窄或闭塞、临时阻断、牵拉损伤、术中动脉瘤破裂、穿支动脉机械损伤、血管痉挛、血栓形成、全身血压下降等。发生脑缺血并发症往往严重影响患者的神经功能。近年来,术中神经电生理监测(intraoperative neurophysiologic monitoring,IONM)在动脉瘤手术中发挥着越来越重要的作用。IONM通过监测神经传导的完整性,实时地评估术中神经功能,从而提醒术者及时做出调整措施,减少动脉瘤术中脑缺血损伤和神经功能损害的发生[2, 3]。动物实验和临床研究均已证实了脑血流量降低与体感诱发电位(somatosensory evoked potential,SEP)波幅下降和潜伏期延长相关。
1977年,IONM在国际上首先应用于脊柱手术,其后在各类神经外科手术中得到推广。1983年,SEP监测开始在大脑中动脉瘤夹闭术中应用[4]。20世纪末,我国开始在神经外科手术中进行术中神经电生理监测[1],并于2018年发布了《中国神经外科术中电生理监测规范(2017版)》[5]。但是,该规范对于动脉瘤术中电生理监测未进行详细叙述。为了推动动脉瘤手术中神经电生理监测的规范化,中国研究型医院学会临床神经电生理专业委员会和中国医师协会神经外科医师分会神经生理监测学组组织了全国神经电生理及脑血管病方面的专家,在广泛征求意见的前提下,制定了本专家共识。
本共识的撰写工作起自2022年5月,针对颅内动脉瘤术中神经电生理监测相关文献进行了充分的检索。检索数据库包括The Cochrane Library、MEDLINE、Embase、中国知网、维普、万方和中国生物医学文献数据库。文献检索时间跨度为2012年1月至2021年12月。文献检索类型优先选择系统评价、荟萃分析与指南。若需制作系统评价、荟萃分析则进行相应原始研究的检索。为保证研究证据质量,研究过程中的文献筛选、质量评价、文献资料提取等工作由2位工作人员分别独立完成后核对、汇总。撰写小组在武汉大学循证与转化医学中心专家的指导下,采用GRADE方法对证据进行评价与分级(表1)。

证据质量与推荐强度分级
证据质量与推荐强度分级
| 分级 | 具体描述 |
|---|---|
| 证据质量等级 | |
| 高(A) | 非常有把握:观察值接近真实值 |
| 中(B) | 对观察值有中等把握:观察值有可能接近真实值,但也有可能差别很大 |
| 低(C) | 对观察值的把握有限:观察值可能与真实值有很大差别 |
| 极低(D) | 对观察值几乎没有把握:观察值与真实值可能有极大差别 |
| 推荐强度分级 | |
| 强(1) | 明确显示干预措施利大于弊或弊大于利 |
| 弱(2) | 利弊不确定或无论质量高低的证据均显示利弊相当 |
专家小组基于证据评价与分级小组提供的有关颅内动脉瘤术中神经电生理监测的国内外证据,从常用的IONM技术及参数设置、围手术期准备与结果解读、不同部位动脉瘤术中电生理监测价值和特殊情况下电生理监测四个方面形成了9条专家推荐意见草案。后通过两轮德尔菲调研和两次邮件专家讨论,最终确定了9条推荐意见。共识文本用“推荐”来反映强推荐,用“建议”或“考虑”来反映弱推荐。强推荐并不意味着有足够的干预有效性,推荐意见的制订结合疾病的严重程度、患者意愿、安全性、经济性等因素综合考虑。
EEG是大脑皮质表面锥体细胞层产生的兴奋性和抑制性突触后电位的总和,EEG可发现脑血管手术中较大面积脑皮质的灌注不足,但对功能区穿支血管缺血造成的脑功能障碍不敏感。对于颅内动脉瘤介入治疗,可采用国际10-20标准安置头皮电极进行神经电生理监测[6, 7]。而在开颅动脉瘤夹闭手术中,可选择多脑叶皮质脑电图(multilobar electrocorticography,mEcoG)对多部位进行局部脑电监测[8]。EEG对颅内动脉瘤手术引起的脑缺血预测作用特异度可达99%,但敏感度仅58%[9]。此外,脑电双频指数(bispectral index,BIS)也可用于监测麻醉深度,与其他监测模式联合进行术中神经电生理监测。
推荐意见1:鉴于EEG具有高特异性、低敏感度的特点,建议将其作为颅内动脉瘤IONM的基础监测,与其他监测技术联合进行术中神经电生理监测。(中等证据,弱推荐)
SEP是通过重复刺激含有感觉纤维的周围神经,在中枢神经相应传导通路上记录其电反应,进而反映躯体感觉传导通路的完整性的一种电生理监测技术[10]。周围神经的刺激位置,上肢常采用腕部的正中神经,下肢常采用内踝部的胫后神经。刺激正中神经时,负极放置在腕横纹近端2~4 cm处,正极放置在远端2~3 cm处。刺激胫后神经时,负极放置在内踝和跟腱之间的近脚踝处,正极放置在胫后神经走行的内踝远端2~3 cm处。SEP的头皮记录电极放置部位是基于10-20国际脑电图电极放置系统进行定位,上肢的头皮电极记录点为C3′(C3后2 cm)、C4′(C4后2 cm);下肢的头皮电极记录点为Cz。头皮电极选用Fz点为参考电极。前循环动脉瘤夹闭手术多采用翼点入路,放置头皮记录电极前先与手术医师沟通,确定头皮切口的划线,尽量避开切口1 cm。
技术参数:(1)刺激参数:①刺激强度:刺激一般采用方形脉冲电流,上肢<25 mA,下肢<40 mA;②刺激频率:一般为2.1~5.7 Hz,为了减少波形叠加带来的干扰,刺激频率不应该设定为50 Hz的倍数;③刺激间歇时间:0.1~0.3 ms。(2)记录参数:①带通滤波范围:30~3 000 Hz;②信号分析时间:上肢为50 ms,下肢为100 ms;③重复信号平均次数:平均次数100~500次。
推荐意见2:推荐使用SEP监测评估动脉瘤术中皮质和皮质下感觉传导束缺血情况。正中神经SEP监测大脑中动脉(MCA)和大脑后动脉(PCA)供血的感觉通路神经功能;胫后神经的SEP监测大脑前动脉(ACA)供血的感觉通路神经功能。(中等证据,强推荐)
颅内动脉瘤手术中MEP可采用经颅电刺激,沿着皮质脊髓束向下传到运动神经元和对应的靶肌肉,在四肢肌肉记录到激活脊髓前角α运动神经元的复合肌肉动作电位(compound muscle action potential,cMAP)即为肌源性运动诱发电位(muscular motor evoked potentials,mMEPs),通过这一动作电位来反映运动通路的完整情况[11]。MEP的刺激部位:刺激电极放置于大脑皮质中央前回上肢(C3、C4)和下肢(Cz前方2 cm处)的头皮定位,阳极为刺激电极,放在记录部位的对侧,放置刺激电极前先与手术医师沟通,确定头皮切口的划线,尽量避开切口1 cm。记录部位:上肢肌肉为拇短展肌,下肢肌肉为胫前肌和踇展肌。
技术参数:(1)刺激参数:①刺激模式:双相方波电脉冲,串刺激5(3~9)个/次,强度100~500 V;②刺激持续时间:通常0.2(0.1~0.5)ms;③刺激间歇时间:2~4 ms。(2)记录参数:①带通滤波范围:30~1 500 Hz;②信号分析时间:100 ms。
推荐意见3:MEP监测运动功能损伤,特别是对皮质下缺血导致的运动功能损伤更可靠,如时间较长的临时阻断、无法预见的血管闭塞、血管痉挛、穿支血管损伤等,MEP均较SEP更具优势。因此,推荐动脉瘤手术中MEP与SEP联合监测以提高术中监测的敏感度和特异度。(中等证据,强推荐)
BAEP是通过对耳的短声刺激后在乳突或乳突下记录到的电反应[12]。正常人BAEP可记录到7个波,其中Ⅰ、Ⅲ、Ⅴ波与术中监测最相关,出现率达100%,BAEP能评价整个听觉传导通路的完整性,监测听神经和脑干功能,也被用于椎-基底动脉系统的动脉瘤术中监测。通常采用耳塞声波刺激,在头顶(Cz)及左右两侧的乳突(M1、M2)或耳垂(A1、A2)处放置电极进行记录,地极置于额部(Fz)。在所有的IONM模式中,BAEP对麻醉药物最不敏感,缺点是BAEP覆盖的范围有限。
推荐意见4:BAEP监测主要用于椎-基底动脉动脉瘤手术中。SEP与MEP同样能在一定程度上反映脑干感觉运动传导通路的完整性。因此,建议后循环动脉瘤术中采用BAEP联合SEP和MEP监测。(中等证据,弱推荐)
VEP是指利用图像或闪光刺激视网膜,在颅顶或皮质记录到反映视觉通路传导完整性的电信号,是神经内外科及眼科在疾病诊疗过程中常用的检查技术[13, 14]。其中,闪光刺激模式可以在眼睑闭合的状态下进行检查,为术中VEP监测的常用模式。VEP记录为N75(N1)、P100、N145(N2),分别对应刺激发出后75、100及145 ms处记录的波形,其出现的时间称为其对应的潜伏期[15]。通常用N75和P100之间的峰间值或是P100和N145之间的峰间值来表示VEP的波幅。潜伏期和波幅的改变可以反映出视觉功能异常,通常以N75(N1)或P100的潜伏期及波幅作为结果解读的重点[13]。
推荐意见5:目前VEP监测技术已越来越成熟,考虑可在颈内动脉眼动脉段和前交通动脉瘤手术中采用VEP监测,因为这两个部位的动脉瘤手术对视神经或眼动脉的影响较大。(低等证据,弱推荐)
所有神经电生理监测均在一定程度上受患者体温、血压、麻醉药、肌松药(对MEP尤为影响)及手术室环境的影响[1]。术中应保持患者生命体征稳定,维持脑部正常灌注,并常规监测体温,避免体温过低。除了BAEP外[16],其他类电生理监测模式受吸入性麻醉药物影响较大,在麻醉诱导插管前使用短效肌松药物,术中不追加或在肌松监测下使用该类药物。维持麻醉通常采取全凭静脉麻醉方案(total intravenous anaesthesia,TIVA):持续泵注维持剂量为丙泊酚4~6 mg·kg-1·h-1+瑞芬太尼0.1~0.3 μg·kg-1·min-1,或靶控输注(target controlled infusion,TCI)方案丙泊酚(血浆浓度3~4 μg/ml)+瑞芬太尼(效应室浓度4 ng/ml)。所有动脉瘤手术的麻醉方案均按相同标准进行,在具体动脉瘤监测方案中将不再一一赘述。
术中神经电生理监测没有绝对禁忌证,Hunt-Hess分级0~5级患者均可以接受电生理监测[17]。电生理监测相对禁忌证包括合并癫痫、颅骨缺损、术前使用抗惊厥药物、颅内电极以及心脏起搏器等其他生物医学装置植入病史等[18]。目前推荐,在与患者充分沟通并进行充分的术前准备后,即使相对禁忌证的患者也可以采用术中电生理监测。另外,急诊患者在经过迅速准备之后采用术中神经电生理监测并不耽误患者手术进程。本共识还建议根据手术动脉瘤的不同位置,制定个性化的监测方案(表2)。
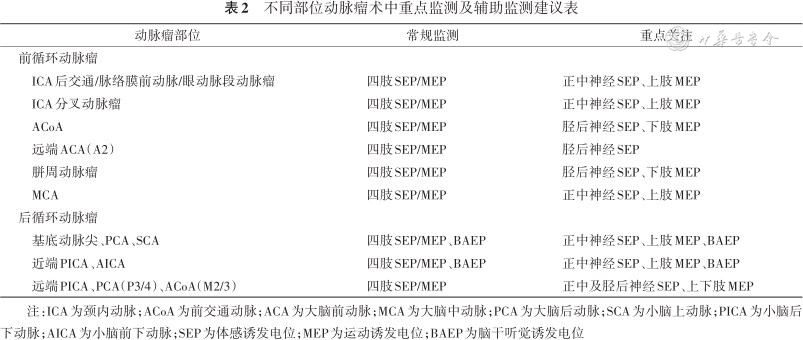
不同部位动脉瘤术中重点监测及辅助监测建议表
不同部位动脉瘤术中重点监测及辅助监测建议表
| 动脉瘤部位 | 常规监测 | 重点关注 |
|---|---|---|
| 前循环动脉瘤 | ||
| ICA后交通/脉络膜前动脉/眼动脉段动脉瘤 | 四肢SEP/MEP | 正中神经SEP、上肢MEP |
| ICA分叉动脉瘤 | 四肢SEP/MEP | 正中神经SEP、上肢MEP |
| ACoA | 四肢SEP/MEP | 胫后神经SEP、下肢MEP |
| 远端ACA(A2) | 四肢SEP/MEP | 胫后神经SEP |
| 胼周动脉瘤 | 四肢SEP/MEP | 胫后神经SEP、下肢MEP |
| MCA | 四肢SEP/MEP | 正中神经SEP、上肢MEP |
| 后循环动脉瘤 | ||
| 基底动脉尖、PCA、SCA | 四肢SEP/MEP、BAEP | 正中神经SEP、上肢MEP、BAEP |
| 近端PICA、AICA | 四肢SEP/MEP、BAEP | 正中神经SEP、上肢MEP、BAEP |
| 远端PICA、PCA(P3/4)、ACoA(M2/3) | 四肢SEP/MEP | 正中及胫后神经SEP、上下肢MEP |
注:ICA为颈内动脉;ACoA为前交通动脉;ACA为大脑前动脉;MCA为大脑中动脉;PCA为大脑后动脉;SCA为小脑上动脉;PICA为小脑后下动脉;AICA为小脑前下动脉;SEP为体感诱发电位;MEP为运动诱发电位;BAEP为脑干听觉诱发电位
对不同部位动脉瘤和不同的手术方式,建议采用统一的预警标准。MEP预警标准:潜伏期延长10%以上或者MEP波幅减少50%以上[19];SEP报警标准:潜伏期延长10%以上或者SEP基线振幅减少50%以上[20]。BAEP的预警临界值,最常用的为Ⅲ或Ⅴ波的波幅降低50%以上和(或)Ⅴ波潜伏期延长>1 ms[12]。以上标准是按照传统的将波幅与基线值相比降低超过50%或潜伏期延长10%以上的理念来设定的。把数值下降至50%作为预警指标,是因为有足够临床证据表明,应用这一指标的患者,通过及时调整,其预后得到了最有效的改善[21]。
除了波幅下降幅度之外,MEP及SEP发生显著变化的持续时间可以间接反映载瘤动脉供血皮质区域对于缺血的耐受能力,且其预警标准需要根据动脉瘤特征的变化而调整。比如大脑中动脉动脉瘤患者术中MEP显著下降的时间如超过8.5 min,患者术后出现运动功能障碍的概率会大幅提升[11];对于颈内动脉动脉瘤的患者,由于颈内动脉侧支循环丰富,这一时间可以延长至14 min[3];而在破裂动脉瘤的手术中,这一时间标准的把握应相对严格[22]。
当电生理监测指标出现预警信号,电生理监测医师应及时提醒手术医师采取相应措施,避免因缺血导致不可逆性神经功能损害。应及时检查穿支血管有无被误夹,是否存在动脉瘤夹导致的颈内动脉狭窄,或脑压板的使用不当导致的穿支动脉的受压和闭塞[23]。处理措施包括调整动脉瘤夹、撤除临时阻断夹、调整脑压板、升高动脉压、罂粟碱湿敷痉挛血管、温盐水冲洗等。在夹闭完成后,应密切观察神经电生理指标的变化,推荐夹闭完成后监测维持半小时以上的稳定状态,才能排除血管缺血导致的神经功能损害。
IONM除了为动脉瘤术中神经功能提供实时监测,还对动脉瘤术后脑缺血发生有预测价值。IONM对术后脑缺血预测的特异度很高,往往达到100%,表明IONM能准确预测部分动脉瘤术后脑缺血,但敏感度相对低一些。其原因可能是有些患者术后迟发性脑血管痉挛导致发生脑缺血,增加了假阴性患者数量,降低了敏感度[24]。
MEP和SEP各自的敏感度和特异度也存在较大差别。当出现相应血供区域皮质及大部分皮质下区域缺血时,SEP与MEP均能提示传导的异常;但供应部分皮质下深部传导束的穿支动脉缺血可仅引起MEP异常。所以,动脉瘤手术中MEP与SEP联合监测的意义不仅可提高术中监测的敏感度和特异度,还在于出现MEP或SEP单一异常时,有助于确定缺血部位,如当SEP与MEP同时出现异常时通常考虑皮质缺血,而仅仅只有MEP异常时,应该首先考虑皮质下缺血[25]。
大脑中动脉瘤约占所有颅内动脉瘤的20%,破裂后常伴颅内血肿。由于大脑中动脉是大脑运动和感觉功能区的主要供血血管,手术过程中一旦发生缺血,术后致残率相当高[26]。大脑中动脉皮质支供应中央前、后回的下3/4,包括上肢腕部的感觉与运动中枢,但不包括内踝部的感觉与运动区,因此上肢SEP和MEP监测比下肢SEP和MEP监测更适合大脑中动脉瘤手术监测[27]。SEP与MEP均能有效监测皮质血流灌注情况,而穿支动脉缺血时可能仅有MEP异常,SEP呈阴性[25]。原因是发自大脑中动脉的穿支动脉主要供应内囊后上 2/3 及侧脑室旁前部的尾状核体部部分,包含了内囊中穿过的传导运动的皮质脊髓束,未完全包含传导感觉的丘脑中央辐射。
推荐意见6:推荐将正中神经SEP、上肢MEP为主要监测指标,胫后神经SEP、下肢MEP为辅助监测指标。并且,MEP比SEP更能实现对穿支动脉血流灌注的监测。(中等证据,强推荐)
前交通动脉瘤是颅内动脉瘤中较为常见的一种类型,由于瘤体指向多变,其处理相对棘手。动脉瘤毗邻的ACoA和ACA附近穿支血管较多,手术时容易发生血管损伤。Heubner回返动脉一般于大脑前动脉与ACoA分叉处发出,其分支分布于壳核前部、尾状核头及两者之间的内囊前肢等部位,Heubner回返动脉损伤会造成患者对侧面瘫及上肢轻瘫[28]。对侧上肢MEP及正中神经SEP的监测有助于判断是否存在Heubner回返动脉的损伤;另外,ACA的供血区域不仅包括大脑半球内侧面,还覆盖半球背外侧面,可达额中回上缘、中央前后回的上四分之一。因此,在大脑前动脉瘤和前交通动脉瘤手术中,一旦误夹同侧大脑前动脉A2段,可能会导致患者出现对侧下肢偏瘫及感觉障碍。
ACA/ACoA动脉瘤夹闭术中出现的脑缺血事件,SEP监测比MEP更具有指导意义[29, 30]。另外,由于正中神经SEP并不能完全反映ACA区域内的脑血流(cerebral blood flow,CBF)情况,所以胫后神经SEP更常用于监测ACA/ACoA动脉瘤手术中的缺血性损伤。
推荐意见7:推荐将胫后神经SEP、下肢MEP为主要监测指标,正中神经SEP、上肢MEP为辅助监测指标。并且,对侧下肢MEP及对侧胫后神经SEP术中监测有助于及时发现相关异常。(中等证据,强推荐)
AChA供血区包括部分海马、基底节、内囊后肢,向上延伸至侧脑室中央部外侧区域,手术中若影响AChA的供血,将发生对侧肢体偏瘫和偏身感觉障碍[31]。特别是动脉瘤与AChA关系密切的类型,术中临时阻断载瘤动脉以及对动脉瘤进行塑形,这些操作都可能干扰AChA的供血。电生理监测对预测脉络膜前动脉被误夹后出现对侧肢体偏瘫和偏身感觉障碍的特异度和敏感度都很高。术前造影发现存在胚胎型大脑后动脉的情况,要特别保护后交通动脉,进行电生理监测可以提示后交通动脉误夹后出现的神经功能损害。
在巨大床突段动脉瘤夹闭术中,手术操作更加复杂,对邻近血管的干扰更大,因而电生理监测的应用尤为重要[32]。术中电生理监测可用于评估术前未常规行压颈试验或球囊闭塞试验患者的侧支循环代偿能力,从而判断其是否能耐受一侧颈内动脉阻断并评估阻断时间。若术中阻断颈内动脉后,MEP波幅随即出现降低超过80%,则表明该患者对颈内动脉闭塞缺乏耐受性,此种情况下行颈内动脉阻断应非常慎重[32]。此外,由于颈内动脉眼动脉段和床突段靠近视神经,因此在行眼动脉段及床突段动脉瘤夹闭术中,VEP监测对患者视力视野的保护具有一定的作用[33]。
推荐意见8:脉络膜前动脉瘤和后交通动脉瘤手术的监测均建议采用双侧正中神经SEP、上肢MEP。眼动脉段及床突段动脉瘤手术中考虑增加VEP监测。(低等证据,弱推荐)
处理基底动脉顶端动脉瘤时,特别要注意对基底动脉顶端附近的丘脑穿支动脉的保护[34, 35]。丘脑穿支动脉常常位于瘤体的背侧。穿支动脉的损伤是导致涉及丘脑、中脑等部位梗死的主要原因,术中主要依靠电生理监测来保护小穿支[36]。
小脑上动脉分支供应内侧丘系(躯干、四肢意识性本体感觉及皮肤精细触觉传导通路)、外侧丘系(听觉通路的一部分)及脊髓丘脑束(传导躯干和四肢的痛、温、触及压觉)。夹闭手术多采用乙状窦后入路,暴露动脉瘤时,有可能影响听神经的功能,因此BAEP有助于提醒术者轻柔操作,避免过度牵拉或损伤毗邻的听神经。小脑后下动脉(PICA)近侧段常发出脑干穿支血管。在进行近侧段PICA动脉瘤手术时,穿支血管的损伤可能导致后组颅神经损伤和锥体束的水肿[37]。
后循环动脉瘤的监测中,MEP比SEP更敏感,MEP改变出现的时间比SEP早,且改变更为显著。对于基底动脉主干动脉瘤,BAEP的敏感度可能仍然不及SEP,而在椎动脉和小脑前下/后下动脉动脉瘤术中,BAEP敏感度达60%,超过SEP[38]。SEP监测范围可以覆盖由基底动脉穿支供血的一些重要区域。对涉及丘脑感觉通路的穿支血管而言,如果出现术中损伤,会出现SEP异常,而MEP无明显变化的情况。
推荐意见9:对基底动脉尖、PCA、SCA动脉瘤,建议重点监测正中神经SEP、上肢MEP、BAEP和VEP,辅助监测胫后神经SEP、下肢MEP;对PICA、小脑前下动脉(AICA)动脉瘤,建议重点监测正中神经SEP、上肢MEP、BAEP、胫后神经SEP、下肢MEP、面MEP;对远端PICA、PCA(P3/4)动脉瘤,建议重点监测正中及胫后神经SEP、上下肢MEP和VEP。(中等证据,弱推荐)
破裂动脉瘤与未破裂动脉瘤的术中电生理监测通常选择同样的评估标准,但其效能存在差异。首先,破裂与未破裂动脉瘤IONM异常的比例不同,破裂动脉瘤组患者SEP出现异常的比例明显高于未破裂组[39],主要原因是破裂动脉瘤患者蛛网膜下腔出血引起的皮质功能紊乱影响大脑的电生理基线。其次,IONM对未破裂动脉瘤患者术后脑缺血监测的敏感度和特异度比破裂动脉瘤患者都要高[40],是因为动脉瘤破裂已经损害了部分正常脑功能,术中对神经功能轻微的干扰即可引发电生理监测指标的改变。但是,SEP在动脉瘤术中不可逆改变对于未破裂患者术后卒中发生率的预测作用高于破裂患者,可能与破裂动脉瘤术后发生延迟性血管痉挛发生有关[39]。
不管是采用血管内球囊阻断还是临时动脉瘤夹阻断,都可采用术中神经电生理监测。阻断造成的神经功能损害取决于阻断的时间,载瘤动脉临时阻断的时限报道不一[3,11],一般认为,颈内动脉临时阻断14 min不会造成术后缺血性损害[41];有研究指出大脑中动脉临时阻断时间不应超过5 min[42]。脑组织对后来的临时阻断表现出更高的耐受性。MEP恢复所需要的时间与阻断时间呈正相关,即阻断时间越长,MEP恢复所需时间越长。阻断载瘤动脉后出现电生理监测指标异常的时间因个体而异,根据经验推断阻断载瘤动脉的安全时间是不可靠的。常规情况下,应依靠电生理监测出现异常,给予手术医生做出及时调整的依据。
在动脉瘤介入术中,神经电生理监测亦有重大意义。电生理监测技术结果可以用来评估球囊阻断时间长短和支架置入是否合适,术中通过打开球囊或调整支架来降低术后神经功能障碍的发生率。首先,电生理监测可以帮助选择合适的介入导管,直径过大的导管可能引起缺血而导致SEP发生改变。其次,术中DSA显示有血管痉挛而SEP未见明显变化的患者,术后通常无神经功能异常,因此电生理监测对于术中血管痉挛损伤的判定也有一定意义。此外,除了电极放置更加便利,动脉瘤介入手术中神经电生理监测方式选择和评判标准与夹闭基本相同。
在动脉瘤夹闭或介入手术中,神经电生理监测对动脉瘤手术的神经功能保护起到了越来越重要的作用。除了在电生理监测的技术方面要做到规范化,对不同部位的动脉瘤,或相同部位不同形态特征的动脉瘤,术前应根据动脉瘤处理过程中可能出现的问题,设计出个体化监测方案,可以提高电生理监测的准确率,降低假阳性和假阴性率,更有效地提高神经功能保护作用。
执笔者:熊南翔(武汉大学中南医院神经外科);蔡远坤(武汉大学中南医院神经外科);潘智勇(武汉大学中南医院神经外科);王孟阳(武汉大学中南医院神经外科);柳雯(武汉大学中南医院神经外科);周易玄(武汉大学中南医院神经外科);杨静怡(武汉大学中南医院神经外科);戴璇(武汉大学中南医院神经外科)
方法学专家:靳英辉(武汉大学循证与转化医学中心)
共识专家组成员(按姓氏汉语拼音排序):方媛(四川大学华西医院神经外科);郭东生(华中科技大学同济医学院附属同济医院神经外科);胡勇(香港大学深圳医院骨科医学中心);杭春华(南京大学医学院附属鼓楼医院神经外科);李晓宇(首都医科大学宣武医院神经外科);李六一(河南省人民医院神经外科);李鹃(中南大学湘雅医院神经外科);刘献增(北京大学国际医院神经外科);茆翔(安徽医科大学附属第一医院神经外科);齐华光(西安交通大学医学院附属红会医院功能检查科);乔慧(北京神经外科研究所神经电生理室);宋红梅(吉林大学第一医院神经肿瘤外科);孙晓川(重庆医科大学附属第一医院神经外科);孙海峰(宁夏医科大学总医院神经中心电生理科);田宏(中日友好医院神经外科);王硕(首都医科大学附属北京天坛医院神经外科);熊南翔(武汉大学中南医院神经外科);徐欣(解放军总医院第一医学中心神经外科);杨超(中山大学附属第一医院神经外科);应婷婷(上海交通大学医学院附属新华医院神经外科);袁辉胜(湖北省中西医结合医院神经外科);赵元立(首都医科大学附属北京天坛医院神经外科);张鸿祺(首都医科大学附属宣武医院神经外科);张良文(山东第一医科大学附属省立医院神经外科)
中国研究型医院学会临床神经电生理专业委员会, 中国医师协会神经外科医师分会神经电生理学组. 颅内动脉瘤术中神经电生理监测中国专家共识(2023版)[J]. 中华医学杂志, 2023, 103(3): 158-166. DOI: 10.3760/cma.j.cn112137-20220909-01915.
所有作者均声明不存在利益冲突



























