
探讨儿童TCF3-PBX1融合基因阳性急性前体B淋巴细胞白血病(B-ALL)的临床特征及预后因素。
回顾性分析2011年4月至2020年12月福建省5家医院(福建医科大学附属协和医院、厦门大学附属第一医院、福建医科大学附属漳州市医院、福建医科大学附属泉州第一医院、福建省南平市第一医院)收治的1 287例初诊B-ALL患儿的临床资料。根据TCF3-PBX1融合基因检测结果,将患儿分为TCF3-PBX1阳性组与TCF3-PBX1阴性组,比较两组患儿的临床特征、早期治疗反应[诱导中及诱导结束时的微小残留病(MRD)]及远期疗效[总生存(OS)及无事件生存(EFS)],采用Kaplan-Meier法进行生存分析,采用Cox比例风险模型分析TCF3-PBX1阳性B-ALL的预后影响因素。83例TCF3-PBX1阳性ALL患儿中,62例治疗方案、危险分层、疗效评价采用中国儿童白血病协作组(CCLG)-ALL 2008方案,21例采用中国儿童肿瘤协作组(CCCG)-ALL 2015方案,比较两组疗效及严重不良事件(SAE)发生率。
1 287例B-ALL患儿中,83例(6.4%)TCF3-PBX1阳性。与TCF3-PBX1阴性组相比,TCF3-PBX1阳性组初诊白细胞计数(WBC)≥50×109/L的患儿比例更高,但诱导第15天或第19天MRD≥1%、诱导第33天或第46天MRD≥0.01%的患儿比例均更低(均P<0.05)。Cox回归单因素分析显示,诱导治疗第15天或第19天MRD≥1%、诱导第33天或第46天TCF3-PBX1定量≥0.01%为OS及EFS的危险因素(均P<0.05)。多因素分析显示,诱导治疗第15或第19 MRD≥1%为OS(HR=10.589,95% CI 1.903~58.933,P=0.007)及EFS(HR=10.218,95% CI 2.429~42.980,P=0.002)的独立危险因素;诱导治疗第33天或第46天TCF3-PBX1定量≥0.01%为EFS的独立危险因素(HR=6.058,95% CI 1.463~25.087,P=0.013),但不是OS的独立危险因素(HR=3.550,95% CI 0.736~17.121,P=0.115)。TCF3-PBX1阳性组10年EFS率及OS率分别为84.6%(95% CI 76.9%~93.1%)、89.1%(95% CI 82.1%~96.6%),与TCF3-PBX1阴性组差异均无统计学意义(均P>0.05)。80例接受规范治疗的患儿中,与接受CCLG-ALL 2008方案治疗的患儿相比,接受CCCG-ALL 2015方案治疗的患儿感染相关SAE发生率更低[0(0/21)比20.3%(12/59),χ2=5.22,P=0.022],但两组的治疗相关死亡率、复发率、EFS及OS差异均无统计学意义(均P>0.05)。
TCF3-PBX1阳性儿童B-ALL总体预后良好,诱导中期MRD≥1%及诱导结束TCF3-PBX1定量≥0.01%可能为不良预后的影响因素,CCCG-ALL 2015方案在获得良好疗效的同时可减少感染相关SAE。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性淋巴细胞白血病(ALL)是儿童最常见的恶性肿瘤,约占同时期儿童恶性肿瘤的30%。随着危险分层的日趋精准、支持治疗的不断增强及对特殊融合基因亚型靶向治疗的开展,目前欧美发达国家儿童ALL的5年总生存(OS)率为85%~90%[1]。TCF3-PBX1(又称E2A-PBX1)融合基因是由19号染色体短臂1区3带的TCF3基因与1号染色体长臂2区3带上的PBX1基因相互融合形成,TCF3的转录激活基序和PBX1的DNA同源结构域融合形成一个嵌合型转录因子,前体B细胞可在该转录因子持续激活下发生克隆性增殖,从而导致白血病的发生[2]。由于TCF3-PBX1融合基因在儿童ALL中的阳性率较低,目前国内针对TCF3-PBX1融合基因阳性儿童ALL的报道多为较小样本的单中心研究[3,4,5,6,7],大样本的研究仍较少。本研究回顾性分析福建省多中心该亚型患儿的临床特征、预后因素及不同治疗方案的疗效,旨在深入了解该亚型ALL的临床特点,为优化治疗方案以进一步提高疗效提供参考。
福建省年收治新诊断ALL患儿≥5例的医院包括福建医科大学附属协和医院、厦门大学附属第一医院、福建医科大学附属漳州市医院、福建医科大学附属泉州第一医院、福建省南平市第一医院,回顾性分析上述5家医院2011年4月至2020年12月初诊ALL患儿资料。纳入标准:(1)患儿年龄>1个月且≤14岁;(2)临床表现符合ALL,并经骨髓常规、免疫分型、细胞遗传学及分子生物学(MICM)(TCF3-PBX1、ETV6-RUNX1、BCR-ABL1、MLL-AF4等融合基因为常规检测项目)检查明确诊断[8];(3)初发患儿(来院就诊前未经过任何ALL相关治疗)。排除标准:(1)流式细胞术检测提示为T细胞型或成熟B细胞型;(2)依据世界卫生组织(WHO)或欧洲白血病免疫学分型协作组标准诊断混合表型急性白血病;(3)慢性粒细胞白血病急淋变;(4)21三体综合征或伴有脏器功能损害的先天性或遗传性疾病;(5)其他继发性白血病;(6)先天性免疫缺陷病或代谢性疾病;(7)先天性心脏病伴心功能不全;(8)入组前1个月内使用糖皮质激素≥14 d,或3个月内有任何化疗、放疗史。所有患儿初诊时均通过多重巢式反转录聚合酶链反应筛查出相关的融合基因,筛查出TCF3-PBX1阳性的患者后续采用荧光定量聚合酶链反应及TaqMan探针定量法检测TCF3-PBX1基因的拷贝数。本研究已通过福建医科大学附属泉州第一医院伦理委员会批准(批准文号:泉一伦[2021]216号),豁免患者知情同意。
83例TCF3-PBX1阳性ALL患儿中,62例治疗方案、危险分层、疗效评价采用中国儿童白血病协作组(CCLG)-ALL 2008方案[9],21例采用中国儿童肿瘤协作组(CCCG)-ALL 2015方案[10]。两种化疗方案的对比及严重不良事件(SAE)的定义参照文献[11]。比较两种治疗方案诱导期的SAE发生率。
患儿在诱导化疗期间使用BC Navios流式细胞仪(美国Beckman公司)监测MRD,其中CCLG-ALL 2008方案组患儿在诱导化疗第15天及第33天抽取骨髓评估MRD,CCCG-ALL 2015方案组患儿在诱导化疗第19天及第46天抽取骨髓评估MRD。
所有患儿通过门诊复查或电话进行随访,随访截至2021年12月31日。中位随访时间56.1个月(1.2~125.9个月)。OS时间为患者开始治疗至死亡或末次随访的时间;无事件生存(EFS)时间为开始治疗至发生任何事件的时间,包括任何原因所致死亡、疾病进展、复发或失访。CCLG-ALL 2008方案组中1例因诱导治疗后放弃治疗而失访、2例因诱导治疗后转院而未纳入生存分析。观察患儿一般情况、复发及干预措施、生存情况,监测骨髓象、MRD。
采用SPSS 25.0统计学软件进行数据分析。计数资料用频数(%)表示,组间比较采用χ2检验或Fisher确切概率法。符合正态分布的计量资料用 ±s表示,非正态分布的计量资料用中位数(范围)表示。采用Kaplan-Meier法进行生存分析,并进行log-rank检验。采用Cox比例风险模型进行预后因素分析。P<0.05为差异有统计学意义。
±s表示,非正态分布的计量资料用中位数(范围)表示。采用Kaplan-Meier法进行生存分析,并进行log-rank检验。采用Cox比例风险模型进行预后因素分析。P<0.05为差异有统计学意义。
共纳入1 414例儿童ALL,包括1 287例(91.0%)急性前体B淋巴细胞白血病(B-ALL),其中TCF3-PBX1融合基因阳性83例,占ALL的5.9%(83/1 414),占B-ALL的6.4%(83/1 287)。83例TCF3-PBX1阳性与1 204例TCF3-PBX1阴性B-ALL患儿的临床特征及早期疗效比较见表1。与TCF3-PBX1阴性组比较,TCF3-PBX1阳性组初诊白细胞计数(WBC)≥50×109/L的患儿比例更高(P=0.005),但诱导化疗第15天或第19天MRD≥1%、诱导化疗第33天或第46天MRD≥0.01%的患儿比例更低(均P<0.05)。
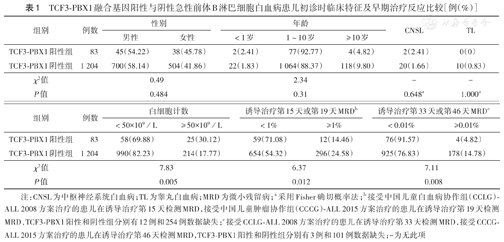
TCF3-PBX1融合基因阳性与阴性急性前体B淋巴细胞白血病患儿初诊时临床特征及早期治疗反应比较[例(%)]
TCF3-PBX1融合基因阳性与阴性急性前体B淋巴细胞白血病患儿初诊时临床特征及早期治疗反应比较[例(%)]
| 组别 | 例数 | 性别 | 年龄 | CNSL | TL | |||
|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | <1岁 | 1~10岁 | ≥ 10岁 | ||||
| TCF3-PBX1阳性组 | 83 | 45(54.22) | 38(45.78) | 2(2.41) | 77(92.77) | 4(4.82) | 2(2.41) | 0(0) |
| TCF3-PBX1阴性组 | 1 204 | 700(58.14) | 504(41.86) | 22(1.83) | 1 064(88.37) | 118(9.80) | 20(1.66) | 10(0.83) |
| χ2值 | 0.49 | 2.34 | - | - | ||||
| P值 | 0.484 | 0.31 | 0.648a | 1.000a | ||||
| 组别 | 例数 | 白细胞计数 | 诱导治疗第15天或第19天MRDb | 诱导治疗第33天或第46天MRDc | |||
|---|---|---|---|---|---|---|---|
| <50×109/L | ≥ 50×109/L | <1% | ≥1% | <0.01% | ≥0.01% | ||
| TCF3-PBX1阳性组 | 83 | 58(69.88) | 25(30.12) | 59(71.08) | 12(14.46) | 76(91.57) | 4(4.82) |
| TCF3-PBX1阴性组 | 1 204 | 990(82.23) | 214(17.77) | 654(54.32) | 296(24.58) | 925(76.83) | 178(14.78) |
| χ2值 | 7.83 | 6.37 | 7.11 | ||||
| P值 | 0.005 | 0.012 | 0.008 | ||||
注:CNSL为中枢神经系统白血病;TL为睾丸白血病;MRD为微小残留病;a采用Fisher确切概率法;b接受中国儿童白血病协作组(CCLG)-ALL 2008方案治疗的患儿在诱导治疗第15天检测MRD,接受中国儿童肿瘤协作组(CCCG)-ALL 2015方案治疗的患儿在诱导治疗第19天检测MRD,TCF3-PBX1阳性和阴性组分别有12例和254例数据缺失;c接受CCLG-ALL 2008方案治疗的患儿在诱导治疗第33天检测MRD,接受CCCG-ALL 2015方案治疗的患儿在诱导治疗第46天检测MRD,TCF3-PBX1阳性和阴性组分别有3例和101例数据缺失;-为无此项
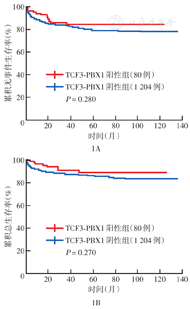
83例TCF3-PBX1阳性B-ALL患儿中,1例因诱导治疗后放弃治疗而失访;2例诱导治疗后转院,至截稿仍无病生存。TCF3-PBX1阳性组10年EFS及OS率分别为84.6%(95% CI 76.9%~93.1%)、89.1%(95% CI 82.1%~96.6%),均高于TCF3-PBX1阴性组[77.8%(95% CI 75.0%~80.8%)、83.6%(95% CI 81.0%~86.2%)],但差异均无统计学意义(均P>0.05)(图1)。

80例患儿接受规范治疗,71例在随访截止日期仍无病生存,2例发生治疗相关死亡(1例重症感染,1例重症胰腺炎);7例复发(均为骨髓复发):3例复发后接受再诱导化疗达缓解,之后进行造血干细胞移植(HSCT)(其中1例移植后因再次复发死亡,2例目前仍生存);4例复发后再诱导化疗不能达缓解(2例死于感染,2例放弃治疗后死亡)。对规范治疗的80例TCF3-PBX1阳性B-ALL进行Cox回归单因素分析,结果显示,诱导治疗第15天或第19天MRD、诱导治疗第33天或第46天TCF3-PBX1对OS及EFS均有影响(均P<0.05),性别、初诊年龄、初诊时WBC及诱导治疗第33天或第46天MRD对OS及EFS均无影响(均P>0.05)(表2)。多因素分析结果显示,诱导治疗第15天或第19天MRD≥1%为OS(HR=10.589,95% CI 1.903~58.933,P=0.007)及EFS(HR=10.218,95% CI 2.429~42.980,P=0.002)的独立危险因素;诱导治疗第33天或第46天TCF3-PBX1定量≥0.01%为EFS的独立危险因素(HR=6.058,95% CI 1.463~25.087,P=0.013),但不是OS的独立危险因素(HR=3.550,95% CI 0.736~17.121,P=0.115)。在80例TCF3-PBX1阳性ALL中仅有1例患儿同时检出IKZF1缺失型突变(第1号至第8号外显子缺失),该患者最终复发并死亡。
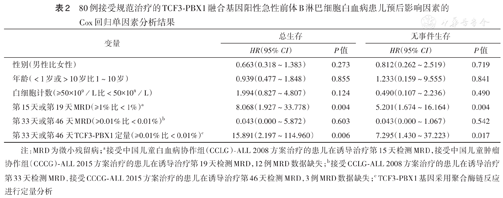
80例接受规范治疗的TCF3-PBX1融合基因阳性急性前体B淋巴细胞白血病患儿预后影响因素的Cox回归单因素分析结果
80例接受规范治疗的TCF3-PBX1融合基因阳性急性前体B淋巴细胞白血病患儿预后影响因素的Cox回归单因素分析结果
| 变量 | 总生存 | 无事件生存 | ||
|---|---|---|---|---|
| HR(95% CI) | P值 | HR(95% CI) | P值 | |
| 性别(男性比女性) | 0.663(0.318~1.383) | 0.273 | 0.812(0.262~2.519) | 0.719 |
| 年龄(<1岁或>10岁比1~10岁) | 0.939(0.477~1.848) | 0.855 | 1.233(0.159~9.555) | 0.841 |
| 白细胞计数(≥50×109/L比<50×109/L) | 1.994(0.827~4.807) | 0.124 | 0.490(0.107~2.236) | 0.490 |
| 第15天或第19天MRD(≥1%比<1%)a | 8.068(1.927~33.778) | 0.004 | 5.201(1.674~16.164) | 0.004 |
| 第33天或第46天MRD(≥0.01%比<0.01%)b | 0.043(0.000~5.872) | 0.603 | 0.043(0.000~1.067) | 0.542 |
| 第33天或第46天TCF3-PBX1定量(≥0.01%比<0.01%)c | 15.891(2.197~114.960) | 0.006 | 7.295(1.430~37.223) | 0.017 |
注:MRD为微小残留病;a接受中国儿童白血病协作组(CCLG)-ALL 2008方案治疗的患儿在诱导治疗第15天检测MRD,接受中国儿童肿瘤协作组(CCCG)-ALL 2015方案治疗的患儿在诱导治疗第19天检测MRD,12例MRD数据缺失;b接受CCLG-ALL 2008方案治疗的患儿在诱导治疗第33天检测MRD,接受CCCG-ALL 2015方案治疗的患儿在诱导治疗第46天检测MRD,3例MRD数据缺失;c TCF3-PBX1基因采用聚合酶链反应进行定量分析
80例接受规范治疗的TCF3-PBX1阳性B-ALL患儿中,21例接受CCCG-ALL 2015方案化疗,59例接受CCLG-ALL 2008方案化疗。21例接受CCCG-ALL 2015方案化疗的患儿中,4例(19.0%)发生4例次SAE,均为非感染相关SAE,包括1例可逆性后部脑白质脑病、继发性癫痫,2例需要进行血液透析的高甲氨蝶呤血症,1例门冬酰胺酶相关胰腺炎(AAP);无治疗相关死亡(TRM);1例(4.8%)复发,复发时间20.0个月。59例接受CCLG-ALL 2008方案化疗的患儿中,17例(28.8%)发生20例次SAE,其中12例(20.3%)发生13例次感染相关SAE,5例(23.1%)发生7例次SAE,2例(3.4%)发生TRM;6例(10.2%)复发,复发中位时间19.8个月(7.4~36.6个月)。CCCG-ALL 2015方案组SAE发生率低于CCLG-ALL 2008方案组,但差异无统计学意义(χ2=0.76,P=0.382),其中CCCG-ALL 2015方案组感染相关SAE发生率低于CCLG-ALL 2008方案组(χ2=5.22,P=0.022),而两组非感染相关SAE发生率差异无统计学意义(χ2=1.73,P=0.188)。两组TRM率及复发率差异均无统计学意义(均P>0.05)。CCCG-ALL 2015方案组3年EFS、OS率均高于CCLG-ALL 2008方案组,但差异均无统计学意义[EFS率:94.4%(95% CI 84.4%~100.0%)比85.8%(95% CI 77.1%~95.4%),P=0.340;OS率:100.0%比87.5%(95% CI 79.3%~96.6%),P=0.170]。
在不同的儿童ALL研究队列中,TCF3-PBX1阳性的检出率不同。来自NOPHO的研究显示,TCF3-PBX1阳性在儿童ALL中的检出率为1.8%[12]。欧美协作组的研究显示,TCF3-PBX1阳性在儿童ALL中的检出率为2.9%~3.3%[1,13]。在日本的一项研究中,TCF3-PBX1阳性在儿童ALL中的检出率为7.2%。我国较大样本报道,TCF3-PBX1阳性在儿童ALL中的检出率为4.8%~6.5%,在B-ALL中的检出率为6.3%~7.2%[6,7,14,15,16,17]。本研究TCF3-PBX1阳性在ALL中的检出率为5.9%,在B-ALL中的检出率为6.4%,与上述我国大样本研究结果相似。
关于TCF3-PBX1阳性ALL的临床特征,不同文献报道结果不同。相比TCF3-PBX1阴性ALL患儿,TCF3-PBX1阳性ALL患儿的初诊年龄较大、WBC较高[15,17]。在我国两项研究中,TCF3-PBX1阳性组与TCF3-PBX1阴性组相比,初诊年龄和WBC差异均无统计学意义,但TCF3-PBX1阳性组在诱导中及诱导后转阴率更高[5,6]。本研究中,TCF3-PBX1阳性组与TCF3-PBX1阴性组相比,初诊年龄差异无统计学意义,但TCF3-PBX1阳性组初诊高WBC患者比例更高,而早期诱导反应良好(诱导中MRD<1%及诱导后转阴),与上述文献报道一致。
既往TCF3-PBX1阳性为ALL预后危险因素,但在给予高强度化疗后,TCF3-PBX1阳性ALL总体预后良好,5年EFS率约85%,OS率可达90%,与预后良好的ETV6-RUNX1和超二倍体核型相似[6,12,15,18]。本研究中的TCF3-PBX1阳性ALL生存率与上述文献报道相当。TCF3-PBX1阳性B-ALL复发率约为10%,与预后良好的ETV6-RUNX1和超二倍体核型B-ALL相似,但复发后往往经历高度耐药,对治疗反应差,预后不良[19]。本研究复发率约10%,与文献报道相似[3,5,17,18];复发后再诱导缓解率不足50%,长期生存率不足30%,低于ETV6-RUNX1 B-ALL[20]。嵌合抗原受体T细胞(CAR-T)治疗可提高二次缓解率及MRD清除率,可能改善该亚型预后[21]。另有临床前研究显示,磷脂酰肌苷3-激酶δ(p110δ)抑制剂依地那利昔布(idelalisib)是治疗复发TCF3-PBX1阳性B-ALL的有效药物[22]。这都将成为进一步提高该亚型OS率的希望。
关于TCF3-PBX1阳性ALL的预后影响因素,既往研究较少对此进行分析,这可能与例数相对较少,而预后良好有关[3,7,12,15,17]。在日本的一项大样本研究中,诱导第15天或第33天的MRD水平并不能预测复发,但在123例TCF3-PBX1阳性ALL中共检出3例IKZF1缺失型突变,最终均复发[18]。在本研究中,仅有的1例IKZF1缺失型突变患儿最终复发并死亡,结合文献[18],推测IKZF1缺失型突变可能为TCF3-PBX1阳性ALL不良预后因素,但因例数少,结论仍需要更大样本的验证。本研究预后分析结果显示,诱导第15天或第19天MRD≥1%为OS及EFS的独立危险因素,第33天或第46天TCF3-PBX1定量≥0.01%为EFS的危险因素,提示诱导中期MRD水平及诱导后基因定量可能为预后影响因素,其中诱导结束基因定量水平影响预后与文献[3,4]报道一致,但诱导中MRD水平与预后的相关性仍需要更多研究验证支持。
治疗相关SAE加重了家庭经济负担并可能影响患儿远期生命质量,SAE所致的TRM仍是除复发外最重要的预后影响因素[23,24]。因此在保证疗效的基础上,通过优化方案减少SAE及TRM对于改善预后和生命质量至关重要。感染是最常见的SAE,也是导致TRM最常见的原因。研究显示,高强度化疗及中性粒细胞缺乏持续时间长是发生感染相关SAE最重要的危险因素[23,25]。致命性感染多数发生在诱导的第3周[25]。CCCG-ALL 2015方案组的感染相关SAE发生率更低,其原因可能与CCCG-ALL 2015方案降低了单个疗程的化疗强度有关,如CCCG-ALL 2015方案在中危型ALL诱导缓解阶段柔红霉素减量为2次(CCLG-ALL 2008方案为3~4次),这样就避免了在最常发生重症感染的诱导第3周时使用柔红霉素,可显著缩短化疗后骨髓抑制的时间,避免重症感染的发生。
总之,TCF3-PBX1融合基因阳性儿童ALL初诊WBC更高,但早期治疗反应良好,长期生存率高,总体预后佳;诱导中期MRD≥1%及诱导结束TCF3-PBX1定量≥0.01%可能为预后的危险因素;CCCG-ALL 2015方案在获得良好疗效的同时可减少感染相关SAE。
所有作者均声明不存在利益冲突



























