
甲状腺内胸腺癌(intrathyroid thymic carcinoma,ITTC)是一种非常罕见的头颈部肿瘤,组织形态学上易与原发性甲状腺低分化鳞状细胞癌、甲状腺髓样癌、甲状腺未分化癌等混淆。由于病例较少,影像学及穿刺细胞学特征尚未明确,导致诊治过程中误诊及过度治疗概率大。本文报道1例ITTC,62岁女性患者,因颈部不适入院,甲状腺超声发现病灶,分析其临床表现、影像学、组织形态学及免疫表型特点,并复习相关文献,旨在提高头颈外科和病理科医师对此病的认识水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,62岁。2021年9月8日因颈部不适1 d就诊于当地医院,超声提示甲状腺肿物。为求进一步诊治入吉林大学第一医院,甲状腺彩超提示双叶体积增大,伴多发结节,左叶较大的甲状腺影像报告和数据系统(C-TIRADS)4C级、其余C-TIRADS 3级。双侧颈部可见淋巴结,左侧四区及六区部分性质待定。颈部软组织CT示双侧颌下及颈动脉鞘周围间隙见多发软组织结节影,边界欠清,直径0.5~0.7 cm。甲状腺两叶体积增大,左叶较明显,其内见大小约2.5 cm×1.7 cm不规则密度影,并向下突入胸廓内口,增强扫描呈低强化。实验室检查:甲状腺功能五项,钙、磷、碱性磷酸酶、甲状旁腺激素(PTH)均在正常值范围内。因考虑肿物恶性可能性大,且生长位置向下突入胸廓内口,不排除后期压迫气管及远处转移可能,故与患者及其家属沟通后,未行甲状腺细针穿刺活检术,建议限期手术治疗。经完善术前喉镜检查后,于9月10日全麻下行双侧甲状腺全部切除、左侧多功能保留颈淋巴结清扫术。术中可见甲状腺左叶中下部背侧大小约3.3 cm×3.0 cm实性质硬肿物,无完整包膜。肿物向内侧与气管、食管、左侧喉返神经、左下甲状旁腺关系密切,肉眼观察不除外侵及带状肌及部分胸锁乳突肌;甲状腺周围见多枚肿大淋巴结,大部分左侧颈内静脉旁,切除肿物并送检术中快速冷冻病理。
病理检查:左侧甲状腺组织,重19 g,体积6.5 cm×3.0 cm×2.5 cm,切面见一灰白色、实性质硬区,体积3.3 cm×3.0 cm×2.0 cm。右侧甲状腺组织重9.5 g,体积4.5 cm×2.5 cm×1.5 cm,切面褐色、实性、质软。左Ⅱ~Ⅵ区淋巴结数枚,部分粘连成团。显微镜下可见左侧肿瘤累及至甲状腺外软组织,肿瘤组织由巢状、岛状或相互吻合的梁带状分布的上皮样细胞组成,其间可见宽窄不一的致密纤维组织分隔(图1),肿瘤细胞多边形、鳞状或合体样,胞质丰富、弱嗜酸性,核较大、圆形或卵圆形、染色质空泡状,可见居中或偏位的嗜伊红色小核仁,核分裂象少见;部分区域可见不同程度鳞状分化(图2)。右侧甲状腺呈现大小不一的滤泡增生,多个结节样。免疫组织化学染色CD5、细胞角蛋白(CK)5/6、CD117、p40均显示阳性(图3, 4, 5, 6),PAX8部分弱阳性,CK7散在阳性,Ki-67阳性指数30%;末端脱氧核苷酸转移酶(TdT)、CK20、甲状腺转录因子(TTF)1均显示阴性。
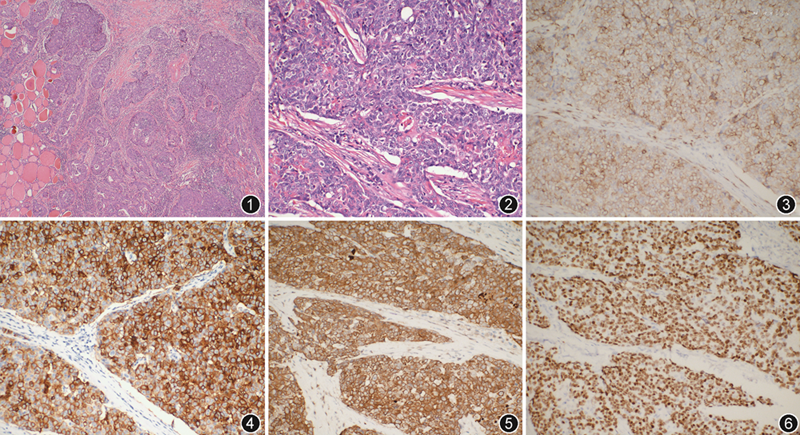

病理诊断:术中快速病理回报为甲状腺低分化癌。术后病理经过免疫组织化学标记证实为左侧甲状腺内胸腺癌;右侧结节性甲状腺肿;周边肌肉组织未见明确癌浸润;左Ⅱ~Ⅵ区共查见淋巴结27枚,直径0.2~1.2 cm,淋巴组织增生,各组淋巴结均未见癌转移。
术后及随访情况:患者手术顺利,术后口服左甲状腺素片100 μg/d。2021年10月12日再次入院行放射治疗,随访15个月未见肿瘤复发和转移。
讨论:甲状腺内胸腺癌(ITTC)旧称甲状腺显示胸腺样分化的癌(carcinoma showing thymus-like differentiation,CASTLE)[1],2017年第4版WHO甲状腺肿瘤分类将其更名为ITTC[2]。在2022版WHO分类中没有发生重大变化,仍将其归于甲状腺内胸腺肿瘤中,其余分类包括胸腺瘤及伴胸腺样分化的梭形细胞肿瘤(SETTLE)[3]。ITTC发病率极低,占所有甲状腺恶性肿瘤的0.08%~0.15%[4, 5]。以中青年人多见,男女比为1.0∶1.3,好发于甲状腺下极[6]。究其来源大多数学者指出其可能由异位的胸腺或鳃囊残余物引起[7],从解剖学方面分析,胚胎发育时期胸腺分化和下降过程中发生异常,可导致异位胸腺的形成。异位胸腺源自胸腺导管上皮的残余,可见于胸腺始基从颈部下降到胸腔纵隔中的某些部位如心包、甲状腺等,后者便成为了ITTC的始动因素,但尚不清楚它是如何获得的发展为恶性肿瘤的可能性[8]。因ITTC具有惰性生物学行为,生长速度较慢,临床常表现为无痛性肿块,症状主要取决于肿瘤的大小及其与邻近器官的关系。如压迫喉返神经出现声音嘶哑、挤压气管出现喘憋感或呼吸困难、邻近食管导致吞咽困难等,并可出现颈部淋巴结转移。据报道,病程中发热症状亦可发生[9]。本例患者自述病程中未出现以上症状,仅有轻微颈部不适感。
影像学特征中颈部超声ITTC多表现为低回声或极低回声,边界不清,内部可见点状或线样高回声,纵横比<1,血流分级0~3级,C-TIRADS分级4A~5级[10],以上特点特异性较低,通常与其他类型甲状腺恶性肿瘤尤其是甲状腺乳头状癌等难以鉴别。Wu等[11]对10例ITTC患者CT影像特点进行了分析,平扫CT为边界不清、密度均匀的结节性肿物,增强CT显示大部分肿物为轻度不均匀增强。CT检查无法动态观察肿物内部回声和分辨肿物内部细微结构[10],故认为本例患者CT增强扫描呈低强化的原因是肿瘤恶性程度较低,细胞增殖较缓慢,且血供相对不丰富。超声引导下细针穿刺活检术通常取材量较少,难以反映病变全貌,对于ITTC正确诊断率只有1.5%[12],而术中冷冻病理因取材限制则易诊断为低或未分化癌。综上,术后病理学检查是诊断ITTC的可靠手段[13]。
在鉴别诊断上,胸腺癌为胸腺上皮来源,ITTC的免疫表达与其一致,即CD5和CD117阳性,二者被认为是诊断的重要指标[6]。在Ito等[14]的研究中,CD5诊断ITTC的特异度为100%,灵敏度为82%,这意味着CD5阴性表达的罕见病例是存在的[15],所以对于临床上若有CD5表达阴性的患者,加做CD117联合两者检测,可以提高对ITTC的诊断。近年来国内外研究显示PAX8在绝大多数甲状腺相关的肿瘤中存在高表达情况,对ITTC具有较好的辅助诊断价值[16]。本例PAX8、p40、CK5/6、CD5及CD117均呈阳性表达,而TdT、CK20、TTF1阴性表达,结合上述免疫组织化学特征,胸部CT检查未提示胸腺明确占位性病变,一定程度上排除了肿瘤为胸腺原发并转移至甲状腺的可能,故ITTC诊断成立。
还需要鉴别诊断的有:(1)原发性甲状腺低分化鳞状细胞癌:在甲状腺原发肿瘤中较罕见,恶性程度高,侵袭性强,预后差。镜下呈现鳞癌特征,核分裂象多见,常伴坏死,但CD5及CD117常常阴性表达可以与ITTC鉴别。(2)甲状腺未分化癌:常见于老年女性,广泛浸润性生长,较早即出现侵犯或压迫周边器官症状,镜下见大片凝固性坏死,栅栏状、肉瘤样结构。TTF1、广谱细胞角蛋白(CKpan)、甲状腺球蛋白(Tg)等可呈阳性或阴性,PAX8大部分阳性,而CD5及CD117均阴性,另未分化癌经充分取材大部分病例可以查见合并的乳头状癌成分。(3)甲状腺髓样癌:二者相似点在于癌巢中均可见大量淋巴细胞浸润,但髓样癌通常淋巴结转移发生较早,且血清降钙素水平高,CD5及CD117均不表达。近年来Gonzales-Laguado等[17]报道1例将ITTC误诊为髓样癌,术后16年再次复发的病例。(4)其他类型甲状腺癌:在乳头状癌、滤泡癌中TTF1均阳性表达,CD5仅呈灶状阳性或弱阳性,此外滤泡癌易血行转移。(5)甲状腺转移性淋巴上皮癌:通常为鼻咽部原发,镜下在大量淋巴细胞及浆细胞中偶见鳞状细胞癌成分,EB病毒检测阳性,并不表达CD5和CD117。
ITTC呈低度恶性,表现为惰性生长方式,治疗首选手术切除,若术前及术中提示有颈部淋巴结转移,将该区域淋巴结彻底清扫是保证预后的必要条件[18]。由于ITTC发病率极低,临床数据并不丰富,因此患者术后是否需接受放、化疗文献报道不一[14, 15]。Gao等[12]认为放疗可显著提高无淋巴结转移患者的生存率,本例患者因癌灶侵犯甲状腺周边肌肉组织,存在局部复发的可能,故术后予以放疗。综上所述,手术切除是治疗ITTC的首选方案,至于术后是否进一步行辅助放、化疗,临床上应综合考虑患者自身情况再做决定[13]。
王野驰, 金美善, 伊丹, 等. 甲状腺内胸腺癌1例[J]. 中华病理学杂志, 2023, 52(5): 518-520. DOI: 10.3760/cma.j.cn112151-20230119-00056.
所有作者声明无利益冲突



























