
儿童后颅窝肿瘤的病理类型多样,术前准确判断肿瘤类型对临床治疗方案的选择和预后评估具有重要意义。该文中重点阐述儿童后颅窝常见肿瘤的影像学表现特点,并梳理影像学诊断思路,以提高影像医师对儿童后颅窝肿瘤的诊断水平。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
在儿童各部位发生的实体肿瘤中,脑肿瘤是导致其死亡的首要原因[1]。后颅窝肿瘤占儿童所有脑肿瘤的45%~60%,大多数发生在3~11岁[2, 3]。儿童后颅窝肿瘤的病理类型多样,其中以髓母细胞瘤最常见,占30%~40%,其他较常见肿瘤包括毛细胞型星形细胞瘤(25%~35%)、弥漫性中线胶质瘤(20%~25%)、室管膜瘤(10%~15%)以及同属于胚胎性肿瘤中的非典型畸胎样/横纹肌样瘤(1%~2%)[4]。少见情况下,儿童后颅窝亦可发生其他病理类型肿瘤,占全部后颅窝肿瘤的10%~15%,包括伴有多层菊形团的胚胎性肿瘤、生殖细胞肿瘤(生殖细胞瘤、畸胎瘤)、脉络丛乳头状瘤、血管母细胞瘤、脑膜瘤、淋巴瘤、中枢神经系统神经母细胞瘤、中枢神经系统节细胞神经母细胞瘤等。不同组织学类型的肿瘤,其临床处置方式不完全相同,术前对肿瘤准确定位、定性,结合年龄、临床资料等明确肿瘤类型,对临床决策的选择至关重要。
儿童后颅窝肿瘤的最常见临床表现为颅高压引起的症状,如头痛、恶心和呕吐等,也可出现共济失调、视乳头水肿、眼球震颤、运动障碍等。婴幼儿则以头围增大为主要表现,多因肿瘤体积较大时,压迫导致脑脊液循环受阻引起梗阻性脑积水。当肿瘤体积较小时,可无任何临床症状。因此,CT和MRI是发现和诊断儿童后颅窝肿瘤的主要方法[5]。CT对于显示肿瘤内是否存在钙化较敏感。MRI因无电离辐射、能够进行多参数多方位成像,已成为儿童脑肿瘤诊断和评估的最佳影像学检查方法。MRI对于显示肿瘤的发生部位、形态、大小、边界、成分、与邻近结构的关系、强化方式、是否出现神经轴的脑脊液播散、预判肿瘤生物学行为等具有重要作用。
1.髓母细胞瘤:是儿童期最常见的中枢神经系统胚胎性肿瘤,WHO分级为Ⅳ级,多见于15岁以前,以3~7岁最多见。发病年龄在3岁以上时,男性多于女性;发病年龄在3岁以下时,无明显性别差异。最常见部位为小脑蚓部,也可发生于小脑半球、第四脑室、桥小脑角区、桥臂等。
影像诊断要点:CT平扫表现为高密度肿块(图1),肿瘤内钙化及囊变不多见,为较小钙化及囊变。MRI能够更好地显示肿瘤的成分,矢状面图像对于判断肿瘤的部位和起源、明确肿瘤与第四脑室、脑干和小脑的关系非常重要。MRI平扫肿块于T1WI呈等-稍低信号,于T2WI呈稍高-高信号,瘤周水肿不明显。DWI序列肿块呈高信号(图2),ADC图信号减低(图3),表现为明显扩散受限,为其诊断关键点,其原因为肿瘤内细胞排列密集,细胞核与细胞质比率高,基质稀少,水分子扩散受限。MRS表现为N-乙酰天冬氨酸峰明显减低,胆碱峰明显升高。MRI增强表现缺乏特异性,肿瘤实质部分强化程度可为轻度至明显强化,强化方式可为均质或呈不均质斑片状强化。由于髓母细胞瘤可经脑脊液通路传播,导致颅内或椎管内蛛网膜下腔播散,因此,对整个神经轴进行MRI增强检查明确是否出现脑膜或脊膜侵犯非常必要。

2016年WHO中枢神经系统肿瘤分类首次在组织学分类的基础上引入分子遗传学概念,对髓母细胞瘤分类和命名进行了调整,分别按照组织学和分子遗传学对其进行分类[6]。2021年WHO中枢神经系统肿瘤分类加深了对分子诊断指标的解读[7]。髓母细胞瘤组织学分类包括经典型、促纤维增生/结节型、广泛结节型、大细胞/间变型[8]。(1)经典型是最常见的组织学亚型,多见于3岁以上儿童,婴幼儿不常见。发生部位主要为后颅窝中线区,可位于小脑蚓部或第四脑室内,当肿瘤体积较大时,起自小脑蚓部的肿瘤可突入并占据第四脑室。(2)促纤维增生/结节型髓母细胞瘤约占组织学分类的20%,约50%见于3岁以下儿童,预后较好,转移发生率低。多发生于小脑半球,少数位于中线区。(3)广泛结节型髓母细胞瘤占组织学分类的3%~4%,多见于3岁以下,预后较好。肿块多位于小脑蚓部,少数累及小脑半球,其特征性表现为MRI增强肿瘤呈多发结节状强化。(4)大细胞/间变型髓母细胞瘤约占组织学分类的10%,儿童期各年龄均可发生,主要位于后颅窝中线区。此亚型预后最差,可早期出现脑脊液播散。
分子遗传学分类的各亚型是根据髓母细胞瘤发病机制中激活的信号通路而命名的,具有不同的细胞起源,包括WNT激活型、SHH激活型、非WNT/非SHH激活型(Group3型、Group4型)[9]。不同亚型髓母细胞瘤的预后有所差别,其发生部位对分型具有一定提示作用[10, 11]。(1)WNT激活型约占分子遗传学分类的10%,女、男比例约为2∶1。起源于背外侧原始脑干下部,沿其迁移通道生长,典型发病部位为桥小脑角区或第四脑室侧孔区,少数位于中线区。常规治疗预后较好。(2)SHH激活型约占分子遗传学分类的30%,无明显性别差异。起源于小脑颗粒细胞前体外部颗粒细胞层,多位于小脑半球。SHH激活型髓母细胞瘤分为两种类型,分别为伴TP53野生型和伴TP53突变型。伴TP53野生型多见于婴儿或青少年,预后较好;伴TP53突变型多见于中间年龄段的儿童,预后较差。(3)非WNT/非SHH激活型约占分子遗传学分类的60%,Group3型约占20%、Group4型约占40%。Group3型髓母细胞瘤多见于婴幼儿和儿童,男、女比例约为2∶1。发生部位多为中线区,以小脑蚓部多见,也可为第四脑室。此类型髓母细胞瘤新生血管多,预后差,可出现脑脊液播散。Group4型髓母细胞瘤可发生在任何年龄,以5~15岁多见,男、女比例约为3∶1。发生部位多为中线区,以第四脑室多见。
2.非典型畸胎样/横纹肌样瘤:是中枢神经系统胚胎性肿瘤的一个独立类型,WHO分级为Ⅳ级,发生率较髓母细胞瘤低,但侵袭性较髓母细胞瘤强。幕上或幕下均可发生,发生于后颅窝者多位于中线旁区,发病年龄通常较髓母细胞瘤小,多见于3岁以下婴幼儿,男性发病率高于女性[12]。肿瘤多位于小脑蚓部、小脑半球或桥小脑角区,少数情况下可位于第四脑室。
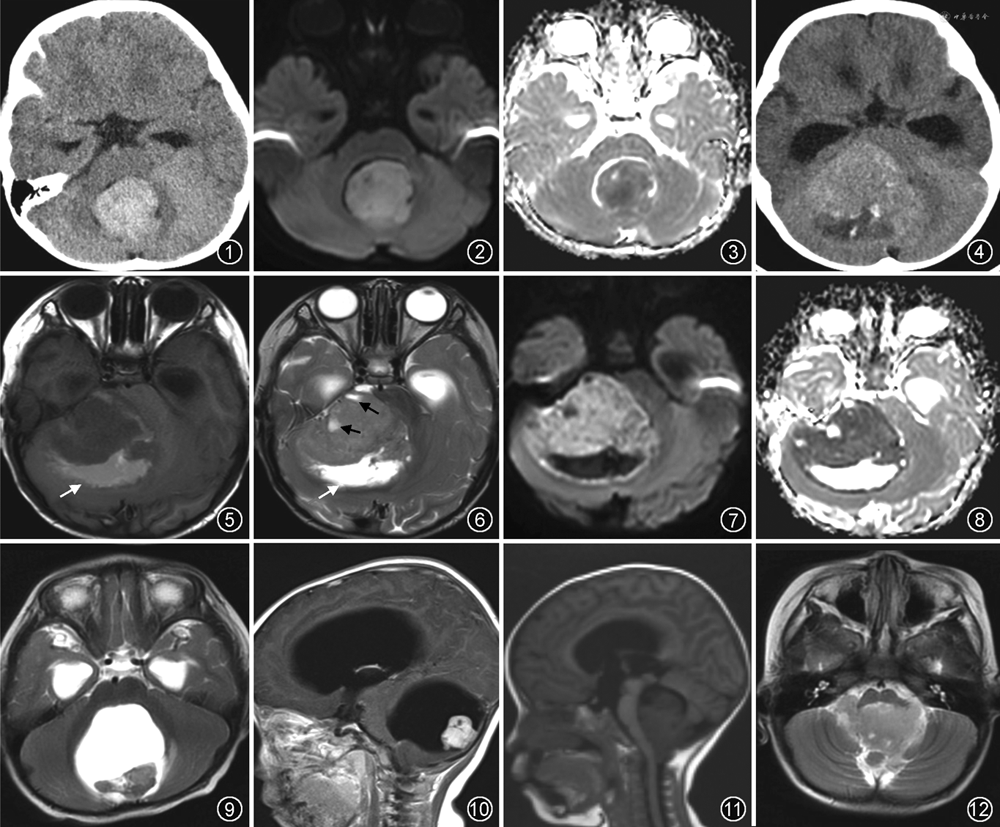
影像诊断要点:肿瘤体积通常较大,常见瘤周水肿,肿瘤呈囊实性,囊性部分多呈偏心性分布于肿瘤周边。CT表现为不均匀高密度肿块(图4),可伴有出血、囊变坏死和钙化,钙化并非其特异性表现。MRI显示肿瘤成分更加清晰,肿瘤整体呈混杂信号。MRI平扫实性部分于T1WI呈等信号,T2WI呈等-稍高信号;囊变坏死区于T1WI呈低信号,T2WI呈高信号,多位于肿瘤周边;肿瘤内出血可因出血所处的时期不同表现为不同信号(图5,6)。于DWI实性部分呈高信号(图7),ADC图信号减低(图8),是非典型畸胎样/横纹肌样瘤诊断的必要条件,原因为其属于小圆细胞恶性肿瘤,细胞密集度高,核质比大,水分子明显扩散受限[13]。MRI增强肿瘤呈不均匀强化,“曲带状”强化具有特征性[14]。非典型畸胎样/横纹肌样瘤恶性度高,部分病例发生脑脊液播散,可见柔脑膜强化。
毛细胞型星形细胞瘤属于良性肿瘤,生长速度较慢,WHO分级为Ⅰ级。儿童期任何年龄均可发生,好发于3~7岁,无明显性别差异。肿瘤好发于后颅窝,多见于小脑半球和蚓部。
影像诊断要点:肿瘤多为囊实性,瘤周水肿较轻,典型表现为囊性伴壁结节。CT平扫显示肿瘤边界清楚,囊性成分呈低密度,实性成分呈等密度,第四脑室呈受压表现。CT增强实性成分明显强化。MRI平扫肿瘤囊性部分于T1WI呈低信号,T2WI呈高信号,壁结节于T1WI和T2WI均呈等信号(图9),DWI示扩散受限不明显。MRI增强壁结节呈明显强化,囊性部分及囊壁无强化(图10)。少数情况下,当囊壁出现环形强化时说明囊性部分为肿瘤坏死形成。不典型情况下,毛细胞型星形细胞瘤也可表现为完全实性或不规则囊实性,增强后实性成分均可见强化,此时其与髓母细胞瘤或非典型畸胎样/横纹肌样瘤的主要鉴别点在于毛细胞型星形细胞瘤实性部分于DWI无明显扩散受限。
2016年WHO中枢神经系统肿瘤分类新定义的肿瘤实体中,将“弥漫性中线胶质瘤伴H3K27M突变型”划分为一类新的从属于弥漫性星形细胞和少突胶质细胞肿瘤的亚型,属于儿童型弥漫性高级别胶质瘤,WHO分级为Ⅳ级,恶性程度高,侵袭性强,预后差,2年生存率<10%[15]。该肿瘤多发生于儿童及青少年,无明显性别差异。肿瘤发生于中枢神经系统中线结构,儿童期多发生于脑干,以脑桥多见,也可发生于小脑半球、桥臂或幕上中线区。
影像诊断要点:肿瘤形态多不规则,边界尚清晰,脑干通常呈膨胀性改变,可部分包裹基底动脉,大多无瘤周水肿,有一定的占位效应。MRI敏感性高,肿瘤于T1WI呈等-稍低信号,T2WI呈稍高信号,肿瘤内可出现囊变,多为偏心性。DWI肿瘤可伴或不伴扩散受限。增强检查肿瘤强化形式多样,可从无强化到明显不均匀强化,出现强化时多为不规则环状、斑片状或结节状强化。需要注意的是,当肿瘤表现类似于脑干低级别胶质瘤时,如T1WI、T2WI信号较均匀,无囊变坏死,动脉自旋标记序列呈低灌注,DWI无明显扩散受限,增强后无强化或轻度强化,也不能轻易排除弥漫性中线胶质瘤伴H3K27M突变型的可能性,其仍可出现高级别肿瘤的生物学行为[16]。
室管膜瘤发病年龄为6个月~18岁,3~5岁为发病高峰,组织学分为经典型室管膜瘤(WHO分级Ⅱ级)和间变性室管膜瘤(WHO分级Ⅲ级)。随着分子学诊断指标的完善,发现室管膜瘤的分子特征与部位、年龄等因素密切相关[17]。后颅窝室管膜瘤表现为特征性的DNA甲基化谱,根据DNA甲基化、基因、治疗和预后将后颅窝室管膜瘤分为A组和B组[18]。A组发生于婴幼儿或年龄较小的儿童,平均发病年龄约3岁,男性略多于女性,发生部位多为第四脑室偏侧性,中心多位于第四脑室侧隐窝区,并向桥小脑角区延伸,预后较差。B组多见于年龄较大的儿童、青少年或成人,年龄多为10~17岁,女性略多于男性,发生部位多为第四脑室中线区,预后相对较好[19]。
影像诊断要点:CT表现为第四脑室内不均质肿块,多呈等-稍低密度,钙化常见,高达60%可见钙化,多伴有囊变坏死,也可伴有出血。肿瘤形态不规则,生长方式具有特点,可沿第四脑室侧孔向外生长(图11,12)。MRI平扫肿瘤呈混杂信号,实性部分于T1WI呈等-稍低信号,T2WI呈等-稍高信号;囊变坏死区于T1WI呈低信号,T2WI高信号;出血于T1WI呈高信号;肿瘤内钙化或流空血管于T1WI和T2WI均呈低信号。大多数情况下,DWI肿瘤扩散受限不明显,当肿瘤扩散受限明显时,提示其生物学级别增高,具有间变性趋势。增强检查肿瘤呈不均匀强化,实性部分呈轻-中度强化,强化方式不具特征性。
儿童后颅窝肿瘤的病理类型多样,CT对于发现肿瘤内钙化敏感,MRI是最佳影像学检查方法,能够更好地显示肿瘤的发生部位、生长方式、组成成分、毗邻关系、累及范围,特别是DWI及增强检查对于肿瘤的鉴别诊断具有重要作用,能够提高诊断的准确性。随着WHO中枢神经系统肿瘤分类的更新,分子学诊断指标的引入,希望影像学医师可以积极发挥和运用人工智能和影像组学技术建立儿童后颅窝肿瘤的多模态多参数影像评估体系,作出更加精准的诊断,为个体化治疗提供依据。
陈静, 王春祥, 李欣. 儿童后颅窝肿瘤的影像学诊断思路[J]. 中华放射学杂志, 2023, 57(6): 702-706. DOI: 10.3760/cma.j.cn112149-20230328-00222.
中华医学会放射学分会儿科学组对本栏目给予大力支持
所有作者声明无利益冲突
1.儿童后颅窝肿瘤中,最常见的胚胎性肿瘤类型是()
A.毛细胞型星形细胞瘤
B.髓母细胞瘤
C.室管膜瘤
D.弥漫性中线胶质瘤
2.下列关于髓母细胞瘤的表述,错误的是()
A.CT表现为低密度肿块
B.DWI肿瘤明显扩散受限
C.增强T1WI强化程度可多样
D.分子遗传学分类的各亚型中,SHH激活型伴TP53突变型和Group3型预后较差,可出现脑脊液播散
3.下列有关毛细胞型星形细胞瘤的表述,错误的是()
A.典型表现为大囊伴壁结节
B.肿瘤可以为囊实性,也可为完全实性
C.恶性度高,侵袭性强,预后差
D.儿童期后颅窝最常见的良性肿瘤
4.下列有关非典型畸胎样/横纹肌样瘤的表述,错误的是()
A.属于胚胎性肿瘤
B.发病年龄较小,多见于3岁以下婴幼儿
C.DWI肿瘤实性部分不会出现明显扩散受限
D.肿瘤多呈囊实性,囊性部分多为偏心性,多呈“曲带状”强化
5.下列有关室管膜瘤的表述,错误的是()
A.CT表现为第四脑室内高密度肿块
B.肿瘤内钙化常见
C.特征性表现为沿第四脑室侧孔向外生长
D.大多数情况下,DWI肿瘤扩散受限不明显,当肿瘤扩散受限明显时,提示其具有间变性趋势



























