
探索在神经重症患者中,电阻抗指标与目前临床常用营养指标的相关性。
本研究采用横断面研究,收集2022年6至9月上海中医药大学附属曙光医院神经外科重症患者58例,于术后或伤后1周对患者进行生物电阻抗检测,并于当天采集患者营养相关的生化指标,包括营养状况相关指标、炎症相关指标、贫血相关指标、血脂相关指标。对患者进行急性生理学慢性健康评估Ⅱ评分(APACHE Ⅱ评分)和序贯器官衰竭评分(SOFA评分),并根据所得结果进行Nutric营养评分,进行Spearman相关性分析,分析电阻抗与营养相关指标及营养风险相关指标的相关性;二元多因素logistic回归构建营养状况的预测模型;逐步回归法筛选与营养状况相关的电阻抗指标;绘制受试者工作特征(ROC)曲线,并计算曲线下面积(AUC)评估营养状况评估模型的评估能力。
共收集58例神经外科ICU患者,其中男33例,女25例,年龄72.0(59.0,81.8)岁。细胞外水(ECW)与白细胞介素6呈正相关(r=0.529,P<0.001);浮肿指数[ECW/身体总水分(TBW)]与白蛋白(r=-0.700,P<0.001)、红细胞压积(r=-0.641,P<0.001)、血红蛋白(r=-0.667,P<0.001)呈负相关;相位角(RA为右上肢相位角、LA为左上肢相位角、TR为躯干相位角、RL为右下肢相位角、LL为左下肢相位角)与白蛋白(rRA=0.667,rLA=0.649,rRL=0.669,rLL=0.685,均P<0.001)、红细胞压积(rRA=0.600,rLA=0.604,rTR=0.565,rRL=0.529,rLL=0.602,均P<0.001)、血红蛋白(rRA=0.626,rLA=0.635,rTR=0.594,rRL=0.624,rLL=0.631,均P<0.001)呈正相关。通过逐步回归筛选营养状况的评估因素,再将年龄、性别、白细胞作为混杂因素纳入模型后,得到最终模型为:营养状况=-0.01×年龄+1.22×性别-0.12×白细胞+202.20×ECW/TBW+0.5×躯干相位角-82.16,其中ECW/TBW的OR值为20.8(95%CI:3.7~117.1),P<0.001。该模型的AUC为0.921。
在神经重症患者中,生物电阻抗指标与目前临床常用营养指标有较好的相关性,可以作为营养状况的评估因素为临床神经重症患者营养评估提供新的方法。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经外科重症患者在伤后或术后的应激期会处于高分解、高代谢状态,需要足量补充能量[1]。目前国内外专家共识明确指出在神经外科重症患者早期(48~72 h)使用肠内营养,并在1周内逐渐达标,可以降低患者病死率,改善患者预后[2]。由于患者往往存在胃肠道不耐受、镇静镇痛、营养支持治疗不足等问题,即使给予早期营养支持,仍然会出现营养不足的情况[3]。所以对患者进行营养评估,进一步采取合理的营养干预措施对神经外科ICU患者至关重要。目前临床上危重患者常用的营养评估方法仍然是生化指标,如血清白蛋白、淋巴细胞数、前白蛋白等,但这些指标会受到炎症等其他因素的影响[4],不能准确反映患者营养状况。
生物电阻抗分析是一种简单无创的方法,其主要原理是通过发出微弱的电流来测定身体的阻抗值,进而计算出患者身体成分[5, 6]。研究表明,电阻抗可以与患者营养状况相关联,作为新的营养评估方法[7]。但由于国内电阻抗在神经重症患者中的使用仍不普及,因此很少将电阻抗用于神经重症患者的营养评估[8]。本研究将电阻抗指标与目前临床常用营养相关指标进行比较,旨在验证在神经重症患者的营养评估中,电阻抗指标与临床营养指标的相关性。
本研究采用横断面研究,回顾性收集上海中医药大学附属曙光医院2022年6—9月神经外科ICU患者资料。本研究符合《赫尔辛基宣言》对伦理的要求,并取得患者或家属的知情同意。(1)纳入标准:①神经外科ICU住院患者,ICU住院时间>7 d;②年龄>18岁。(2)排除标准:①安装起搏器或植入心脏除颤器的患者;②截肢患者;③腹腔积液患者。
1. 营养风险评估:于生物电阻抗检测当天对患者进行营养风险评估,首先对患者进行急性生理学慢性健康评估Ⅱ评分(acute physiology,age and chronic health evaluation Ⅱ,APACHE Ⅱ评分)和序贯器官衰竭评分(sequential organ failure assessment,SOFA评分),根据所得结果进行Nutric营养评分,将结果≥5分视为存在营养风险。在营养风险评分过程中进行了标准化控制,对评分人员进行了标准化培训。
2. 生物电阻抗测定:患者术后或伤后 7 d,使用Inbody S10电阻抗机器对患者进行电阻抗检测。患者仰卧位,双腿分开30~45度,分别于患者拇指、中指、踝关节两侧放置8个电极片,进行电阻抗检查,收集细胞内水分(intracellular water,ICW)、细胞外水分(extracellular water,ECW)、身体总水分(total body water,TBW)、浮肿指数(ECW/TBW)、骨骼肌、肌肉量、去脂体重、蛋白质、身体细胞量、水合率(TBW/FFM)、骨骼肌质量指数(skeletal muscle mass index,SMI)、四肢及躯干相位角。
3. 生化指标收集:于电阻抗检测当天对患者血液进行检测,收集与患者营养相关的指标,主要包括营养状况相关指标(白蛋白、前白蛋白、淋巴细胞数);炎症相关指标(C反应蛋白、白细胞介素6、降钙素原、白细胞数);贫血相关指标(红细胞压积、血红蛋白、转铁蛋白);血脂相关指标(胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇)。
所有的统计分析均使用统计软件R(版本4.2.1)进行,双侧检验,检验水准α=0.05,多重检验的P值进行了FDR校验。定量资料使用shapiro检验进行正态性检验,符合正态分布的定量资料使用进行描述,不符合正态分布的定量资料使用M(Q1,Q3)进行描述,定性资料使用例(%)进行描述。电阻抗指标和白蛋白指标之间的相关性使用Spearman相关性分析进行评估,当r>0.5且P<0.05时定义为两变量之间有相关性,并绘制相关性热图。使用二元多因素logistic回归构建白蛋白指标的预测模型,电阻抗指标的筛选使用逐步回归法。年龄、性别、白细胞作为混杂因素纳入到模型当中。绘制最终模型的受试者工作特征(receiver operating characteristic,ROC)曲线,并计算曲线下面积(area under curve,AUC)用于评估营养状况预测模型的预测能力。
共收集58例神经外科ICU患者,其中男33例,女25例,年龄72.00(59.00,81.75)岁,其中创伤性脑损伤21例,自发性脑出血18例,动脉瘤性蛛网膜下腔出血10例,肿瘤5例,脑脓肿4例。生化指标、营养风险指标及生物电阻抗指标水平见表1。

58例神经外科ICU住院患者生化与营养风险指标及电阻抗水平
58例神经外科ICU住院患者生化与营养风险指标及电阻抗水平
| 项目 | 结果 | 项目 | 结果 | |
|---|---|---|---|---|
| 生化与营养风险指标 | 电阻抗指标 | |||
| 白蛋白[g/L,M(Q1,Q3)] | 35.45(32.62,38.65) | 细胞内水分[L,M(Q1,Q3)] | 19.00(15.40,25.08) | |
| 淋巴细胞[×109/L,M(Q1,Q3)] | 0.99(0.68,1.32) | 细胞外水分[L,M(Q1,Q3)] | 12.65(10.80,16.38) | |
| 前白蛋白(mg/L,) | 161.87±78.44 | 身体总水分[L,M(Q1,Q3)] | 31.60(26.27,41.05) | |
| C-反应蛋白[mg/L,M(Q1,Q3)] | 43.46(15.18,70.66) | ECW/TBW[M(Q1,Q3)] | 0.41(0.39,0.41) | |
| 白细胞介素6[ng/L,M(Q1,Q3)] | 21.82(8.75,64.14) | 骨骼肌[kg,M(Q1,Q3)] | 22.75(18.10,30.75) | |
| 白细胞[×109/L,M(Q1,Q3)] | 9.08(6.99,13.78) | 肌肉量[kg,M(Q1,Q3)] | 40.45(33.30,52.55) | |
| 降钙素原[μg/L,M(Q1,Q3)] | 0.15(0.08,0.44) | 去脂体重[kg,M(Q1,Q3)] | 42.90(35.38,55.77) | |
| 转铁蛋白(mg/L,) | 17.67±5.56 | 蛋白质[kg,M(Q1,Q3)] | 8.25(6.70,10.78) | |
| 红细胞压积() | 0.33±0.06 | 身体细胞量[kg,M(Q1,Q3)] | 27.15(22.02,35.98) | |
| 血红蛋白(g/L,) | 109.34±20.76 | TBW/FFM(%,) | 73.87±0.57 | |
| 胆固醇(mmol/L,) | 3.48±1.36 | SMI(kg/m2,) | 6.45±1.68 | |
| 甘油三酯[mmol/L,M(Q1,Q3)] | 1.12(0.83,1.36) | 相位角 | ||
| 高密度脂蛋白胆固醇(mmol/L,) | 0.90±0.38 | RA(kHz,) | 3.72±1.11 | |
| 低密度脂蛋白胆固醇(mmol/L,) | 1.94±0.80 | LA[kHz,M(Q1,Q3)] | 3.40(2.73,4.40) | |
| APACHEAⅡ评分[分,M(Q1,Q3)] | 17.00(10.25,23.75) | TR(kHz,) | 3.97±1.54 | |
| SOFA评分[分,M(Q1,Q3)] | 3.50(1.00,6.00) | RL[kHz,M(Q1,Q3)] | 3.50(2.50,4.80) | |
| Nutric<5分[例(%)] | 34(58.6) | LL[kHz,M(Q1,Q3)] | 3.25(2.12,5.10) | |
| Nutric≥5分[例(%)] | 24(41.4) |
注:ICU为重症监护室;APACHEAⅡ评分为急性生理学慢性健康评估Ⅱ评分;SOFA评分为序贯器官衰竭评分;Nutric为重症营养风险评分;ECW/TBW为浮肿指数;TBW/FFM为水合指数;SMI为骨骼肌质量指数;RA为右上肢相位角;LA为左上肢相位角;TR为躯干相位角;RL为右下肢相位角;LL为左下肢相位角
ECW与白细胞介素6(r=0.529,P<0.001)呈正相关;ECW/TBW与白蛋白(r=-0.700,P<0.001)、红细胞压积(r=-0.641,P<0.001)、血红蛋白(r=-0.667,P<0.001)呈负相关;相位角(RA为右上肢相位角、LA为左上肢相位角、TR为躯干相位角、RL为右下肢相位角、LL为左下肢相位角)与白蛋白(rRA=0.667,rLA=0.649,rRL=0.669,rLL=0.685,均P<0.001)、红细胞压积(rRA=0.600,rLA=0.604,rTR=0.565,rRL=0.529,rLL=0.602,均P<0.001)、血红蛋白(rRA=0.626,rLA=0.635,rTR=0.594,rRL=0.624,rLL=0.631,均P<0.001)呈正相关(图1)。
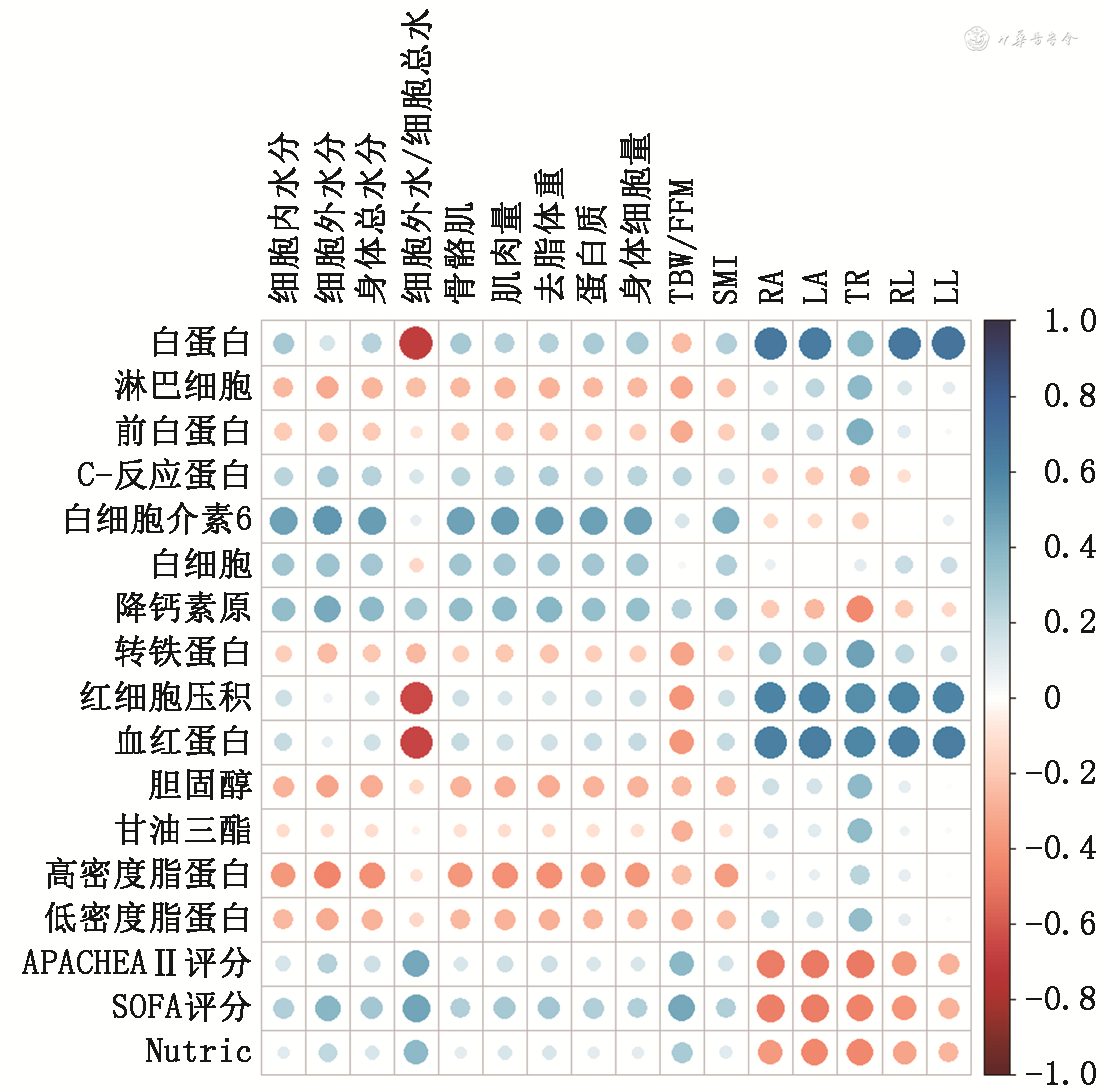

注:APACHEAⅡ评分为急性生理学慢性健康评估Ⅱ评分;SOFA评分为序贯器官衰竭评分;Nutric为重症营养风险评分;TBW/FFM为水合指数;SMI为骨骼肌质量指数;RA为右上肢相位角;LA为左上肢相位角;TR为躯干相位角;RL为右下肢相位角;LL为左下肢相位角
通过逐步回归筛选营养状况的预测因素,再将年龄、性别、白细胞作为混杂因素纳入模型后,得到最终模型为:营养状况=-0.01×年龄+1.22×性别-0.12×白细胞+202.20×ECW/TBW+0.5×躯干相位角-82.16,其中ECW/TBW的OR值为20.8(95%CI:3.7~117.1),P<0.001(表2)。该模型的AUC为0.921(图2)。
神经外科ICU患者电阻抗指标对营养状况的评估模型
神经外科ICU患者电阻抗指标对营养状况的评估模型
| 项目 | OR(95%CI) | P值 |
|---|---|---|
| 年龄 | 0.99(0.92~1.06) | 0.703 |
| 性别 | 3.39(0.59~19.32) | 0.143 |
| 白细胞 | 0.55(0.25~1.18) | 0.104 |
| ECW/TBW | 20.80(3.70~117.10) | <0.001 |
| TR | 2.08(0.74~5.89) | 0.136 |
注:ICU为重症监护室;ECW/TBW为浮肿指数;TR为躯干相位角;性别为分类变量,男性=1,女性=0;其他为连续性变量
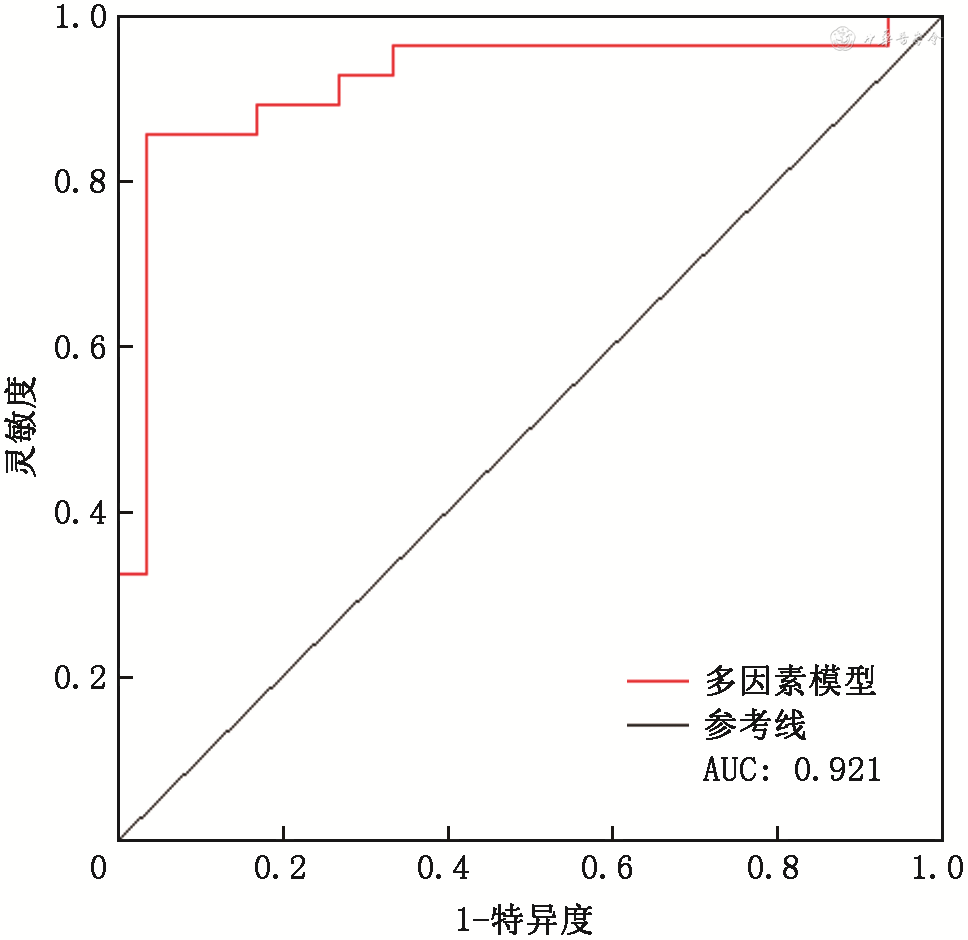

注:AUC为曲线下面积
神经外科ICU患者术后或伤后的应激期处于高分解、高代谢状态,对营养的需求比健康人高40%,会导致高血糖症、蛋白及能量消耗增加,国内外指南均建议神经外科重症患者应早期给予肠内营养,患者每天能量的目标量为25~30 kcal·kg-1·d-1,蛋白的目标量为1.2~2.0 g·kg-1·d-1[9]。但临床上仍然存在大量患者由于高消耗、高代谢、胃肠道不耐受等而存在营养不良、体重下降、免疫力下降、伤口愈合缓慢等状况[10],尤其是中老年人患者由于各项机体功能的衰退,这也增加了患者的感染风险,导致病死率增加[11],如不及时补充营养,势必会导致预后不良[1],因此,临床上及时对患者进行有效的营养评估是非常重要的。
生物电阻抗主要是通过对ICW和ECW的测量从而评估患者身体成分,大多用于对血透患者浮肿状态的评估[12],而有研究表明,电阻抗测量的身体成分的变化与能量和蛋白摄入量有显著相关性,并且神经外科专家共识也强调可以用生物电阻抗评估患者营养状况,但国内目前使用极少,因此本研究探讨了生物电阻抗用于神经重症患者营养评估的相关性,结果显示,电阻抗指标中ECW/TBW和相位角与白蛋白和贫血指标具有较好的相关性。在电阻抗指标建立的营养状况预测模型中也可以看出ECW/TBW和躯干相位角能够作为营养状况的预测因素,考虑到年龄、性别、炎症等混杂因素的影响,本研究将这些混杂因素纳入模型中,其预测能力AUC依然可以达到0.921,说明电阻抗不同于其他实验室指标,受炎症等混杂因素影响较小,是一个比较稳定的营养评估方法。之前有研究表明,ECW/TBW代表患者的浮肿指数,与患者病死率密切相关[13],因为在严重营养不良的情况下,ICW的减少相对导致了ECW/TBW的增高,其数值增高导致了流体的超载[14, 15]。而相位角则是通过电阻和电抗计算而来的,公式为(电抗/电阻)×(180°/π)[16],电抗是指组织的电容特性,与细胞数量、细胞大小和细胞膜的完整性有关,当电抗减小时,说明细胞膜结构受损及选择性滤过功能降低;电阻意味着组织的阻力特性,与瘦肉量和组织的水合作用有关,当电阻增大时,说明肌肉含量减少[17]。这也从理论上证明了相位角是衡量细胞质量和营养风险的指标。
神经重症患者长期卧床、肌肉运动较少,导致短时间内大量肌肉的损失。因此神经重症患者应更多重视通过评估患者肌肉情况来反映患者营养状况。对于肌肉的评估方法除了电阻抗外,还可通过B超、CT等方法进行评估。但这些方法受个体差异影响较大,且需要对患者进行前后对比才能正确反映患者营养状况。相比较来看,电阻抗是一个更加简单和准确的营养评估方法。此外,电阻抗指标中ECW/TBW以及相位角具有不受患者体重影响的优势,目前大多数的营养评估方法都不能脱离患者体重去独立评估,且国内大多数ICU未配备床秤,也对长期卧床患者营养评估造成了困难。而电阻抗在评估过程中不用测量患者体重,只需测量体长即可,这也让其在众多营养评估方法中占有优势。
当然本研究也存在不足:(1)本研究属于横断面研究,因果关系的论证能力不足,但考虑缺乏同类研究,本研究为后续前瞻性研究提供了方向。(2)样本量略小,但经过计算β>0.8,符合研究的样本量要求。(3)电阻抗本质上是对患者身体成分进行检测,所以会存在性别差异影响研究结果,本研究在营养状况预测模型中纳入性别作为混杂因素后,模型也具有较好的预测能力,说明电阻抗指标可以反映患者真实营养状况。
综上所述,生物电阻抗指标与营养状况指标有较好的相关性,电阻抗指标中ECW/TBW和相位角能较好地评估患者营养状况,低相位角和高ECW/TBW能够提示营养不良。
孙文超, 高小茜, 费欣一, 等. 生物电阻抗与神经重症患者营养状况的相关性分析[J]. 中华医学杂志, 2023, 103(23): 1787-1792. DOI: 10.3760/cma.j.cn112137-20221011-02126.
所有作者均声明不存在利益冲突



























