
探讨宏基因组学二代测序技术(mNGS)在新生儿疑难感染性疾病中的临床应用。
回顾性分析2019年9月至2020年12月于郑州大学第三附属医院新生儿科住院治疗且经脑脊液、肺泡灌洗液或血液病原菌mNGS技术确诊的不明原因发热、抗感染治疗效果欠佳、危重感染患儿的临床资料和病原学mNGS结果。
4例新生儿,其中男2例,女2例,起病年龄为生后5 h至26 d。2例患儿为脑炎/脑膜炎,其中例1患儿表现为发热、抽搐、昏迷,例2患儿长期抗生素治疗临床症状不能缓解且脑脊液细胞数不能恢复正常;例3患儿长期发热伴C-反应蛋白增高,例4患儿发热、咳嗽、呼吸窘迫。传统培养均未检出致病微生物,mNGS分别检测出人单纯疱疹病毒2型、微小脲原体、人类疱疹病毒5型、结核分支杆菌复合群。
mNGS有助于不明原因发热、治疗效果欠佳、危重感染等新生儿疑难病原体感染的诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
感染性疾病是新生儿期的重要疾病,是引起新生儿死亡的主要原因[1]。新生儿感染起病急、进展快、病原体复杂,短时间内能否明确病原微生物至关重要。临床工作中常有一些病例经过传统的病原微生物检测(包括形态学检测、培养分离、生化检测、免疫学和核酸检测)仍无法明确病原体,导致病程迁延或预后不佳。宏基因组学二代测序(metagenomics next-generation sequencing,mNGS)技术是一种新型的DNA/RNA检测技术,能够快速、精准地检测到病原体,适用于急危重症和疑难感染的诊断[2,3]。关于mNGS在成人重症感染性疾病的应用较多,相继有儿童感染性疾病方面的报道[4,5],但该技术在新生儿感染性疾病诊断中的应用报道较少。本研究回顾性分析了郑州大学第三附属医院经mNGS确诊的4例新生儿感染性疾病患儿的临床资料,旨在探讨mNGS在新生儿疑难感染性疾病中的临床应用价值。
例1 患儿,男,14 d,因"发热4 d,抽搐半天"由当地医院转入我院。入院后血常规示白细胞计数6.22×109/L,C-反应蛋白(C-reactive protein,CRP) 3.66 mg/L。脑脊液常规:细胞数23×106/L,多个核细胞10%,单个核细胞90%;脑脊液生化:蛋白2 909 mg/L,糖2.43 mmol/L,氯化物112 mmol/L;脑脊液培养、血培养和痰培养均未见致病菌生长。头颅MRI示:右额叶出血(亚急性期),双侧侧脑室旁微出血灶(图1A、B)。脑电图示异常脑电图,低电压活动。入院后先后给予哌拉西林他唑巴坦、美罗培南抗感染及对症治疗,患儿病情进行性加重出现持续抽搐、昏迷,复查血常规示白细胞计数12.52×109/L,CRP 0.43 mg/L。脑脊液常规:细胞数575×106/L,多个核细胞15%,单个核细胞85%;脑脊液生化:蛋白15 957 mg/L,糖2.12 mmol/L,氯化物114 mmol/L,脑脊液培养无致病菌生长;脑脊液mNGS结果:人单纯疱疹病毒2型(表1),完善血单纯疱疹病毒IgM及IgG阳性,风疹病毒IgM阳性,弓形虫IgM阳性。确诊单纯疱疹病毒脑炎,予阿糖胞苷抗病毒治疗,入院第10天出现呼吸衰竭予机械通气,家属考虑预后欠佳于入院第12天要求终止治疗。
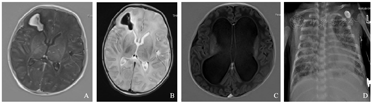

A、B:例1患儿头颅磁共振成像示右额叶出血(亚急性期),双侧侧脑室旁微出血灶,双侧小脑半球异常信号,双侧基底节区异常信号;C:例2患儿头颅磁共振成像示双侧脑室扩张,重度脑积水;D:例4患儿X线胸片示两肺野透过度减低,可见多发斑片致密影。

4例新生儿感染病例一般情况和宏基因组学二代测序结果
4例新生儿感染病例一般情况和宏基因组学二代测序结果
| 序号 | 年龄 | 性别 | 标本采集时间 | 报告时间 | 标本来源 | 致病微生物 | 序列数 | 基因覆盖度(%) | 转归 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 10 d | 男 | 生后21 d | 3 d | 脑脊液 | 人单纯疱疹病毒2型 | 8 071 | 放弃治疗 | |
| 2 | 5 h | 女 | 生后70 d | 3 d | 脑脊液 | 微小脲原体 | 6 961 | 53.022 367 | 治愈 |
| 3 | 23 d | 女 | 生后45 d | 3 d | 血液、脑脊液 | 巨细胞病毒 | 398 | 10.586 643 | 治愈 |
| 1 | 0.023 340 | ||||||||
| 4 | 26 d | 男 | 生后32 d | 2 d | 血液、肺泡灌洗液 | 结核杆菌复合群 | 5 | 好转 | |
| 1 758 | 2.926 104 |
例2 患儿,女,5 h,因"胎龄29+1周,生后呼吸困难5 h"入院。系试管婴儿双胎小婴儿,第2胎第2产,出生体重1 350 g,第1胎孕7个月早产生后夭折。入院后先后给予机械通气、持续气道正压无创呼吸支持、肺表面活性物质应用、抗感染、静脉营养等对症支持治疗。入院第19天无创辅助通气下出现呼吸暂停,反应差,肤色发花,经皮血氧饱和度不稳定。查血常规:白细胞计数33.26×109/L,中性粒细胞百分比77.5%,血红蛋白120 g/L,血小板计数435×109/L,CRP 12.67 mg/L。脑脊液常规示:细胞数1 244×106/L,多个核细胞95%,单个核细胞5%;脑脊液生化:蛋白2 785.6 mg/L,糖0.05 mmol/L,氯化物118 mmol/L;脑脊液培养:未见致病菌生长。诊断为新生儿化脓性脑膜炎,先后予美罗培南联合万古霉素、氟康唑联合头孢曲松及万古霉素、哌拉西林他唑巴坦联合头孢曲松及氟康唑治疗2月余,患儿反应仍差,脑脊液细胞数始终未恢复正常。患儿先后5次血培养,14次脑脊液培养,1次痰培养均无致病菌生长,入院73 d脑脊液mNGS结果检测到微小脲原体(表1),查头颅MRI示双侧脑室明显扩张,脑积水(图1C)。更改治疗方案为红霉素抗感染治疗1周后病情好转,脑脊液细胞数明显下降,3周后完全恢复正常,治愈出院,后入住小儿神经外科行脑室分流术,随访至1岁,患儿发育良好。
例3 患儿,女,23 d,因"发热5 h"入院。第1胎第1产,胎龄32+1周,出生体重2 300 g,人工喂养,2周前曾有过1次输血史。入院后患儿精神可,无咳嗽、抽搐等,体温波动在38~39 ℃,CRP波动在50 mg/L左右,X线胸片、脑脊液、骨髓穿刺和免疫功能检查均未见异常。先后给予氨苄西林、哌拉西林他唑巴坦联合阿奇霉素、美罗培南抗感染及更换深度水解蛋白配方喂养,效果欠佳,仍间断发热。入院15 d血及脑脊液标本mNGS均检出巨细胞病毒(cytomegalovirus,CMV)(表1),进一步完善检查示血CMV IgM及IgG抗体阳性,PCR法血CMV-DNA阴性,尿CMV-DNA阳性,予更昔洛韦抗病毒治疗,3 d后患儿体温恢复正常,CRP下降,抗病毒治疗5周后痊愈出院。
例4 患儿男,26 d,因"咳嗽7 d,发热3 d,呼吸困难15 h"由当地医院转入我院。第1胎第1产,胎龄34+1周,出生体重2 150 g,未接种卡介苗及乙肝疫苗。X线胸片示两肺炎症并间质性改变(图1D),血CRP 92.3~143.3 mg/L,入院后2次血培养、脑脊液培养未见异常,2次痰涂片见少量革兰阴性杆菌生长,未见致病菌生长,抗酸染色阴性,骨髓检查无异常。诊断为新生儿败血症及重症肺炎,先后给予美罗培南、万古霉素、利奈唑胺、氟康唑、卡泊芬净抗感染及机械通气等治疗,病情持续进展,科室疑难病例讨论认为非典型致病菌感染可能性大。入院第8天血和肺泡灌洗液mNGS标本均检测到结核杆菌复合群(表1),再次复查痰涂片示抗酸染色阳性,血结核抗体TB-(F6抗原)抗体IgG弱阳性,结核分支杆菌复合群基因阳性。之后获悉其母亲在患儿发病前已经出现低热、咳嗽,患儿确诊后其母亲在结核病专科医院亦确诊肺结核并给予抗结核治疗。该患儿确诊后转入专科医院给予病因治疗,治愈出院。
新生儿感染性疾病病原学快速、准确的诊断具有很大的挑战性,传统的主要病原学检测方法包括病原体染色、培养、免疫相关抗原抗体检测和核酸检测技术等,其不仅在检测的敏感性、特异性、时效性、信息量等方面存在局限,而且是基于临床假设的针对性检测,对于特殊或者未知的病原微生物,无法快速识别。mNGS技术能够快速、客观地检测临床样本中的较多病原微生物(细菌、真菌、病毒和支原体、衣原体等不典型病原体),为疑难危重症及罕见病原微生物感染的诊断提供了有效的技术手段[6,7,8]。该方法可同时检测样本中几乎所有的DNA/RNA信息,不需要预先猜测感染的可能病原体,克服了PCR、培养、免疫标志物等靶向诊断方法的局限性,因此能够发现少见病原体[9,10]。
目前常见的细菌检测方法是细菌培养和涂片,因需要一定的培养时间,并受抗生素的影响较大,其在时效性及敏感性方面存在一定缺陷,且特殊病原体培养需要一定的培养条件,因此细菌培养能覆盖的病原体范围有限。2018年北京儿童医院应用mNGS检测99例细菌性脑膜炎患儿脑脊液,检出的主要病原体是肺炎链球菌、B组链球菌、金黄色葡萄球菌、大肠埃希菌,与传统方法检测的结果相符合,由于mNGS检测不受采样时间及抗菌药物应用的限制,检出率有所提高[11]。Wilson等[12]研究发现,mNGS可以检出一些罕见及机会感染性病原体如奈瑟菌、诺卡菌等,表明mNGS对复杂病例的诊断十分有益。结核病的确诊有赖于病原学检测,包括抽胃液检测抗酸杆菌、培养、结核感染T细胞斑点试验和分子诊断技术Xpert MTB等,但以上技术存在周期长、敏感性差等不足,不能满足临床快速诊断的需要。研究表明mNGS能快速检测结核分支杆菌复合群,可以用于活动性结核病的早期辅助诊断[13,14]。本研究应用mNGS早期诊断新生儿结核病,患儿得到及时救治。因此,mNGS可以提高常见细菌的检出率,对一些罕见、疑难及特殊病原体的检测意义更大。
新生儿病毒感染临床表现不典型,病情凶险,病死率高,传统的检测方法包括病毒分离、血清抗原抗体检测和逆转录聚合酶链反应检测。病毒分离周期长,技术要求高,无法作为常规检测方法。血清抗原抗体检测和PCR技术能缩短时间,由于病毒种类和分型较多,且仍然是基于临床假设的针对性检测,无法快速检测出病原体及鉴定具体分型。mNGS检测无偏倚性,可检测出较多的病毒类型。尚永朋等[15]应用mNGS快速辅助诊断18例新生儿肠道埃可病毒感染,并早期鉴定具体分型为肠道埃可病毒18,而传统的检测方法未检测到病原体,个别病例肠道病毒通用PCR方法检测为阳性,但无法具体分型。新生儿单纯疱疹病毒脑炎临床表现不典型,病情凶险,病死率高,幸存者常遗留严重神经系统后遗症。脑脊液单纯疱疹病毒-DNA检测是目前诊断公认的金标准,特异性和敏感性高,但早期脑脊液检查可呈阴性结果。研究显示,对于单纯疱疹病毒感染,脑脊液mNGS具有重要的确诊价值,可在疾病早期协助诊断单纯疱疹病毒脑炎[16,17]。刘龙群等[18]报道了1例通过mNGS确诊的血流感染登革病毒病例。本研究2例患儿血液及脑脊液标本mNGS分别检测出人单纯疱疹病毒2型、巨细胞病毒,1例放弃治疗,1例根据检测结果调整用药治愈出院。表明mNGS对病毒的检测具有较高的敏感性,可以作为常规检测的有效补充,在新生儿未知病毒感染病原体快速鉴定中,mNGS具有重要的临床诊断价值。
目前临床上常用的检测方法不能早期有效地识别罕见病原体及某些不典型致病菌,而mNGS可以发挥巨大作用。有研究利用mNGS检测出军团菌,协助早期临床诊断[19,20]。Wilson等[12]应用mNGS检出一些罕见及机会感染病原体如奈瑟菌、诺卡菌等。在早产儿中,不明原因的脑积水和持续的脑脊液炎症很可能是微小脲原体、解脲支原体脑膜炎[21,22]。由于微小脲原体、解脲支原体的诊断需要特殊的液体培养基和特异的PCR,因此传统检测技术难以明确诊断。本研究利用mNGS诊断微小脲原体脑膜炎1例,目标靶向使用红霉素治疗,患儿治愈出院。因此,mNGS对于罕见、特殊及疑难病原体的检测意义重大。
综上所述,mNGS作为一种新型的微生物检测技术,测序速度快,敏感性高,对于早期精准识别新生儿感染性疾病病原体具有重要意义,但目前尚缺少mNGS结果分析和判读标准,尤其在区分背景微生物序列和病原微生物序列方面,存在一定的假阳性/假阴性概率,需结合临床特征、传统检测方法和治疗效果综合判断病原体是否具有真正的致病性[23]。因此,mNGS可以作为一种有效的补充手段,为传统检测技术难以诊断或治疗效果欠佳的新生儿感染性疾病提供参考。本研究的局限性在于病例数较少,不能通过统计学方法评价确切的效果;且目前mNGS检测方法较昂贵,临床上难以做到治疗前后检测结果的复查与对比。
所有作者均声明不存在利益冲突



























