
在前循环大血管闭塞性急性缺血性卒中患者中,探讨基线皮质静脉引流与血管内治疗后无效再通的关联。
回顾性收集2015年3月至2021年12月于复旦大学附属华山医院神经内科进行急诊血管内治疗的前循环大血管闭塞患者的临床及影像学资料,每例患者均进行基线美国国立卫生研究院卒中量表(NIHSS)评估。根据基线CT血管造影(CTA)图像上大脑中浅静脉、Trolard静脉和Labbé静脉的显影情况,采用0~6分的半定量评分系统评价缺血半球皮质静脉引流(VO)。发病后90 d对研究对象进行电话随访,采用90 d改良Rankin量表(mRS)评分评估功能预后。无效再通定义为血管再通[改良脑梗死溶栓(mTICI)分级达到2b级及以上]后的不良预后(90 d mRS评分 3~6分)。通过单因素分析和受试者工作特征(ROC)曲线寻找VO预测良好预后的最佳截断值。通过多因素logistic回归模型和基于赤池信息准则(AIC)的向后逐步回归进行变量筛选,分析缺血区VO与无效再通的关联。
共纳入150例患者,其中男92(61.3%)例,女58(38.7%)例,年龄[M(Q1,Q3)]71(61,78)岁,基线NIHSS评分[M(Q1,Q3)]为15(11,18)分。单因素分析显示,缺血区VO与血管内治疗后90 d良好预后相关(OR=1.587,95%CI:1.185~2.187)。根据ROC曲线将VO评分二分类,校正年龄、基线血糖、NIHSS、基线梗死核心体积、改良Tan评分(mTan)、低灌注强度比值(HIR)、病因分型、血管再通、出血转化及最终梗死体积后,VO评分≥4分是90 d良好预后的相关因素(OR=5.133,95%CI:1.530~19.361)。在91(60.7%)例成功再通(mTICI 分级2b级及以上)的患者中,44例未能获得良好功能预后。逐步回归发现,VO评分≥4分的患者血管再通后发生不良预后的风险较低(OR=0.234,95%CI:0.054~0.878)。在获得完全再通(mTICI 分级2c级及以上)的患者中,VO评分≥4分亦与更低的无效再通风险相关(OR=0.018,95%CI:0~0.255)。
缺血区VO能降低前循环大血管闭塞性卒中无效再通的风险。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血管内取栓治疗是目前急性缺血性卒中伴大血管闭塞最有效的治疗手段,循证医学已经证实其可以显著改善患者预后。但荟萃分析结果显示,尽管早期血管再通率显著提高,但仅1/4的患者能在发病90 d时重获功能独立[1, 2]。Hussein等[3]提出“无效再通”的概念描述这种现象,探究其预测因素对血管内治疗后不良预后的早期识别具有重要价值。既往研究陆续发现一系列危险因素,主要包括高龄、卒中严重程度、软脑膜侧支及最终梗死体积等[4, 5, 6, 7]。
至今,无效再通的机制仍不明确,但侧支循环可能在其中扮演重要角色[3, 4]。传统的侧支循环即指软脑膜侧支动脉,这一观点已逐渐被更新。颅内静脉系统作为神经血管网络的重要组成部分之一,同样具备自身调控机制以响应急性脑血管事件的发生,参与调节和维持脑组织的有效血流灌注,近年来被认为是侧支循环网络中不容忽视的部分[8]。其中,皮质静脉引流(venous outflow,VO)作为影像学标志物与卒中预后的相关性已经有一些研究证实[9, 10]。但是,其与无效再通现象的关联尚不清楚。
基于上述背景,本研究探索缺血区皮质静脉引流与前循环大血管闭塞性卒中患者无效再通的关联,旨在为这一群体治疗结局的预测以及临床治疗决策的制订提供新的辅助手段。
回顾性选择2015年3月至2021年12月就诊于复旦大学附属华山医院神经内科,接受急诊血管内治疗的前循环大血管闭塞性急性缺血性卒中患者。本研究经华山医院伦理委员会批准(KY2021-898)且获得知情同意。
1. 纳入标准:年龄≥18岁;发病24 h内;经头颈联合CT血管造影(CTA)证实前循环大血管闭塞,包括颈内动脉颅外或颅内段、大脑中动脉M1或M2段及串联病变(指颅内大血管闭塞伴颅外颈动脉病变);接受急诊血管内治疗;完成90 d随访。
2. 排除标准:基线CTA影像缺失或乙状窦/颈静脉球未显影;最终血管造影影像缺失。
1. 临床资料:收集研究对象的年龄、性别、既往病史(包括高血压、糖尿病、高脂血症、脑卒中或短暂性脑缺血发作、心房颤动)、吸烟史,抗栓药物治疗情况(包括病前连续6个月以上的抗血小板药物阿司匹林、氯吡格雷、西洛他唑和抗凝药物华法林、新型口服抗凝药、低分子肝素应用史),就诊时美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分,就诊时血压,就诊时血糖、血常规化验,发病至就诊时间,发病至基线影像采集时间,就诊至静脉溶栓时间(桥接取栓者),就诊至股动脉穿刺时间(door-to-puncture,DTP)以及根据类肝素药物治疗缺血性卒中试验(trial of Org 10172 in acute stroke treatment,TOAST)确定的病因分型。
2.影像学资料:(1)VO的评价方法:在基线头颅CTA中半定量评价缺血半球大脑中浅静脉、上吻合静脉(Trolard静脉)、下吻合静脉(Labbé静脉)的造影剂填充:0分:未显影;1分:与对侧半球相比部分显影;2分:完全显影。加总得到VO评分,分值0~6分,越高表示缺血半球静脉引流更充分[9, 10]。(2)软脑膜侧支的评价方法:在基线头颅CTA原始图或最大密度投影图上,采用改良Tan评分(modified Tan,mTan)评估大脑中动脉供血区软脑膜侧支血管充盈:0分:软脑膜侧支血管充盈<50%大脑中动脉供血区;1分:软脑膜侧支血管充盈≥50%大脑中动脉供血区[11]。(3)组织灌注的评价方法:基线头颅CT灌注使用商业软件MIStar(Apollo,澳大利亚墨尔本)进行后处理生成脑血流量、脑血容量、平均通过时间和延迟时间(delay time,DT)图谱。将相对脑血流量<30%定义为梗死核心,DT>3 s定义为低灌注[12]。错配比即低灌注区域与梗死核心的体积比。低灌注强度比值(hypoperfusion intensity ratio,HIR)指DT>2 s区域内DT>6 s的比例,用以评估低灌注的严重程度,反映脑组织侧支循环水平[12]。(4)血管再通的评价方法:所有患者接受急诊血管内取栓治疗,必要时可予球囊扩张及支架植入。根据改良脑梗死溶栓(modified thrombolysis in cerebral infarction,mTICI)分级评估取栓术后血管再通情况:0级:无再灌注,闭塞远端无前向血流;1级,微量血流通过闭塞区域但不能使远端血管床显影;2级:部分灌注,造影剂能通过闭塞段并使远端血管床部分显影;3级:完全灌注,远端血管床完全显影。其中,根据受累血管供血区域显影面积将mTICI分级 2级进一步划分:2a级:显影<50%;2b级:显影50%~99%;2c级:近全灌注,仅少数远端皮质血管血流缓慢或小栓塞[13]。
1. 出血转化的评价:发病后24~48 h随访头颅CT平扫,根据欧洲急性卒中协作研究-Ⅱ(ECASS-Ⅱ)分型定义颅内出血转化[14]。
2. 神经功能预后的评价:发病后90 d对研究对象进行电话随访。根据改良Rankin量表(modified Rankin scale,mRS)评价功能预后。其中,90 d mRS评分0~2分定义为良好预后,3~6分定义为不良预后。尽管血管再通(mTICI分级≥2b级),但未能获得良好预后者,被定义为无效再通。
采用SPSS 26.0及R 4.1.0进行统计分析。采用Kolmogorov-Smirnov检验对连续变量进行正态性检验。符合正态分布的计量资料用描述,单因素组间比较采用独立样本t检验;偏态分布的计量资料采用M(Q1,Q3)表示,单因素组间比较采用Mann-Whitney U检验;分类变量以频数及百分比表示,单因素组间比较采用χ2检验或Fisher精确检验。通过受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)反映预测指标的准确性;根据约登指数(即灵敏度+特异度-1)选取最佳截断值。采用logistic回归进行多因素分析,通过基于赤池信息准则的向后逐步回归进行变量筛选,计算各因素OR值和95%CI。双侧检验,检验水准α=0.05。
研究纳入急诊取栓的前循环大血管闭塞患者150例(筛选流程见图1)。男性92(61.3%)例,女性58(38.7%)例,年龄71(61,78)岁。研究人群中前三位危险因素分别为高血压(60.0%)、心房颤动(40.0%)和吸烟史(35.7%)。有29(19.3%)例患者既往有卒中或短暂性脑缺血发作(transient ischemia attack,TIA)史;22(14.7%)例患者此次发病前接受规律抗血小板治疗,17(11.3%)例接受抗凝治疗。就此次发病情况,基线NIHSS评分为15(11,18)分,就诊至股动脉穿刺时间156(126,190)min。大脑中动脉M1段闭塞的患者最多,为88(58.7%)例;其次为颈内动脉颅外段(15.3%)。91(60.7%)例患者获得血管再通(mTICI分级 2b~3级),55例(36.7%)几乎完全再通(mTICI分级 2c~3级)。随访90 d,有56(37.3%)例患者获得良好预后,33(22.0%)例患者死亡。
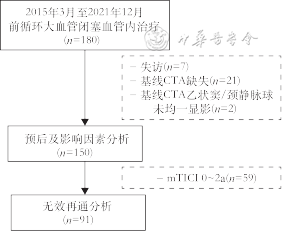

注:CTA为CT血管造影;mTICI为改良脑梗死溶栓
单因素分析显示VO评分是血管内治疗良好预后(OR=1.587,95%CI:1.185~2.187,P=0.003)的相关因素。根据约登指数选择VO评分预测良好预后的最佳截断值为3.5分(AUC=0.689,95%CI:0.592~0.786)(图2),并将VO评分≥4分定义为良好的静脉引流,VO评分<4分定义为不良静脉引流。校正年龄、基线血糖、NIHSS、基线梗死核心体积、mTan、HIR、病因分型、血管再通、出血转化及最终梗死体积等重要预后影响因素及临床相关因素后,VO评分≥4分是90 d良好功能结局(OR=5.133,95%CI:1.530~19.361,P=0.010)的影响因素。
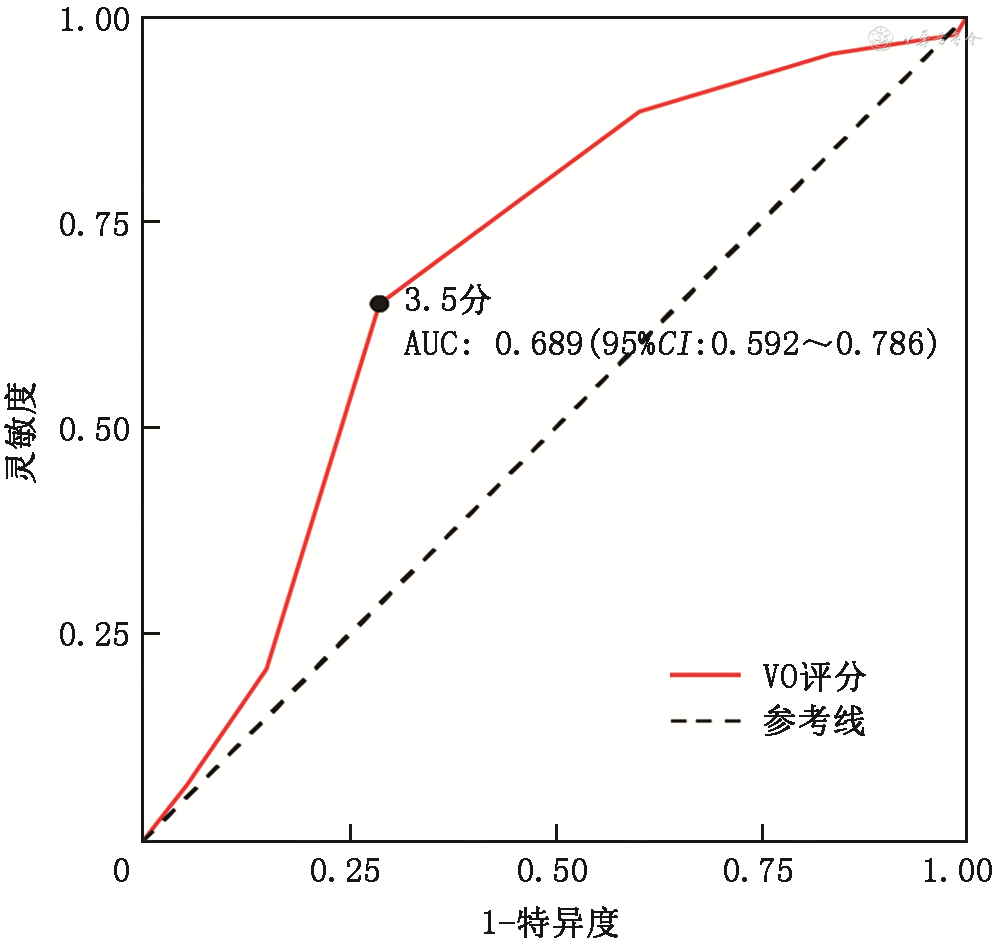

注:最佳截断值3.5分,灵敏度0.651,特异度0.712
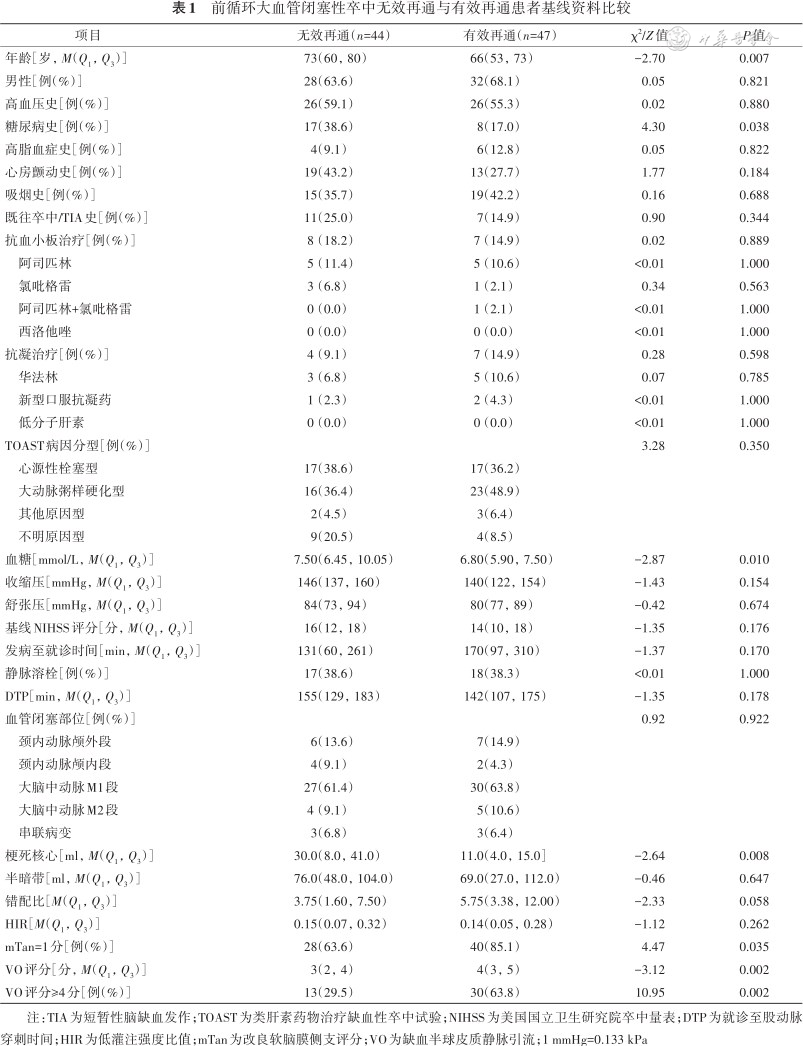
根据无效再通的定义,将91例血管内治疗后获得mTICI分级 2b级及以上再通的患者分为无效再通组(44例,48.4%)和有效再通组(47例,51.6%),比较基线临床及影像学特征(表1)。与获得有效再通的患者相比,无效再通的患者年龄更大(P=0.007),糖尿病患病率更高(P=0.038),相应基线血糖也较高(P=0.010);两组患者病前用药史、此次发病至就诊时间、基线NIHSS、血压等差异无统计学意义。在多模影像方面,无效再通的患者基线梗死核心体积较大(P=0.008),软脑膜侧支较差(P<0.05),缺血半球VO评分及VO评分≥4分的比例均低于有效再通者(均P<0.01)。
前循环大血管闭塞性卒中无效再通与有效再通患者基线资料比较
前循环大血管闭塞性卒中无效再通与有效再通患者基线资料比较
| 项目 | 无效再通(n=44) | 有效再通(n=47) | χ2/Z值 | P值 |
|---|---|---|---|---|
| 年龄[岁,M(Q1,Q3)] | 73(60,80) | 66(53,73) | -2.70 | 0.007 |
| 男性[例(%)] | 28(63.6) | 32(68.1) | 0.05 | 0.821 |
| 高血压史[例(%)] | 26(59.1) | 26(55.3) | 0.02 | 0.880 |
| 糖尿病史[例(%)] | 17(38.6) | 8(17.0) | 4.30 | 0.038 |
| 高脂血症史[例(%)] | 4(9.1) | 6(12.8) | 0.05 | 0.822 |
| 心房颤动史[例(%)] | 19(43.2) | 13(27.7) | 1.77 | 0.184 |
| 吸烟史[例(%)] | 15(35.7) | 19(42.2) | 0.16 | 0.688 |
| 既往卒中/TIA史[例(%)] | 11(25.0) | 7(14.9) | 0.90 | 0.344 |
| 抗血小板治疗[例(%)] | 8(18.2) | 7(14.9) | 0.02 | 0.889 |
| 阿司匹林 | 5(11.4) | 5(10.6) | <0.01 | 1.000 |
| 氯吡格雷 | 3(6.8) | 1(2.1) | 0.34 | 0.563 |
| 阿司匹林+氯吡格雷 | 0(0.0) | 1(2.1) | <0.01 | 1.000 |
| 西洛他唑 | 0(0.0) | 0(0.0) | <0.01 | 1.000 |
| 抗凝治疗[例(%)] | 4(9.1) | 7(14.9) | 0.28 | 0.598 |
| 华法林 | 3(6.8) | 5(10.6) | 0.07 | 0.785 |
| 新型口服抗凝药 | 1(2.3) | 2(4.3) | <0.01 | 1.000 |
| 低分子肝素 | 0(0.0) | 0(0.0) | <0.01 | 1.000 |
| TOAST病因分型[例(%)] | 3.28 | 0.350 | ||
| 心源性栓塞型 | 17(38.6) | 17(36.2) | ||
| 大动脉粥样硬化型 | 16(36.4) | 23(48.9) | ||
| 其他原因型 | 2(4.5) | 3(6.4) | ||
| 不明原因型 | 9(20.5) | 4(8.5) | ||
| 血糖[mmol/L,M(Q1,Q3)] | 7.50(6.45,10.05) | 6.80(5.90,7.50) | -2.87 | 0.010 |
| 收缩压[mmHg,M(Q1,Q3)] | 146(137,160) | 140(122,154) | -1.43 | 0.154 |
| 舒张压[mmHg,M(Q1,Q3)] | 84(73,94) | 80(77,89) | -0.42 | 0.674 |
| 基线NIHSS评分[分,M(Q1,Q3)] | 16(12,18) | 14(10,18) | -1.35 | 0.176 |
| 发病至就诊时间[min,M(Q1,Q3)] | 131(60,261) | 170(97,310) | -1.37 | 0.170 |
| 静脉溶栓[例(%)] | 17(38.6) | 18(38.3) | <0.01 | 1.000 |
| DTP[min,M(Q1,Q3)] | 155(129,183) | 142(107,175) | -1.35 | 0.178 |
| 血管闭塞部位[例(%)] | 0.92 | 0.922 | ||
| 颈内动脉颅外段 | 6(13.6) | 7(14.9) | ||
| 颈内动脉颅内段 | 4(9.1) | 2(4.3) | ||
| 大脑中动脉M1段 | 27(61.4) | 30(63.8) | ||
| 大脑中动脉M2段 | 4(9.1) | 5(10.6) | ||
| 串联病变 | 3(6.8) | 3(6.4) | ||
| 梗死核心[ml,M(Q1,Q3)] | 30.0(8.0,41.0) | 11.0(4.0,15.0] | -2.64 | 0.008 |
| 半暗带[ml,M(Q1,Q3)] | 76.0(48.0,104.0) | 69.0(27.0,112.0) | -0.46 | 0.647 |
| 错配比[M(Q1,Q3)] | 3.75(1.60,7.50) | 5.75(3.38,12.00) | -2.33 | 0.058 |
| HIR[M(Q1,Q3)] | 0.15(0.07,0.32) | 0.14(0.05,0.28) | -1.12 | 0.262 |
| mTan=1分[例(%)] | 28(63.6) | 40(85.1) | 4.47 | 0.035 |
| VO评分[分,M(Q1,Q3)] | 3(2,4) | 4(3,5) | -3.12 | 0.002 |
| VO评分≥4分[例(%)] | 13(29.5) | 30(63.8) | 10.95 | 0.002 |
注:TIA为短暂性脑缺血发作;TOAST为类肝素药物治疗缺血性卒中试验;NIHSS为美国国立卫生研究院卒中量表;DTP为就诊至股动脉穿刺时间;HIR为低灌注强度比值;mTan为改良软脑膜侧支评分;VO为缺血半球皮质静脉引流;1 mmHg=0.133 kPa
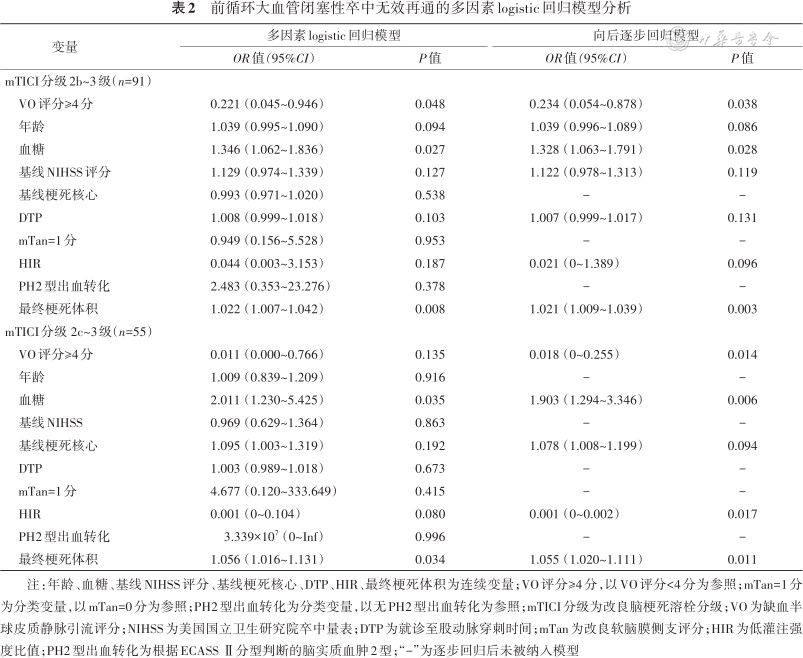
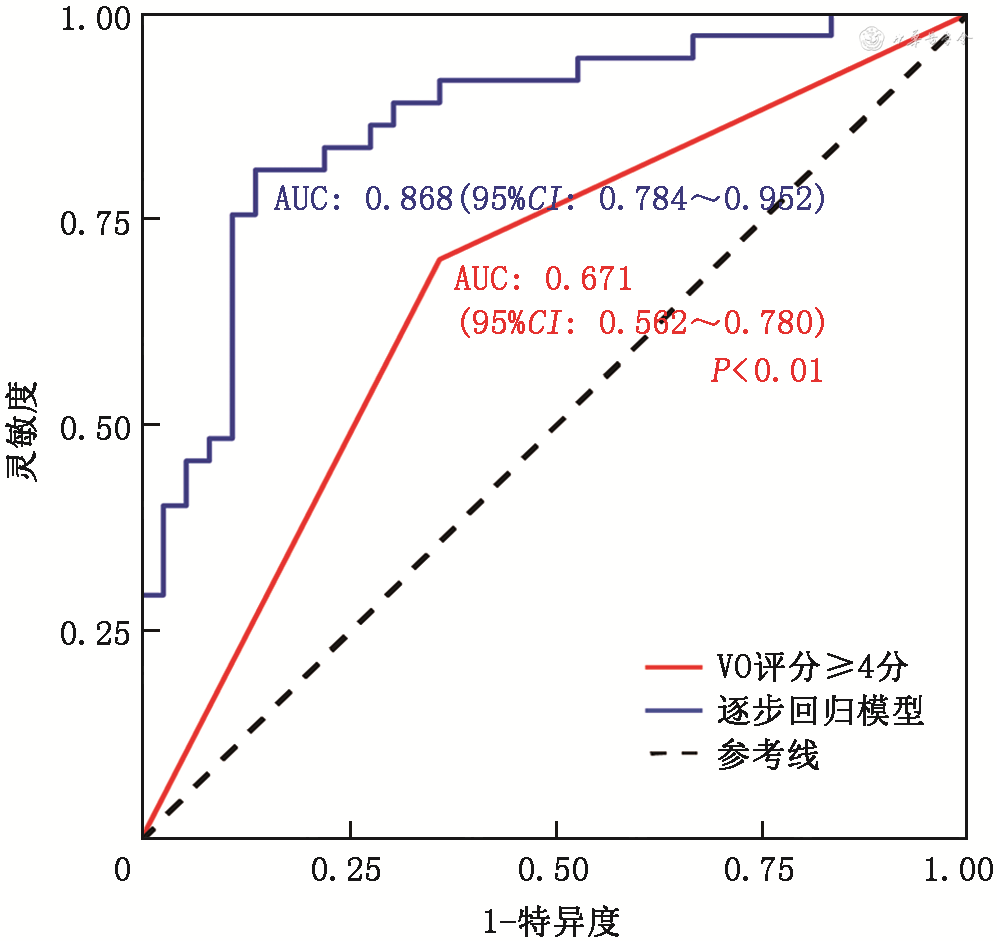
在91例血管再通的患者中进行多因素logistic回归分析(表2)显示,缺血半球良好的VO是血管无效再通的保护因素(OR=0.234,95%CI:0.054~0.878,P=0.038)。ROC曲线分析中(图3),由基线缺血半球VO评分≥4分、年龄、血糖、基线NIHSS、HIR、DTP和最终梗死体积构成的逐步回归模型,能较优地预测无效再通的发生(AUC=0.868,95%CI:0.784~0.952),其灵敏度为81.1%,特异度为86.1%。进一步在55例血管几乎完全再通(mTICI分级2c~3级)的患者中分析无效再通的影响因素(表2),结果提示缺血半球静脉引流较好的患者,血管再通后发生不良预后的风险较低(OR=0.018,95%CI:0~0.255,P=0.014)。另外发现,基线血糖(mTICI分级2b~3级再通,OR=1.328,95%CI:1.063~1.791,P=0.028;mTICI分级2c~3级再通,OR=1.903,95%CI:1.294~3.346,P=0.006)和最终梗死体积(mTICI分级2b~3级再通,OR=1.021,95%CI:1.009~1.039,P=0.003;mTICI分级2c~3级再通,OR=1.055,95%CI:1.020~1.111,P=0.011)是无效再通的影响因素。
前循环大血管闭塞性卒中无效再通的多因素logistic回归模型分析
前循环大血管闭塞性卒中无效再通的多因素logistic回归模型分析
| 变量 | 多因素logistic回归模型 | 向后逐步回归模型 | ||
|---|---|---|---|---|
| OR值(95%CI) | P值 | OR值(95%CI) | P值 | |
| mTICI分级2b~3级(n=91) | ||||
| VO评分≥4分 | 0.221(0.045~0.946) | 0.048 | 0.234(0.054~0.878) | 0.038 |
| 年龄 | 1.039(0.995~1.090) | 0.094 | 1.039(0.996~1.089) | 0.086 |
| 血糖 | 1.346(1.062~1.836) | 0.027 | 1.328(1.063~1.791) | 0.028 |
| 基线NIHSS评分 | 1.129(0.974~1.339) | 0.127 | 1.122(0.978~1.313) | 0.119 |
| 基线梗死核心 | 0.993(0.971~1.020) | 0.538 | - | - |
| DTP | 1.008(0.999~1.018) | 0.103 | 1.007(0.999~1.017) | 0.131 |
| mTan=1分 | 0.949(0.156~5.528) | 0.953 | - | - |
| HIR | 0.044(0.003~3.153) | 0.187 | 0.021(0~1.389) | 0.096 |
| PH2型出血转化 | 2.483(0.353~23.276) | 0.378 | - | - |
| 最终梗死体积 | 1.022(1.007~1.042) | 0.008 | 1.021(1.009~1.039) | 0.003 |
| mTICI分级 2c~3级(n=55) | ||||
| VO评分≥4分 | 0.011(0.000~0.766) | 0.135 | 0.018(0~0.255) | 0.014 |
| 年龄 | 1.009(0.839~1.209) | 0.916 | - | - |
| 血糖 | 2.011(1.230~5.425) | 0.035 | 1.903(1.294~3.346) | 0.006 |
| 基线NIHSS | 0.969(0.629~1.364) | 0.863 | - | - |
| 基线梗死核心 | 1.095(1.003~1.319) | 0.192 | 1.078(1.008~1.199) | 0.094 |
| DTP | 1.003(0.989~1.018) | 0.673 | - | - |
| mTan=1分 | 4.677(0.120~333.649) | 0.415 | - | - |
| HIR | 0.001(0~0.104) | 0.080 | 0.001(0~0.002) | 0.017 |
| PH2型出血转化 | 3.339×107(0~Inf) | 0.996 | - | - |
| 最终梗死体积 | 1.056(1.016~1.131) | 0.034 | 1.055(1.020~1.111) | 0.011 |
注:年龄、血糖、基线NIHSS评分、基线梗死核心、DTP、HIR、最终梗死体积为连续变量;VO评分≥4分,以VO评分<4分为参照;mTan=1分为分类变量,以mTan=0分为参照;PH2型出血转化为分类变量,以无PH2型出血转化为参照;mTICI分级为改良脑梗死溶栓分级;VO为缺血半球皮质静脉引流评分;NIHSS为美国国立卫生研究院卒中量表;DTP为就诊至股动脉穿刺时间;mTan为改良软脑膜侧支评分;HIR为低灌注强度比值;PH2型出血转化为根据ECASS Ⅱ分型判断的脑实质血肿2型;“-”为逐步回归后未被纳入模型

在全部150例患者中,根据VO评分分为两组。VO不良的人群中心源性栓塞型[46%(40/87)比28.6%(18/63),P=0.047]比例更高,大脑中动脉M1段闭塞更多见[65.5%(57/87)比49.2%(31/63),P=0.001],就诊时卒中病情也更严重[NIHSS:16(13,18)分 比 12(9,18)分,P=0.017]。两组患者软脑膜侧支及基线灌注参数比较差异均有统计学意义,VO不良的患者软脑膜侧支较差,同时脑组织低灌注范围更大、程度更重。由于其发病至就诊及影像时间较短,进一步计算早期梗死核心增长速度(基线梗死核心体积/发病至基线影像时间)可以发现,VO不良的患者发病早期梗死进展更快[0.09(0.02,0.20)ml/h 比 0.02(0.01,0.06)ml/h,P<0.001]。在基线血常规参数中,两组患者的外周血白细胞计数、血小板计数、中心淋巴比值、血小板淋巴比值差异均无统计学意义。
在纳入基线NIHSS、病因分型、血管闭塞部位、早期梗死核心增长速度、DT>3 s体积、HIR、mTan及中心粒细胞百分比的多因素分析(表3)中发现,软脑膜侧支丰富(mTan=1分,OR=6.232,95%CI:1.827~29.209,P=0.008)、低灌注区域面积较小(DT>3 s体积,OR=0.988,95%CI:0.978~0.997,P=0.010)的患者更易呈现良好的VO。
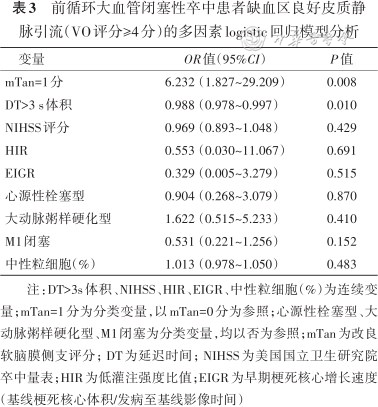
前循环大血管闭塞性卒中患者缺血区良好皮质静脉引流(VO评分≥4分)的多因素logistic回归模型分析
前循环大血管闭塞性卒中患者缺血区良好皮质静脉引流(VO评分≥4分)的多因素logistic回归模型分析
| 变量 | OR值(95%CI) | P值 |
|---|---|---|
| mTan=1分 | 6.232(1.827~29.209) | 0.008 |
| DT>3 s体积 | 0.988(0.978~0.997) | 0.010 |
| NIHSS评分 | 0.969(0.893~1.048) | 0.429 |
| HIR | 0.553(0.030~11.067) | 0.691 |
| EIGR | 0.329(0.005~3.279) | 0.515 |
| 心源性栓塞型 | 0.904(0.268~3.079) | 0.870 |
| 大动脉粥样硬化型 | 1.622(0.515~5.233) | 0.410 |
| M1闭塞 | 0.531(0.221~1.256) | 0.152 |
| 中性粒细胞(%) | 1.013(0.978~1.050) | 0.483 |
注:DT>3s体积、NIHSS、HIR、EIGR、中性粒细胞(%)为连续变量;mTan=1分为分类变量,以mTan=0分为参照;心源性栓塞型、大动脉粥样硬化型、M1闭塞为分类变量,均以否为参照;mTan为改良软脑膜侧支评分;DT为延迟时间;NIHSS为美国国立卫生研究院卒中量表;HIR为低灌注强度比值;EIGR为早期梗死核心增长速度(基线梗死核心体积/发病至基线影像时间)
以机械取栓为代表的血管内治疗是目前治疗大血管闭塞性卒中最为有效的方法,但仍有一定比例的患者未能从早期血管再通中获益。本研究中无效再通的发生率为48.4%,与既往研究相仿(40.5%~54.5%)[7,15, 16]。无效再通现象被认为可能与侧支循环不良、大面积低灌注以及血流自动调节受损有关[17, 18]。
近年来,研究者们开始将侧支循环视为由大血管和微血管构成的复杂循环网络,提出“侧支循环级联”的概念,从软脑膜侧支、组织灌注和静脉引流三个层面全面评估侧支循环,以深入了解卒中患者血流灌注的病理生理学[19, 20, 21, 22]。基于DEFUSE 3研究队列的回顾性分析发现以上三者并不平行:大量软脑膜侧支良好的患者静脉引流受阻;即使缺血脑组织低灌注尚轻,也有部分患者出现静脉引流不良[23]。本研究发现,尽管VO在一定程度上受到软脑膜侧支及组织低灌注程度影响,但其对功能预后与无效再通的预测均独立于二者。这些发现体现了VO在侧支循环网络中的相对独立性,对侧支循环中静脉成分的评估有其必要性。
目前,急性缺血性卒中患者VO受损的机制尚未阐明。与具有完整三层血管壁结构的小动脉不同,皮质静脉管壁缺乏平滑肌细胞,仅由内皮细胞构成[24]。急性缺血事件发生后,薄壁静脉受星形胶质细胞终足水肿的机械压迫而塌陷;以中性粒细胞为主的白细胞和血小板在小静脉中积聚、凝结并黏附于血管内皮形成微血栓阻塞小静脉,使其管腔闭塞、引流受阻[25, 26]。由于组织灌注压受动脉压和静脉压的共同调节,即使大血管完全开通,静脉引流受阻导致的微循环内静脉端压力升高将阻碍毛细血管床有效再灌注,导致脑组织进行性损害[9, 10,27, 28]。本研究中未发现外周血白细胞、血小板计数和反映中心粒细胞活化状态的中性淋巴比值等血液学参数与皮质静脉引流的相关性,推测可能是因为缺血超急性期,外周血难以反映颅内局部微循环变化。
除上述继发性改变外,颅内静脉系统的先天变异亦可能导致其显影不佳,评分低估。就本研究选取的三条皮质静脉,通过外科手术中对其分布的观察,Tanriverdi等[29]发现无论性别和侧别,大脑中浅静脉和Labbé静脉共优势是最常见的皮质静脉分布模式。因此,对三条皮质静脉的联合评估应能较为准确、综合地反映半球的静脉引流情况。在现有的影像学手段中,磁共振静脉血管成像和磁敏感加权成像也能评价颅内静脉系统,但其采集时间长、硬件要求高、存在金属禁忌,在讲究时效性的急性卒中临床诊疗实践中适用性有限;另一方面,对于存在颅内大血管闭塞的研究人群,其在检查过程中的合作度依赖于病情严重程度和意识状态,运动伪影将降低成像质量,影响影像评估的精确性。基于CTA的皮质静脉引流评价方法,简便、快速、可及性是其重要优势。
本研究存在一定的局限性。首先,纳入无效再通分析的样本量较小;其次,血栓负荷、取栓次数、围术期抗栓药物应用、住院期间并发症等可能导致血管内治疗不良结局的变量未包含在多因素分析中,可能造成偏倚。最后,受限于资料维度,本研究对VO的影响因素未能展开深入探索,此后的研究应结合机制进行挖掘。
综上,本研究发现缺血区良好的VO能降低前循环大血管闭塞性卒中无效再通的风险,从侧支循环的角度加深了对无效再通现象的理解,有助于更全面地识别和评估血管内治疗的风险,从而优化患者筛选、改善整体预后。作为侧支循环级联的最后一环,VO对于预后预测的准确性和优越性需要大样本临床研究进一步探索和证实。
李思源, 洪澜, 刘心雨, 等. 缺血区皮质静脉引流与前循环大血管闭塞性卒中无效再通的关联[J]. 中华医学杂志, 2023, 103(29): 2210-2217. DOI: 10.3760/cma.j.cn112137-20221230-02729.
所有作者声明不存在利益冲突



























